第4章结晶分离及升华技术
- 格式:ppt
- 大小:1.19 MB
- 文档页数:61
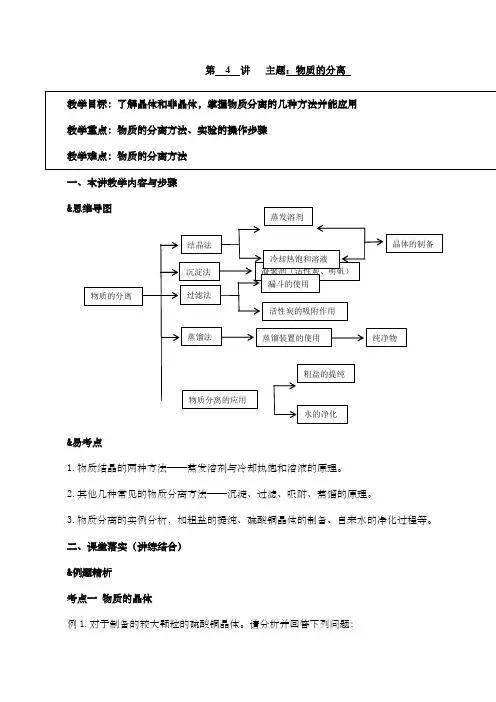
第 4 讲主题:物质的分离一、本讲教学内容与步骤&&易考点1.物质结晶的两种方法——蒸发溶剂与冷却热饱和溶液的原理。
2.其他几种常见的物质分离方法——沉淀、过滤、吸附、蒸馏的原理。
3.物质分离的实例分析,如粗盐的提纯、硫酸铜晶体的制备、自来水的净化过程等。
二、课堂落实(讲练结合)&例题精析考点一物质的晶体例1.对于制备的较大颗粒的硫酸铜晶体。
请分析并回答下列问题:(1)对于的物质,常采用冷却热饱和溶液结晶法。
先在较高温度下制得该物质的饱和溶液,然后使它冷却即可得相应的晶体。
(2)实验中我们发现,如果快速冷却热饱和溶液,那么得到的是颗粒(填“较小”或“较大”,下同)的结晶;如果缓慢冷却热饱和溶液,那么得到的是颗粒的结晶。
考点二结晶法的应用例2.认真阅读下表内容并仔细思考,下列叙述中正确的是()(多选)A.若将溶液A一次性恒温蒸发20g水,则析出晶体5gB.若将溶液B2再恒温蒸发10g水,则析出的晶体质量大于2gC.溶液C1、C2、C3的溶质的质量分数一定相同D.溶液B1、B2的溶质的质量分数相同,溶液C2、C3的溶质的质量分数分数也相同考点三结晶水合物例3.已知16g无水硫酸铜晶体吸水变成硫酸铜晶体后质量正好为25g。
在25℃时,向足量的硫酸铜饱和溶液中加入16g无水硫酸铜粉末,搅拌后静置,最终所得硫酸铜晶体的质量()A.等于16gB.等于25gC.大于16g而小于25gD.大于25g考点四常用的物质分离的方法例4.下列几种分离方法中,对水净化程度最高的是()考点五水的净化例5.净化水的方法有:①过滤;②加明矾吸附沉降;③蒸馏;④消毒杀菌。
自来水厂将混有泥沙的天然水净化成生活用的自来水,选用的方法和顺序为()A.①②③④B.②①④③C.①③④D.②①④&探究提升例.根据实验室进行的过滤操作,请回答下列问题:(1)过滤适用于分离混合物。
(2)过滤的操作要领可归纳为“一贴、二低、三靠”,其中的“一贴”指,否则会。

化学工程中的结晶技术一、结晶技术的定义与意义结晶技术是化学工程领域的一种重要分离和纯化技术,通过控制溶液中溶质的过饱和度,使其在一定条件下结晶沉淀出来,从而实现溶质的分离和纯化。
结晶技术在化学工业、药品生产、食品工业等领域具有广泛的应用,对于提高产品质量和生产效率具有重要意义。
二、结晶过程的基本原理1.过饱和度:溶液中溶质的浓度超过其在特定温度和压力下饱和溶解度时,称为过饱和溶液。
过饱和溶液中的溶质容易形成晶体。
2.成核:过饱和溶液中的溶质分子在适当的条件下,开始聚集并形成微小的晶体核。
3.晶体生长:溶液中的溶质分子不断向晶体核上吸附,使晶体核逐渐长大,形成完整的晶体。
4.晶体分离:通过控制溶液的温度、浓度、搅拌速度等条件,使晶体在一定时间内达到所需的尺寸和纯度,然后将晶体与溶液分离。
三、结晶技术的分类及应用1.冷却结晶:通过降低溶液的温度,使溶质过饱和并结晶沉淀。
适用于溶解度随温度变化较大的物质。
2.蒸发结晶:通过蒸发溶液中的溶剂,使溶质过饱和并结晶沉淀。
适用于溶解度随温度变化不大的物质。
3.盐析结晶:通过加入适当的盐类,降低溶液中溶质的溶解度,使其结晶沉淀。
适用于蛋白质、酶等生物大分子的分离和纯化。
4.超滤结晶:利用超滤膜对溶液中溶质的选择性透过作用,使溶质在膜表面结晶沉淀。
适用于高分子物质的分离和纯化。
四、结晶操作的影响因素1.温度:温度对溶质的溶解度有显著影响,通过控制温度可以调节溶质的过饱和度,从而控制结晶过程。
2.浓度:溶液中溶质的浓度越高,过饱和度越大,结晶速度越快。
3.搅拌速度:搅拌可以增加溶质与溶剂的混合程度,有利于晶体的均匀生长。
但过快的搅拌速度可能导致晶体形态的不规则。
4.溶剂选择:溶剂的性质会影响溶质的溶解度和结晶速度,选择合适的溶剂可以提高结晶效率。
五、结晶技术的展望随着科学技术的不断发展,结晶技术在化学工程中的应用越来越广泛。
未来的结晶技术将更加注重绿色环保、节能高效,通过新型材料、智能控制系统等先进技术,实现结晶过程的优化和自动化,进一步提高产品质量和生产效率。



一、实验目的1. 理解重结晶和升华的原理及其在化学实验中的应用。
2. 掌握重结晶和升华的基本操作步骤。
3. 通过实验,学习如何提高有机化合物的纯度。
二、实验原理1. 重结晶原理:利用物质在不同温度下溶解度的差异,将混合物中的杂质与目标物质分离。
通常,将混合物溶解在溶剂中,加热至高温使物质完全溶解,然后缓慢冷却,使目标物质以晶体形式析出,而杂质则留在溶液中或析出在较低温度下。
2. 升华原理:某些固体物质在加热时不经过液态,直接从固态转变为气态,再冷凝成固态。
这一过程可以用来分离和纯化这些物质。
三、实验试剂与仪器试剂:- 粗苯甲酸- 粗乙酰苯胺- 蒸馏水- 活性炭- 乙醇- 甲醇- 氯仿仪器:- 烧杯- 玻璃棒- 铁架台- 漏斗- 滤纸- 布氏漏斗- 抽滤瓶- 循环水真空泵- 酒精灯- 三脚架- 石棉网- 药匙- 胶头滴管- 火柴四、实验步骤1. 重结晶实验(1)取约0.5g粗苯甲酸晶体置于100mL烧杯中,加入50mL蒸馏水。
(2)在三脚架上垫一石棉网,将烧杯放在石棉网上,点燃酒精灯加热,不时用玻璃棒搅拌(注意:搅拌时玻璃棒不要触及烧杯内壁)。
(3)待粗苯甲酸全部溶解,停止加热。
(4)将烧杯中的混合液趁热过滤。
(5)将滤液静置冷却,观察烧杯中晶体的析出。
(6)将析出苯甲酸晶体的混合液过滤,滤纸上为苯甲酸晶体。
(7)用适量蒸馏水洗涤过滤器中的苯甲酸晶体。
2. 升华实验(1)取约0.5g粗乙酰苯胺晶体置于烧杯中。
(2)将烧杯放在石棉网上,点燃酒精灯加热。
(3)观察乙酰苯胺晶体逐渐升华,形成蒸汽。
(4)将蒸汽导入冷却的锥形瓶中,冷凝成固体。
(5)收集升华后的乙酰苯胺晶体。
五、实验结果与分析1. 重结晶实验通过重结晶实验,我们得到了较纯的苯甲酸晶体。
实验过程中,观察到溶液温度升高时苯甲酸溶解度增加,冷却后苯甲酸晶体析出。
通过热过滤和冷却结晶,成功将杂质与苯甲酸分离。
2. 升华实验通过升华实验,我们得到了较纯的乙酰苯胺晶体。

《升华和结晶》说课稿升华和结晶说课稿一、说课目标本节课的目标是让学生了解和掌握升华和结晶这两种物质状态转变的基本概念和特点,培养学生的观察、实验和思维能力。
二、教学重点和难点教学重点1. 升华和结晶的定义和区别。
2. 升华和结晶过程中的能量变化。
3. 能够运用所学的知识解释常见的升华和结晶现象。
教学难点1. 引导学生理解升华和结晶的微观机理。
2. 培养学生进行实验观察和实验数据分析的能力。
三、教学准备1. 教学工具:投影仪、实验演示材料、实验器材、玻璃片等。
2. 教学资源:课件、实验手册、教学录像等。
3. 学生实验用品:酒精灯、锥形瓷口瓶、亚砜、冰块等。
四、教学过程导入(5分钟)通过播放一个升华和结晶的实验视频,引起学生的兴趣,激发学生的思考和探索欲望。
知识讲解(15分钟)1. 介绍升华和结晶的基本概念和定义。
2. 解释升华和结晶过程中的能量变化。
3. 分别列举一些常见的升华和结晶现象,如干冰升华、盐结晶等。
实验演示(20分钟)1. 使用酒精灯加热冰块,观察冰块的变化并解释。
2. 使用烧杯加热亚砜,观察亚砜的变化并解释。
实验操作(30分钟)1. 学生分组进行实验操作,观察不同物质在加热过程中的状态变化,并记录实验数据。
2. 学生根据观察和数据分析,验证升华和结晶的特点和机理。
拓展应用(10分钟)提出一些拓展问题,让学生运用所学的知识解释一些常见的升华和结晶现象,如水汽的升华、盐类晶体的生长等。
总结归纳(10分钟)让学生总结和归纳本节课学到的关于升华和结晶的知识和经验,并进行课堂小结。
五、作业布置1. 要求学生写一篇关于升华和结晶的实验报告。
2. 教师提供一些额外阅读资料,让学生进一步了解升华和结晶的应用领域。
六、教学反思通过本堂课的设计和实施,学生对升华和结晶的基本概念和特点有了较好的理解,能够通过实验和观察来验证和解释升华和结晶现象。
同时,通过拓展应用和实验报告的任务,培养了学生的自主学习和探究能力。

重结晶升华的实验报告重结晶升华的实验报告引言:实验室是科学探索的殿堂,而化学实验则是其中一道道神秘的门。
在化学实验中,重结晶升华是一种常见的技术手段,用于纯化和分离化合物。
本文将介绍一次关于重结晶升华的实验,并探讨其原理、步骤和结果。
实验原理:重结晶升华是通过溶解物质,再通过降温或加热使其重新结晶的过程。
在溶液中,当溶质的溶解度超过饱和度时,溶质会从溶液中结晶出来。
而升华则是指固体直接从固态转变为气态,而不经过液态。
利用这两种原理,我们可以通过重结晶升华来纯化和分离化合物。
实验步骤:1. 准备:首先,我们需要准备所需的材料和设备,包括待纯化的化合物、溶剂、烧杯、玻璃棒、过滤纸等。
2. 溶解:将待纯化的化合物加入适量的溶剂中,并加热搅拌,使其充分溶解。
3. 过滤:将溶解后的溶液通过滤纸过滤,以去除其中的杂质和固体颗粒。
4. 冷却:将过滤后的溶液置于冷却器中,降低温度,使其逐渐结晶。
5. 结晶:观察溶液中是否出现晶体,如果没有,可以通过轻轻搅拌或加入少量的结晶种子来诱导结晶。
6. 分离:将结晶物通过过滤或离心的方式与溶剂分离。
7. 干燥:将分离得到的结晶物置于通风处,使其自然干燥。
实验结果:通过以上步骤,我们成功地进行了一次重结晶升华实验,并得到了纯净的结晶物。
在实验中,我们使用了硫酸铜作为待纯化的化合物,水作为溶剂。
在加热搅拌后,硫酸铜完全溶解在水中,形成了一个蓝色的溶液。
经过过滤和冷却后,我们观察到溶液中出现了蓝色的结晶。
通过过滤和干燥,我们成功地分离出了纯净的硫酸铜结晶。
讨论与分析:重结晶升华是一种常用的纯化和分离技术,其原理简单而有效。
通过控制溶剂的温度和浓度,我们可以使化合物重新结晶并分离出纯净的晶体。
然而,在实际操作中,一些因素可能会影响重结晶升华的效果,如溶剂的选择、溶解度的控制和结晶速度的调节等。
因此,在进行重结晶升华实验时,我们需要仔细控制这些因素,以确保实验的成功。
结论:通过本次实验,我们深入了解了重结晶升华的原理和步骤,并成功地进行了一次实验。

重结晶及升华实验报告重结晶及升华实验报告引言:在化学实验中,重结晶和升华是两种常见的分离纯化技术。
通过这两种方法,可以将混合物中的杂质分离出来,得到纯净的物质。
本实验旨在通过重结晶和升华两种方法,对混合物进行纯化,并探究其原理和应用。
实验一:重结晶1. 实验目的通过重结晶方法,分离出混合物中的杂质,得到纯净的结晶物质。
2. 实验步骤(1)取一定量的混合物,加入适量的溶剂,进行搅拌,使混合物溶解。
(2)加热溶液,使其达到饱和状态。
(3)将溶液冷却至室温,并过滤得到结晶。
(4)用冷溶剂洗涤结晶,以去除残留的杂质。
(5)将结晶干燥,得到纯净的物质。
3. 实验结果经过重结晶处理后,混合物中的杂质被分离出来,得到了纯净的结晶物质。
通过比较重结晶前后的物质性质,可以验证纯化效果。
4. 实验原理重结晶是利用溶解度差异的原理进行分离纯化的方法。
在加热溶液时,溶质的溶解度会随温度升高而增加,而冷却溶液时,溶质的溶解度则会减小。
通过控制温度,可以使溶质在高温下溶解,在低温下结晶出来,从而实现分离纯化的目的。
实验二:升华1. 实验目的通过升华方法,将混合物中易升华的物质分离出来,得到纯净的升华物质。
2. 实验步骤(1)取一定量的混合物,加热,使易升华的物质升华。
(2)将升华物质收集起来,得到纯净的物质。
3. 实验结果经过升华处理后,混合物中易升华的物质被分离出来,得到了纯净的升华物质。
通过比较升华前后的物质性质,可以验证纯化效果。
4. 实验原理升华是指固体直接从固态转变为气态,然后再由气态转变为固态,而不经过液态的过程。
在加热时,易升华的物质会直接从固态转变为气态,而杂质则不易升华,仍保持在固态。
通过控制温度和收集方式,可以将升华物质分离出来,得到纯净的物质。
讨论与结论:重结晶和升华是常用的纯化技术,广泛应用于化学实验和工业生产中。
通过本实验的操作,我们成功地将混合物中的杂质分离出来,得到了纯净的结晶物质和升华物质。


初中化学结晶技术教案
目标:通过本节课的学习,学生能够了解结晶技术的基本原理和应用,掌握结晶技术的操作步骤。
教学重点:结晶技术的原理、结晶过程中的操作技巧。
教学难点:掌握结晶技术的操作步骤,并能够运用到实际问题中。
教学准备:
1. 实验室器材:烧杯、试管、玻璃棒、燃烧器等。
2. 实验物品:氯化钠、硫酸铜、硫酸钠等。
3. PPT课件:结晶技术的基本原理及操作步骤。
教学过程:
一、导入(5分钟)
1. 引入结晶技术的概念,让学生了解结晶技术在化学实验中的重要性。
二、理论知识教学(10分钟)
2. 介绍结晶技术的基本原理和结晶的定义。
3. 讲解结晶的条件和影响结晶的因素。
三、实验操作演示(15分钟)
4. 演示结晶实验的操作步骤,并让学生观察实验过程。
5. 解释实验中出现的现象,并让学生思考结晶的形成原理。
四、实践操作(20分钟)
6. 分组进行结晶实验操作,老师辅导学生操作,并及时纠正错误。
7. 学生进行实验操作后,展示结晶的结果并做总结。
五、小结(5分钟)
8. 对本节课内容进行总结,强调结晶技术的应用和实验中的注意事项。
教学反馈:
1. 学生完成结晶实验报告,对实验过程和结果进行总结。
2. 学生回答相关问题,检查学生对结晶技术的理解程度。
板书设计:
结晶技术
- 基本原理
- 操作步骤
- 应用场景
扩展阅读:
1. 《化学实验》
2. 《结晶技术在实验室中的应用》
注:本节课时长为45分钟,根据教学情况适当调整时间。

结晶分离技术2008-1-23 阅读次数:2092次结晶(沉淀)分离技术是化工生产中从溶液中分离化学固体物质的一种单元操作,在湿法冶金过程占有十分重要地位。
从湿法冶金溶液中以固体形式分离、回收有价组分常采用结晶、沉淀等操作过程,而又以反应结晶过程居多。
世界上有数百家铀水冶厂,用离子交换法或萃取法从庞大的矿石浸出液中浓集提取铀,得到了浓度较高的含铀的纯化溶液—合格淋洗液或反萃取液。
从这种纯化溶液中沉淀(结晶)铀的浓缩物送纯化工厂进一步精炼,得到核能纯的铀产品。
沉淀铀浓缩物的过程就是一个化学结晶(沉淀)过程。
当向纯化溶液(硫酸铀酰、硝酸铀酰等)中添加沉淀剂:NaOH、NH3H2O、MgO 等的溶液时,立即沉淀(结晶)出重铀酸盐浓缩物(131,黄饼等)中间产品。
铀由水溶液中转化成了固态形式,品位和纯度大大的提高,体积大大减少,给下一步工序的加工带来许多方便,生产设备、规模大大减少。
反应沉淀(结晶)过程一般分为三个步骤:(1)溶液形成过饱和溶液,(2)晶核生成和晶粒生长,(3)沉淀(结晶)的生成和陈化。
图1示出了结晶的三个步骤。
在一定的条件下,沉淀(结晶)能否生成或生成的沉淀是否溶解,取决于该沉淀的溶度积。
当沉淀剂加入溶液中时,mAn++nBm-=AmBn(固)↓,形成的离子浓度的乘积Q=[An+]m[Bm-]n大于沉淀物的溶度积(Ksp),即Q>Ksp时,形成了过饱和溶液,图1结晶过程的三个步骤离子通过互相碰撞形成微小的晶核——成核过程;晶核形成后溶液中的构晶离子向晶核表面扩散,并沉积在晶核上——晶核生长;晶核就逐渐长大成晶粒;晶粒进一步聚集、定向排列成晶体,如果来不及定向排列则成为非晶粒沉淀。
工业生产中一般情况下希望生成粗大的结晶产品,有利于下一步的固液分离操作。
影响结晶的因素很多,如过饱和度、浓度、PH值、同离子效应、络合效应、搅拌强度、沉淀剂的加入速度,甚至两种溶液加入先后顺序都有影响。
要使晶体能够生成,必须首先形成过饱和溶液,但过饱和度太大,易产生大量的晶核,形成细小的晶粒或非晶形沉淀,甚至形成胶体,所以过饱和度必须恰当;为了减少沉淀的溶解损失,应加入过量的沉淀剂,利用共同离子效应来降低沉淀的溶解度,但不可加入太多,过量太多的沉淀剂可能引发络合效应,反而使沉淀物的溶解度增大,甚至造成反溶;沉淀过程中要严格控制酸碱度,一般控制在PH1-14的范围内,酸碱度太高或太低时,要么沉淀的不完全,要么沉淀物重新溶解。
第四章产物的分离和提纯产物是指从反应器中出来的物料。
大多数反应产物都是混合物,它包括未反应掉的原料和反应生成物。
气相反应器和气固相反应器的产物主要是气体产物和夹带的催化剂粉尘;液相反应器的产物主要是液体产物与液固混合物;气液相和气液固三相反应器的产物则有气体产物、液体产物和液固混合物。
产物的分离和提纯是化工生产中的重要环节,它不仅可以由产物中分离出所需要的产品,并进一步提纯至一定产品的规格,还可以使未反应的物料得以循环利用。
因此,产物的分离和提纯操作对保证产品质量和生产过程的经济效益起着重要作用。
一、分离方法概述第一节产物分离的原则在化工生产中,产物的分离方法可分成机械分离和传质分离两大类。
一般来讲,非均相混合物的分离主要采用机械分离法;均相混合物的分离采用传质分离法。
1.机械分离机械分离法用于分离非均相混合物。
非均相混合物分为气态非均一系和液相非均一系两大类。
在工业生产中,用于分离气态非均一系混合物的分离方法有重力沉降、惯性除尘、旋风分离、静电分离、湿法洗涤和纤维过滤等。
用于液相非均一系的分离方法,按照其原理,大致可分为两类。
第一类方法取决于分散相和连续相之间的密度差,属于这一类的有浮选法、重力沉降法和离心沉降法。
第二类分离方法对两相密度差没有要求,而以具有过滤介质为前提,利用过滤介质对分散相物制裁的截留作用而实现分离操作。
属于这类的方法有滤饼过滤、深层过滤、筛滤、滤芯式过滤等。
2.传质分离传质分离方法主要用于各种均相混合物的分离,其特点是在分离过程中有质量传递现象。
工业上常用的传质分离过程又分为两大类,即在相间进行质量传递的平衡分离过程和在相内进行质量传递的分离过程。
(1)平衡分离过程。
多数传质分离操作是通过相平衡时原料中各组分在两相中的不同分配来实现的,这类分离操作通称为平衡分离过程,例如蒸馏、吸收和萃取操作。
为了实现平衡分离过程,将混合物分离成均匀的单一相溶液(气体、液体或固体),需要在混合物中添加分离剂来产生或移出一相。
重结晶与升华实验报告重结晶与升华实验报告引言:实验室中,化学实验是我们学习化学知识的重要途径之一。
本次实验我们将学习并掌握重结晶和升华这两种常见的纯化物质的方法。
通过实际操作,我们将深入了解这两种技术的原理和应用。
一、实验目的本次实验的目的是通过重结晶和升华的方法,纯化和分离混合物中的杂质,从而得到纯净的物质。
二、实验原理1. 重结晶重结晶是一种通过溶解物质,再通过冷却或加入沉淀剂使其重新结晶的方法。
该方法基于物质的溶解度与温度的关系,利用溶质在溶剂中溶解度随温度变化的规律,实现杂质的分离和纯化。
2. 升华升华是一种固体直接从固态转变为气态的过程,而不经过液态。
通过加热固体,使其升华成气体,然后再通过冷凝使气体重新变为固态,从而分离纯净物质和杂质。
三、实验步骤1. 重结晶实验(1)取适量的混合物,加入适量的溶剂,加热搅拌,使溶质完全溶解。
(2)将溶液慢慢冷却,观察是否出现结晶。
(3)将结晶物用滤纸过滤,用冷溶剂洗涤,然后晾干。
(4)称量并记录得到的纯净物质的质量。
2. 升华实验(1)取适量的混合物,将其放入升华器中。
(2)加热升华器,观察是否出现升华现象。
(3)将升华的物质冷凝,得到纯净的物质。
(4)称量并记录得到的纯净物质的质量。
四、实验结果与讨论在实验中,我们选择了硝酸钠和碳酸钠的混合物进行重结晶实验。
通过加热搅拌,我们成功地将溶质溶解在溶剂中。
在冷却的过程中,我们观察到结晶的形成。
通过过滤、洗涤和晾干,我们得到了纯净的硝酸钠。
在升华实验中,我们选择了碘和碘化钾的混合物。
加热升华器后,我们观察到碘发生了升华现象,通过冷凝,我们得到了纯净的碘。
通过称量,我们记录了得到的纯净物质的质量。
在讨论中,我们可以进一步探讨重结晶和升华的应用。
重结晶广泛应用于药物、化妆品、食品等行业中,用于纯化和提纯产品。
升华则常用于纯化挥发性物质,如香料、化妆品中的香精等。
这些方法不仅可以用于实验室中的纯化,也可以在工业生产中起到重要的作用。
第二章蒸馏与分馏技术①用相图说明具有最高或最低共沸点的双组分混合物蒸馏和分馏时,混合物的馏出物成分及温度怎么变化?答:具有固定的沸点和固定组成的双组分混合物,其沸腾时气相和液相的组成完全相同,无法分馏分离。
这一沸点叫共沸点;其组成叫共沸物。
当某混合物中的组分能形成共沸时,有两种情况。
Ⅰ有最高共沸点时,在被分馏物组成未达到恒温组成前,可能将多余的组分馏出一部分,使体系内组成逐渐向共沸组成接近。
当瓶内物料组成已达到共沸物的组成后,温度即会上升,共沸物开始馏出,直到瓶内物料蒸完为止Ⅱ若物料是双组分具有最低共沸点的体系,则情况有所不同。
先蒸出共沸物,当其中一种组分被蒸完后,温度会上升到多余组分的沸点,即多余组分被蒸出直至蒸完。
例如:•乙醇沸点为78.3℃,•水的沸点为100℃。
•水和乙醇可以形成共沸物,共沸点在78.1℃。
共沸物的组成为乙醇95.6%,水4.4%。
•当乙醇和水的混合物在分馏时,先馏出的液体组成总是共沸物的组成,即乙醇95.6%,水4.4%。
直到乙醇或水两个组分之一被蒸完后,才蒸出另一个纯组分。
所以含水的乙醇是无法用分馏来制备无水乙醇的。
②减压蒸馏中通导毛细管起什么作用?可否用沸石代替?有什么替代办法?1、蒸馏操作和回流操作都应注意哪些问题?回流装置装配与操作的注意事项①物料的加入。
一般物料及沸石可事先加入到烧瓶中而后再装上冷凝管等,如果物料均是液态,也可在装好冷凝管后从冷凝管上端加入液态物料。
物料的容积一般约为烧瓶容积的 1/3~1/2,不超过 2/3 为合适。
蒸馏时烧瓶中物料的容积亦然。
②安装气体吸收装置或干燥装置。
对于反应过程中产生有毒性气体的应在冷凝管上端加装气体吸收装置;对于易潮解的物料或产物则应在冷凝器上端连一装有无水氯化钙等干燥剂的干燥管。
③冷凝装置的操作。
为了确保回流效率和实验安全,对用水冷冷凝管时应先通水后加热及先停止加热后关冷却水,中途不得断水;要通过调节冷却水流量及加热速度来控制回流速度.以液体蒸汽浸润界面不超过冷凝管有效冷却长度的 1/3 为宜。