二氧化硅晶体结构
- 格式:pdf
- 大小:44.12 KB
- 文档页数:1

二氧化硅的晶体结构
二氧化硅是正四面体空间网状结构。
SiO2晶体有多种晶型,其基本结构单元是四面体,每个Si周围结合4个O,Si 在中心,O在四个顶角;最小环上有6个硅原子和六个氧原子。
许多这样的四面体又通过顶角的O相连接,每个O为两个四面体所共有,即每个O与2个Si相结合。
实际上,SiO2晶体是由Si和O按1:2的比例所组成的立体网状结构的晶体。
因此,通常用SiO2来表示二氧化硅的组成。
扩展资料:制造玻璃、石英玻璃、水玻璃、光导纤维、电子工业的重要部件、光学仪器、工艺品和耐火材料的原料,是科学研究的重要材料。
除此之外,二氧化硅还可以作为润滑剂,是一种优良的流动促进剂,主要作为润滑剂、抗粘剂、助流剂。
特别适宜油类、浸膏类药物的制粒,制成的颗粒具有很好的流动性和可压性。
还可以在直接压片中用作助流剂。

二氧化硅(SiO2)具有多种晶向,其中<100>和<110>是常见的晶向族。
具体如下:
- <100>晶向族:在<100>晶向上,二氧化硅的原子面密度为2/a^2,晶面间距d约为0.543纳米。
这个方向上原子排列较为宽松,电子迁移率较低。
- <110>晶向族:对于<110>晶向,原子面密度为3.5/a^2,晶面间距d约为0.384纳米。
电子在该方向上的迁移率较高,因为原子排列相对紧密,电子受到的阻碍较少。
然而,由于晶格结构紧密,切割成<110>晶向的硅晶圆成本和技术难度都较高。
需要注意的是,二氧化硅的晶体结构中,硅原子位于正四面体的中心,四个氧原子位于正四面体的四个顶角上,这些四面体通过共享顶点的氧原子相连,形成三维网络结构。
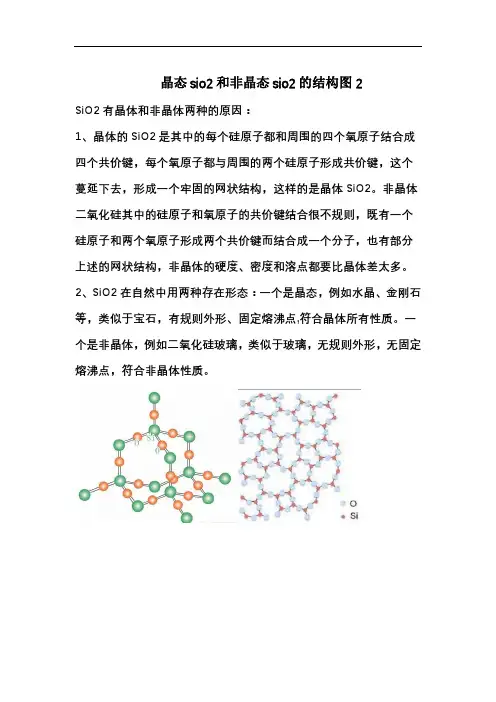
晶态sio2和非晶态sio2的结构图2
SiO2有晶体和非晶体两种的原因:
1、晶体的SiO2是其中的每个硅原子都和周围的四个氧原子结合成四个共价键,每个氧原子都与周围的两个硅原子形成共价键,这个蔓延下去,形成一个牢固的网状结构,这样的是晶体SiO2。
非晶体二氧化硅其中的硅原子和氧原子的共价键结合很不规则,既有一个硅原子和两个氧原子形成两个共价键而结合成一个分子,也有部分上述的网状结构,非晶体的硬度、密度和溶点都要比晶体差太多。
2、SiO2在自然中用两种存在形态:一个是晶态,例如水晶、金刚石等,类似于宝石,有规则外形、固定熔沸点,符合晶体所有性质。
一个是非晶体,例如二氧化硅玻璃,类似于玻璃,无规则外形,无固定熔沸点,符合非晶体性质。

二氧化硅的xrd峰1 简介二氧化硅是一种常见的无机化合物,其分子式为SiO2。
它是一种高度晶化的物质,具有许多重要的物理和化学性质。
在本文中,我们将主要关注二氧化硅的X射线衍射峰,以及这些峰的结构和特征。
2 X射线衍射X射线衍射是一种用于分析材料结构的技术。
当X射线通过物质时,它们会被物质的原子散射,形成一系列衍射峰。
这些峰可以提供关于物质的晶体结构和组成的信息,因此X射线衍射技术成为了重要的材料分析工具。
3 二氧化硅的晶体结构二氧化硅的晶体结构是由硅(Si)和氧(O)原子组成的。
它可以采取多种不同的晶体结构,其中最常见的是α-二氧化硅晶体。
这种晶体结构类似于方格石英晶体,是由正交晶胞组成的。
其中晶格常数a、b、c分别为4.913, 4.913, 和5.405 Å,晶格共344Z。
4 二氧化硅的X射线衍射峰二氧化硅的X射线衍射峰通常具有非常尖锐的形状和高强度的峰值。
这些峰主要由硅和氧原子间的散射产生。
在α-二氧化硅晶体中,最强的峰位于2θ=26.6°附近,这个位置是[101]晶面的布拉格散射.5 二氧化硅的峰形状二氧化硅的X射线衍射峰通常具有非常尖锐的形状和高强度的峰值。
这些特性表明,二氧化硅晶体的结构具有高度的规则性和有序性。
当晶体结构出现缺陷或不规则形状时,峰的宽度可能会显著增加,但在正常情况下,峰通常是极窄的,这也反映了晶体的高度晶化。
6 二氧化硅的峰强度二氧化硅的X射线衍射峰通常具有非常高的强度,这表明该晶体中的硅和氧原子密度非常高,且结构符合高度规则的排列。
此外,衍射峰的强度还受到X射线的入射角度和波长的影响。
7 结论二氧化硅是一种重要的无机化合物,其晶体结构具有高度的规则性和有序性。
当它受到X射线照射时,它会产生尖锐的衍射峰,这些峰可以提供关于物质晶体结构和组成的重要信息。
因此,二氧化硅的X 射线衍射峰被广泛用于材料科学研究和工业应用中。

二氧化硅晶体结构二氧化硅是由硅和氧两种元素组成的一种化合物,化学式为SiO2。
它在自然界中广泛存在,是地壳中的主要成分之一。
二氧化硅具有多种晶体结构,在不同的温度和压力条件下具有不同的晶体结构和物理性质。
本文将重点介绍二氧化硅的晶体结构及其相关特性。
1. α-Quartzα-Quartz是二氧化硅的一种晶体结构,它是最常见的二氧化硅晶体结构。
它的化学式为SiO2,空间群为P3121,具有高度对称性。
它的结构由硅原子和氧原子交替排列组成,形成了六边形的二维网格,每个Si原子都被四个O原子包围。
这种晶体结构中,二氧化硅的结构非常紧密,每个硅原子都与三个相邻的氧原子通过共价键相连,而每个氧原子则与两个相邻的硅原子相连。
α-Quartz在室温下稳定,它具有非常硬和脆的特性,并且具有优异的光学特性。
α-Quartz是一种重要的工业材料,广泛用于太阳能电池板、高温陶瓷、振动元件等方面。
3. TridymiteTridymite是二氧化硅的另一种晶体结构,它是由六方密排的硅氧四面体构成的。
Tridymite的化学式为SiO2,空间群为P3121或P3221,具有高度对称性。
Tridymite的结构与α-Quartz类似,但是在Tridymite中,硅氧六面体的排列方式不同。
Tridymite在高温下稳定,并且具有一些独特的物理特性,如优异的光学和热学性能。
它广泛用于制造反射镜、热隔离材料等方面。
4. Cristobalite总之,二氧化硅具有多种晶体结构,在不同的温度和压力条件下具有不同的晶体结构和物理性质。
它广泛用于制造高温陶瓷、高效太阳能电池板、热隔离材料、光学仪器和半导体等方面,具有广泛的应用前景。

金刚石和二氧化硅的晶体结构
1.金刚石的晶体结构
(1)由3维网络结构构成
金刚石是一种硬度极高的碳化合物,它的晶体结构是由一个由碳原子组成的3维网络结构构成,碳原子之间连接了4个共价键,形成了一维的、二维的和三维的网格结构。
(2)晶格构造
在金刚石中,碳原子是按照笛卡尔坐标系排列,形成晶格,每个晶胞由8个碳原子组成,每个原子在X、Y和Z轴方向上都有一个坐标,他们建立起了一种“键点-晶格-键点”的网络结构。
(3)晶胞半径
晶胞半径为0.35微米,由每个晶胞外围围绕一个等长的球面。
由于不断的晶格构造,晶胞的边界在空间中呈嵌套状构造,两个晶胞的相互关系很密切,构成金刚石的基础结构。
2.二氧化硅的晶体结构
(1)由硅-氧四面体构成
二氧化硅是一种硅原子螺旋结构形式的化合物,它的晶体结构是由硅—氧四面体构成,只有硅和氧两种原子构成晶体结构,每个氧原子与4个硅原子连接,构成一个分子网,重复构成多极的三维的晶体结构。
(2)晶格构造
在二氧化硅中,每个晶胞由2个硅原子和4个氧原子组成,每个原子均在三个晶面的法线方向上平行,形成单元晶胞的正交晶胞,垂直于晶体结构中心的内外表面,每个晶胞具有一定的晶格形状,比如八边形、十二边形、十六边形等形状。
(3)晶体半径
晶体半径为0.5338微米,其尺寸比金刚石要大一些,由于晶体的独特结构,晶胞的边界在空间中也是多层的,晶胞之间的相互关系同样很密切,形成了二氧化硅的基础结构。


二氧化硅晶型转变温度
二氧化硅(SiO2)的晶型转变温度是指在不同温度下,SiO2从一种晶体结构转变为另一种晶体结构的温度。
以下是关于SiO2晶型转变温度的一些信息:
1. SiO2的晶型转变温度与其晶格结构密切相关。
在常温下,SiO2大部分以非晶态存在,即无规则排列的硅氧键网络。
在一定温度范围内,SiO2会发生晶型转变,形成不同的有序晶体结构。
2. α-Quartz晶型是最常见的SiO2晶型。
它的晶格结构是由四面体型SiO4单元组成的,其中一个Si原子被四个O原子所包围。
α-Quartz的转变温度约为573°C。
3. β-Quartz晶型也是一种常见的SiO2晶型。
它的晶格结构与α-Quartz相似,但是β-Quartz的晶胞参数略有不同。
β-Quartz的转变温度约为846°C。
4. Tridymite晶型是另一种SiO2的晶型,其晶格结构由六角柱型SiO6单元组成。
Tridymite的转变温度约为870°C。
5. Cristobalite晶型是SiO2的最高温晶型,具有立方晶格结构。
其转变温度约为1470°C。
需要注意的是,以上转变温度值只是大致数值,具体数值可能会因样品纯度、压力、形态等因素而有所变化。

二氧化硅结构式1. 简介二氧化硅,化学式为SiO2,是一种非金属无机化合物。
它是地壳中相当常见的物质,也是许多晶体和玻璃的主要成分。
本文将介绍二氧化硅的结构式及其相关性质。
2. 结构式二氧化硅的结构式可用化学式SiO2表示。
它的结构由硅原子和氧原子组成,硅原子与四个氧原子形成四面体结构。
硅原子位于四面体的中心,与每个氧原子之间均有共用键相连。
下面是二氧化硅结构式的示意图(使用化学式和Lewis结构式):O╱╲O-Si-O╲╱O3. 性质3.1 物理性质•纯二氧化硅为无色晶体状或无定形状的固体。
•熔点较高,约为1710℃,是一种高熔点物质。
•密度为2.2 g/cm³,是一种高密度物质。
•具有很高的硬度,通常达到7级以上,可以用来制造石英和玻璃等材料。
•二氧化硅是电绝缘体,具有良好的绝缘性能。
3.2 化学性质•二氧化硅是一种稳定的化合物,不与大多数化学物质发生反应。
•它不溶于水和大多数有机溶剂。
•但在浓碱和氢氟酸等强酸性条件下,二氧化硅会发生反应,形成硅酸盐。
4. 应用4.1 建筑材料二氧化硅是建筑材料中重要的成分之一。
由于其硬度高、耐热性好,可以用来制造石英玻璃、建筑玻璃和陶瓷等材料。
此外,二氧化硅还可以作为增强剂添加到混凝土中,提高混凝土的强度和耐久性。
4.2 电子器件由于二氧化硅具有良好的绝缘性能,因此在电子行业中被广泛应用。
它常被用作半导体器件(如晶体管)的绝缘层、LCD显示屏的背板和硅片的衬底。
4.3 咖啡因的吸附剂二氧化硅具有较大的比表面积和吸附能力,因此被用作咖啡因的吸附剂。
在咖啡的生产过程中,二氧化硅可以去除咖啡豆中的咖啡因,从而制得无咖啡因的咖啡。
5. 总结本文介绍了二氧化硅的结构式及其相关性质。
二氧化硅是一种重要的无机化合物,具有良好的物理和化学性质。
它在建筑材料、电子器件和咖啡因去除等方面都有广泛的应用。
通过了解二氧化硅的结构和性质,我们可以更好地理解和应用这一化合物。


二氧化硅的结构特点二氧化硅(SiO2)是一种重要的无机化合物,具有多种结构特点。
以下是关于二氧化硅结构特点的详细解释:1.结构稳定性:二氧化硅具有非常高的熔点和沸点,结构非常稳定。
其结晶态为石英,具有三角晶系。
石英晶体具有非常高的硬度和耐高温性能。
2.空间排列:石英晶体中硅原子和氧原子以共价键的方式连接在一起,形成了一个三维网状结构。
硅原子被四个氧原子所包围,氧原子则被两个硅原子所包围。
3.断键和非晶态:除了结晶态的石英,二氧化硅还可以存在非晶态。
非晶态的二氧化硅由无规则排列的硅氧键所组成,没有明确的长程有序性。
非晶态二氧化硅通常用于制备玻璃和光纤等。
4.同质异构体:除了石英晶体外,二氧化硅还有许多同质异构体。
其中,β-石英是常见的同质异构体之一、它具有六角晶系,结构与石英相似。
此外,还有一个α-石英同质异构体,它具有四方晶系。
5.晶格缺陷:二氧化硅晶体中可以存在一些晶格缺陷,如缺陷位点和结构畸变。
这些缺陷可以影响二氧化硅的物理和化学性质。
6.极性:二氧化硅具有极性,因为硅氧键中硅的电负性较小,氧的电负性较大,导致硅氧键中有一定的电荷分离。
这种极性使得二氧化硅具有一些独特的表面性质,如表面活性、吸附能力等。
7.化学反应:二氧化硅具有丰富的化学反应性。
在一定条件下,可以通过与水反应形成硅酸,也可以与一些酸、碱和金属发生反应。
此外,二氧化硅还可以在高温下与一些金属氧化物形成固溶体。
总而言之,二氧化硅具有高度的结构稳定性、多种异构体以及化学反应性。
这些特点使得二氧化硅在许多领域具有广泛应用,包括材料科学、化学工程、电子器件等。
二氧化硅的原子结构
二氧化硅的原子结构是由硅原子和氧原子构成的,每个硅原子被相邻的4个氧原子包围,处于4个氧原子中心,以共价键跟这4个氧原子结合,形成以硅氧四面体为基本结构的立体网状结构。
二氧化硅(SiO2)有晶体和无定形非晶体两种形态,所以SiO2微粉包含晶体状态和非晶体状态。
在SiO2晶体中, 每个硅原子被相邻的4个氧原子包围, 处于4个O原子中心, 以共价键跟这4个氧原子结合,形成以硅氧四面体为基本结构的立体网状结构。
二氧化硅在工业和科学领域有广泛的应用,如玻璃制造、光学器件、电子器件等。
li2si2o5的晶体结构参数摘要:1.引言2.Li2Si2O5 的基本信息3.Li2Si2O5 的晶体结构4.Li2Si2O5 的晶体结构参数5.结论正文:1.引言Li2Si2O5(二氧化硅锂)是一种广泛应用于玻璃、陶瓷和聚合物等领域的无机材料。
了解Li2Si2O5 的晶体结构参数对于研究其性能和应用具有重要意义。
本文将介绍Li2Si2O5 的晶体结构参数。
2.Li2Si2O5 的基本信息Li2Si2O5 的化学式为Li2Si2O5,表示它由两个锂离子(Li+)、两个硅酸根离子(SiO4^4-)组成。
它是一种离子化合物,具有较高的熔点(约1200 摄氏度)和良好的热稳定性。
3.Li2Si2O5 的晶体结构Li2Si2O5 的晶体结构属于正交晶系,空间群为Pbca。
其晶胞参数如下:- a:10.43 (晶胞在x、y、z 方向上的边长)- b:10.43- c:10.43- β:100.8°(晶胞的轴向角)4.Li2Si2O5 的晶体结构参数Li2Si2O5 的晶体结构参数主要包括晶胞参数、原子坐标参数和键长参数。
- 晶胞参数:已如前述,Li2Si2O5 的晶胞参数为a=10.43 ,b=10.43 ,c=10.43 ,β=100.8°。
- 原子坐标参数:Li2Si2O5 晶体中各原子的坐标可以用来描述晶体结构。
例如,锂离子(Li+)的坐标为(0, 0, 0),硅酸根离子(SiO4^4-)的坐标为(0.5, 0.5, 0.5)。
- 键长参数:Li2Si2O5 的键长参数包括锂- 硅键(Li-Si)、锂- 氧键(Li-O)和硅- 氧键(Si-O)。
其中,锂- 硅键的键长约为2.18 ,锂- 氧键的键长约为2.31 ,硅- 氧键的键长约为1.64 。
5.结论通过对Li2Si2O5 的晶体结构参数的研究,可以更好地了解其微观结构和性能。
二氧化硅的结构特点(一)二氧化硅的结构特点1. 化学式•二氧化硅的化学式为SiO2。
2. 分子结构•二氧化硅的分子结构为四面体结构,每个硅原子与四个氧原子形成共价键。
3. 晶体结构•二氧化硅存在多种晶体结构,其中最常见的是石英晶体结构和水晶晶体结构。
•石英晶体结构为三角棱柱形,具有高度的对称性。
•水晶晶体结构为六角柱形,也具有高度的对称性。
4. 物理性质•二氧化硅为无色、透明的晶体或非晶体固体。
•具有高熔点和高硬度,在高温下仍保持稳定性。
•具有良好的绝缘性能,用作电子元件的绝缘材料。
•硅酸盐矿物的主要成分,是地壳中丰富的物质之一。
5. 应用领域•在玻璃制造中,二氧化硅是主要原料之一,用于提高玻璃的硬度和透明度。
•作为电子材料的重要组成部分,例如制造集成电路和传感器。
•在建筑业中,二氧化硅用作水泥、混凝土和涂料的填料,改善材料的强度和稳定性。
•作为催化剂的载体,促进化学反应的进行。
结论二氧化硅具有特殊的分子和晶体结构,以及优良的物理性质,广泛应用于各个领域。
其多样化的应用使得二氧化硅发挥出巨大的作用,推动了科技的发展和人类社会的进步。
6. 生物活性•二氧化硅具有较高的生物相容性和生物活性,常被用于制备生物医学材料。
•在牙科领域,二氧化硅被用作牙齿修复材料,具有良好的生物相容性和耐磨性。
•二氧化硅纳米材料还具有抗菌和抗炎症的特性,在医学上具有广泛的应用潜力。
7. 环境影响•二氧化硅是一种天然存在的物质,对环境影响较小。
•但在工业生产过程中,二氧化硅的粉尘可能对工人的呼吸系统造成危害,需要采取相应的防护措施。
•此外,二氧化硅的颗粒物也可能对空气质量造成一定的影响,需要控制排放。
8. 研究进展•近年来,二氧化硅的研究领域日益扩大,涉及材料科学、化学、生物医学等领域。
•研究人员对二氧化硅的结构、性质和应用进行了深入研究,不断探索其新的应用领域和潜力。
结论二氧化硅不仅具有多种特殊的结构和性质,还在多个领域有着广泛的应用和研究价值。
二氧化硅晶胞结构嘿,朋友们!今天咱来聊聊二氧化硅晶胞结构这个神奇的玩意儿。
你说二氧化硅,那可真是到处都有啊!就像咱生活中的那些常见却又不可或缺的东西一样。
你看那沙子,对,就是沙滩上的那些,那里面可就有大量的二氧化硅呢!那二氧化硅晶胞结构呢,就好比是一个特别精巧的小房子。
想象一下,这个小房子有好多好多的房间,每个房间都有它独特的位置和作用。
这些房间排列得整整齐齐,规规矩矩的,就像士兵列队一样。
在这个晶胞结构里呀,硅原子和氧原子就像是住在一起的好伙伴,它们亲密无间地组合在一起。
硅原子就像是这个小房子的大梁,撑起了整个结构;而氧原子呢,就像是给大梁添砖加瓦的,让这个小房子更加稳固。
它们相互依靠,相互配合,共同构建出了这么一个奇妙的二氧化硅晶胞结构。
咱再深入一点看看,这些原子可不是随便乱放的哦!它们有着特定的规律和排列方式,这可真是大自然的鬼斧神工啊!就好像是一个超级复杂的拼图,每一块都得放在正确的位置上,不然可就不完美啦。
你说这二氧化硅晶胞结构有啥用呢?那用处可大了去了!它就像是建筑的基石一样,很多材料都离不开它。
比如说玻璃,那可是我们生活中常见的东西吧,玻璃的制造就和二氧化硅晶胞结构息息相关呢。
还有那些陶瓷啊什么的,都有它的功劳。
而且啊,研究二氧化硅晶胞结构可不只是为了制造这些东西哦!它还能让我们更加了解大自然的奥秘呢。
就好像我们通过研究一个小小的细胞,能了解人体的奥秘一样。
朋友们,你们不觉得这很神奇吗?一个小小的二氧化硅晶胞结构,竟然蕴含着这么多的秘密和用途。
这就像是一个隐藏在我们身边的宝藏,等待着我们去发掘,去探索。
所以啊,我们可不能小瞧了这些看似普通的东西。
它们背后可能有着我们意想不到的精彩呢!就像二氧化硅晶胞结构一样,看似简单,实则蕴含着无尽的奥秘和魅力。
让我们一起带着好奇的心,去探索更多这样的神奇世界吧!。
二氧化硅的晶面间距二氧化硅是一种常见的无机化合物,具有多种晶体结构。
晶体的结构特点之一就是晶面间距,也称为晶格常数。
晶面间距是指晶体中相邻晶面的距离,它是晶体结构的重要参数之一。
本文将围绕二氧化硅的晶面间距展开讨论,探究其在不同晶体结构下的特点和应用。
一、二氧化硅的晶体结构二氧化硅的晶体结构有多种,其中最常见的是石英晶体结构。
石英晶体结构属于三方晶系,具有六角柱形状。
在石英晶体结构中,晶面间距可以通过晶格常数来描述。
二、石英晶体结构下的晶面间距石英晶体结构中的晶面间距与其晶格常数密切相关。
石英晶体的晶格常数为a=4.913Å,c=5.405Å。
根据晶体学的理论,可以计算出石英晶体结构中各个晶面的间距。
在石英晶体结构中,最常见的晶面是(100)面、(010)面和(001)面。
这些晶面的间距可以通过以下公式计算:(100)面的间距:d100 = a / √(h^2+k^2+l^2)(010)面的间距:d010 = a / √(h^2+k^2+l^2)(001)面的间距:d001 = c / √(h^2+k^2+l^2)其中,h、k、l分别代表晶面的晶面指数。
晶面指数是用来表示晶面方向和位置的参数,它与晶面间距有直接关系。
三、晶面间距的影响因素晶面间距不仅与晶格常数和晶面指数有关,还与晶体结构、晶体生长条件等因素密切相关。
1. 晶体结构:不同晶体结构的晶面间距不同。
例如,石英晶体结构中的晶面间距与钠长石晶体结构中的晶面间距存在差异。
2. 晶体生长条件:晶体在不同生长条件下,晶面间距可能发生变化。
例如,温度、压力等因素的变化会导致晶体结构的畸变,从而影响晶面间距。
3. 晶体缺陷:晶体中存在的缺陷也会影响晶面间距。
例如,晶体中的点缺陷、线缺陷等可能导致晶面间距的变化。
四、晶面间距的应用晶面间距作为晶体的重要参数,广泛应用于材料科学、矿物学、地质学等领域。
1. 材料科学:晶面间距可以用来表征材料的晶体质量和结构性能。
sio2晶体中最小的环
摘要:
1.SIO2 晶体简介
2.SIO2 晶体中的最小环
3.最小环的重要性和应用
正文:
【1】SIO2 晶体简介
SIO2 晶体,也被称为二氧化硅晶体,是一种广泛存在于自然界的晶体。
它是地球上最常见的矿物之一,被广泛应用于陶瓷、玻璃和电子工业等领域。
SIO2 晶体结构复杂,由硅原子和氧原子组成的环状结构构成。
【2】SIO2 晶体中的最小环
在SIO2 晶体结构中,最小的环是由六个硅原子和六个氧原子组成的六元环。
这个六元环是SIO2 晶体中最基本的结构单元,也是构成更大、更复杂结构的基础。
【3】最小环的重要性和应用
SIO2 晶体中最小的六元环在材料科学和应用领域有着重要的意义。
首先,它的稳定性和结构特性直接影响了SIO2 晶体的物理和化学性质。
其次,通过改变六元环的结构和连接方式,可以调控SIO2 晶体的形态和性能,从而实现在各种领域的应用。
例如,在陶瓷工业中,通过控制SIO2 晶体中最小环的结构,可以改变陶瓷材料的微观结构和性能,提高其强度、硬度和耐高温性能。
在电子工业中,SIO2 晶体中最小的六元环也可以作为绝缘层,用于制作高性能的电子器件。
(2)乙酸与醇反应生成乙酸酯,若产物为
(C
CH 3O O n R ,变式为(CH 2CO )n ·R (OH )n ,从式子
可看出,生成的酯比相应的醇的分子量增加42n ,若为一元醇则增加42。
五、从反应前后碳链结构看
在下列一系列变化中,分子中的碳链结构不变化:醇醛羧酸酯
所以酯中酯键两侧的碳骨架仍保持着醇的碳骨架
和酸的碳骨架。
醇与它自身氧化成的羧酸酯化反应生
成的酯,酯键两侧碳数相同,碳骨架也相同。
六、从酯的特殊性看
甲酸酯中仍有醛基:H
C O
O R ,所以甲酸酯
能够发生银镜反应,等等,表现出醛的一些性质,同时它有酯的通性。
另外,甲酸酯
水解生成甲酸或甲酸盐,所以其产物仍能发生银镜反应。
二氧化硅晶体结构
湖南衡阳县一中(421200) 陈吉秋
一、二氧化硅晶体平面
示意图
高级中学课本化学第二册P6有二氧化硅晶体平面示意图(见图1)。
该图说明二氧化硅不是由单个“SiO 2”的
分子所组成的分子晶体,而是一种原子晶体。
一个Si 原子跟4个O 原子形成4个共价
键。
同时,一个氧原子又跟两个Si 原子形成两个共价键。
但该图也有两处不足:①该图并没有反映出二氧化硅真实的三维空间结构。
②该图中最小环上是4个Si 原子与4个O 原子交替连结,而实际上二氧化硅晶体中,
最小环上是6个Si 原子与6个O 原子交替连接。
二、二氧化硅晶体空间结构1.硅晶体结构
硅晶体结构与金刚石结构相似(见图2),在硅晶体中,每个硅原子都被相邻的4个硅原子包围,处于4个硅原子的中心,以共价键跟这4个硅原子结合,成为正四面体结构,这些正四面体结构向空间发展,构成一种坚实的,彼此联结的空间网状晶体。
2.二氧化硅晶体结构
如果在硅的晶体结构示意图中,将所有的Si -Si 键断裂,再在Si 原子与Si 原子之间连一个原子(每个O 原子形成的两个Si -O 键的键角不是180°)就可得到二氧化硅晶体结构示意图(见图3)。
因此,在二氧化硅晶体中,每个硅原子被相邻的4个氧原子包围,处于4个O 原子中心,
以共价键跟这4
个氧原子结合,成为正四面体结构(见图4)。
每个O 原子为两个四面体所共有(见图5)。
这样,许许多多四面体又通过顶点O 原子连成一个整体(见图6),在二氧化硅晶体中最小环上有6个O 原子和6个未画出的Si 原子以Si -O
键交替相连(见图6)。
由图3与图7也可得出这个结论。
33
释疑解难★。