晶体结构III
- 格式:pdf
- 大小:1.82 MB
- 文档页数:43

三氧化二锰晶体结构三氧化二锰(Manganese(III) oxide)是一种化学式为Mn2O3的无机化合物,它是由锰(Mn)和氧(O)元素组成的。
在这个问题中,我们将讨论三氧化二锰的晶体结构。
1. 三氧化二锰的晶体结构概述三氧化二锰晶体属于正交晶系,其晶格参数为a = 10.86 Å,b = 9.59 Å,c = 2.86 Å。
晶体结构由锰离子和氧离子组成,锰离子以正四面体的形式配位于氧离子周围。
2. 锰离子的配位环境每个锰离子被六个氧离子配位包围着。
这种配位环境被称为八面体配位。
八面体是一个由六个面构成的多面体,每个面都是一个等边三角形。
3. 氧离子的配位环境每个氧离子被三个锰离子配位包围着。
这种配位环境被称为三角形配位。
三角形是一个由三条边构成的几何形状,每条边都连接到一个锰离子。
4. 锰离子和氧离子之间的键合在三氧化二锰晶体结构中,锰离子和氧离子之间形成了离子键。
锰离子以正电荷吸引氧离子的负电荷,从而形成了稳定的结构。
这种离子键的形成使得晶体具有较高的熔点和硬度。
5. 晶体结构的稳定性三氧化二锰晶体结构的稳定性与其晶格结构有关。
晶体中每个离子之间的相互作用力使得整个晶体结构保持稳定。
在三氧化二锰晶体中,锰离子和氧离子之间的离子键强度较高,因此增加了晶体的稳定性。
6. 应用领域三氧化二锰晶体结构的独特性质使其在许多应用领域中发挥重要作用。
例如,它被用作催化剂、电池材料和陶瓷材料的成分。
此外,三氧化二锰还具有磁性,因此也被用于磁学研究中。
在总结,三氧化二锰晶体结构由锰离子和氧离子组成,锰离子以八面体配位环境存在,氧离子以三角形配位环境存在。
锰离子和氧离子之间形成了离子键,这种结构的稳定性使其在催化剂、电池材料和陶瓷材料等领域得到广泛应用。


晶体结构与性质的关系研究引言:晶体是固体中最常见的形态之一,它们具有有序排列的原子、离子或分子结构。
这种有序性使得晶体在性质上表现出一系列独特的特征,因此,晶体结构与性质的关系一直是材料科学领域的热门研究方向。
本文将探讨晶体结构与性质之间的关系,并介绍一些相关的研究进展。
I. 晶体结构对物理性质的影响晶体的结构决定了它们的物理性质。
例如,各向同性的晶体(如立方晶体)具有均匀分布的原子结构,导致它们具有各向同性的物理性质。
然而,一些晶体会因为其结构的非均匀性而表现出各向异性的性质。
例如,石墨的层状晶体结构使其在平面上具有很高的导电性,而在垂直于平面方向上则导电性非常差。
II. 晶体结构对化学性质的影响晶体的结构还会影响其化学性质。
晶体中的原子排列方式决定了它们与其他物质的反应性。
例如,钙钛矿结构的晶体由具有不同电荷的离子构成,这使得它们具有良好的光电性能和催化活性。
此外,晶体结构中的孔道和缺陷也会影响其化学性质。
孔道结构可以增加晶体的吸附性能和储能性能,而缺陷结构可能导致晶体的导电性和热稳定性发生变化。
III. 晶体结构对热学性质的影响晶体的结构还会对其热学性质产生影响。
晶体中原子或分子的排列方式决定了其导热性能、热膨胀性和热导率等特性。
例如,金刚石的均匀排列的碳原子结构使其具有极高的热导率。
此外,晶体结构中的缺陷也会对热学性质产生影响。
一个例子是材料中的点状缺陷能够降低晶体的热导率。
IV. 晶体结构对光学性质的影响晶体的结构还可以影响其光学性质。
晶体中的原子或分子的排列方式决定了其对不同波长的光的吸收、反射和透射能力。
例如,金属结构的晶体对可见光具有很强的反射能力,而透明晶体则对可见光有较高的透射性。
此外,晶体的缺陷结构和掺杂物也会对光学性质产生重要影响。
掺杂不同元素可以使晶体发生光致发光或变色等现象。
结论:晶体结构与性质之间的关系是一个复杂而又有趣的研究领域。
通过对晶体结构进行系统的分析和研究,我们可以揭示晶体的各种性质特征,并为制备具有特定性能的新型材料提供指导。

gaas 晶体构型GaAs晶体构型GaAs晶体是一种III-V族半导体材料,由镓(Ga)和砷(As)元素组成。
它具有特殊的晶体构型,对于研究和应用其物理性质和电子特性具有重要意义。
GaAs晶体属于菱面晶系,晶胞结构为六方最密堆积结构。
它的晶格参数为a=5.65325Å,c=5.65325Å,角度为α=β=90°,γ=120°。
晶格常数较小,原子间距离较近,因此GaAs晶体具有较高的密度和较高的原子配位数。
在GaAs晶体中,镓原子和砷原子分别占据菱面晶胞的两种不同位置,形成了充满整个晶体的晶格结构。
每个菱面晶胞中含有8个原子,其中4个镓原子位于顶点位置,4个砷原子位于中心位置。
镓原子和砷原子之间通过共价键相连,形成了稳定的晶体结构。
由于GaAs晶体的晶格结构特殊,使得其具有许多特殊的物理性质和电子特性。
首先,GaAs晶体具有直接带隙,能带间隙为1.43eV,这使得它在光电子器件中具有广泛的应用,如太阳能电池、激光器等。
其次,GaAs晶体具有高的迁移率和较小的有效质量,这使得它在高频和高速电子器件中具有良好的性能。
此外,GaAs晶体还具有较高的抗辐射性能和较好的稳定性,适合用于航空航天等特殊环境中。
GaAs晶体的构型对其物理性质和电子特性有重要影响。
通过对其构型的研究,可以更好地理解和控制其性能,并在实际应用中发挥其优势。
例如,通过改变晶体的生长条件和掺杂材料,可以调控GaAs 晶体的能带结构和电子能级,实现对其光电性能的改善和优化。
GaAs晶体的构型是其物理性质和电子特性的基础,对于研究和应用该材料具有重要意义。
通过对其晶格结构和原子排列的研究,可以更好地理解和控制GaAs晶体的性能,进一步推动其在光电子器件、高频电子器件等领域的应用。


117晶体结构一、基本概念(The Basic Concepts ): 1.晶体(Crystals ):(1)物质的质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐外形的、以多面体出现的固体物质,称为晶体。
(2) 晶体有同质多象性 由同样的分子(或原子)可以以不同的方式堆积成不同的晶体,这种现象叫做同质多象性。
但同一种物质的气态、液态只存在一种结构。
(3) 晶体的几何度量和物理效应常随方向不同而表现出量上的差异,这种性质称为各向异性。
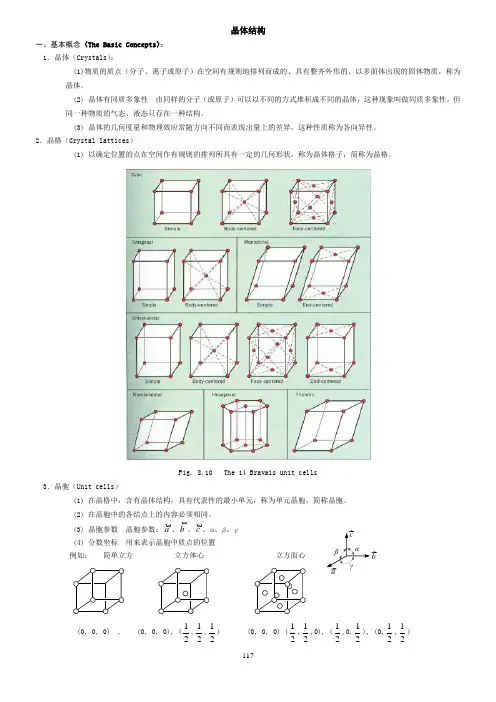
2.晶格(Crystal lattices )(1) 以确定位置的点在空间作有规则的排列所具有一定的几何形状,称为晶体格子,简称为晶格。
Fig. 8.10 The 14 Bravais unit cells3.晶胞(Unit cells )(1) 在晶格中,含有晶体结构,具有代表性的最小单元,称为单元晶胞,简称晶胞。
(2) 在晶胞中的各结点上的内容必须相同。
(3) 晶胞参数 晶胞参数:a、b、c、α、β、γ (4) 分数坐标 用来表示晶胞中质点的位置例如: 简单立方 立方体心 立方面心(0, 0, 0) , (0, 0, 0), (21,21,21) (0, 0, 0) (21,21,0), (21,0,21), (0,21,21) αβγbc a118在分数坐标中,绝对不能出现1,因为1即0。
这说明晶胞是可以前后、左右、上下平移的。
等价点只需要一个坐标来表示即可,上述三个晶胞中所含的质点分别为1、2、4,所以分数坐标分别为1组、2组和4组。
(5) 晶面指数 晶面在三维空间坐标上的截距的倒数(h 、k 、l )来表示晶体中的晶面,称为晶面指数,如立方晶系中(100),(110),(111)面分别为(100) (110)(111)lFig. 8.12 Selected planes and their Miller indices for cubic system用X-ray 的衍射可以测量晶体中的面间距,2d ·sin θ = n ·λ。

§3 晶体结构一、晶体与非晶体1、晶体的特征:⑴有一定的几何外形,非晶体如玻璃等又称无定形体;⑵有固定的熔点;⑶各向异性:晶体在不同方向上表现出不同的物理性质。
一块晶体的某些性质,如光学性质、力学性质、导电导热性质、机械强度等,从晶体的不同方向去测定,常不同。
⑷晶体具有平移对称性:在晶体的微观空间中,原子呈现周期性的整齐排列。
对于理想的完美晶体,这种周期性是单调的,不变的,这是晶体的普遍特征,叫做平移对称性。
⑸自范性:在适宜条件下,晶体能够自发地呈现封闭的、规则的多面体外形。
2、晶体的内部结构⑴晶格:把晶体中规则排列的微粒抽象成几何学中的点,并称为结点。
这些点的结合称为点阵,沿着一定的方向按某种规则把结点连结起来,则得到描述各种晶体内部结构的几何图像——晶体的空间格子,称为晶格。
⑵晶胞:在晶格中,能表现出其结构的一切特征的最小部分称为晶胞。
(晶体中最有代表性的重复单位)⑶晶胞基本特征:晶胞有二个要素:①是晶胞的大小、型式,②是晶胞的内容。
晶胞的大小、型式由a、b、c三个晶轴及它们间的夹角α.β.γ所确定。
晶胞的内容由组成晶胞的原子或分子及它们在晶胞中的位置所决定。
3、单晶体和多晶体⑴单晶体——由一个晶核(微小的晶体)各向均匀生成而成,其内部的粒子基本上按某种规律整齐排列。
如冰糖、单晶硅等。
⑵多晶体——由很多单晶体杂乱聚结而成,失去了各二、离子晶体及其性质1、离子晶体的特征和性质⑴由阳离子和阴离子通过静电引力结合成的晶体——离子晶体。
⑵性质:静电作用力较大,故一般熔点较高,硬度较大、难挥发,但质脆,一般易溶于水,其水溶液或熔融态能导电。
2、离子键⑴定义:阳离子和阴离子通过静电作用形成的化学键。
⑵离子键的形成条件:元素的电负性差要比较大。
⑶离子键的本质特征:是①静电作用力,②没有方向性和饱和性。
⑷影响离子键强度的因素①离子电荷数的影响。
②离子半径的影响:半径大, 导致离子间距大, 所以作用力小; 相反, 半径小, 则作用力大。

冰的18种晶体结构冰是一种常见的物质,它存在于我们生活的各个角落中。
然而,你是否知道冰实际上存在着不同的晶体结构?下面我们将一一介绍冰的18种晶体结构。
1. 冰Ih:冰Ih是最常见的冰的结构,也是我们平常所说的冰块。
它具有六方晶体结构,每个水分子都与其他四个水分子相邻,形成一个六边形的结构。
2. 冰II:冰II是在高压下形成的一种冰的结构。
它具有四方晶体结构,水分子排列更加紧密,形成一个立方体的结构。
3. 冰III:冰III是在更高的压力下形成的一种冰的结构。
它具有同样的六方晶体结构,但水分子的排列更加紧密,相邻的水分子之间的距离更近。
4. 冰IV:冰IV是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。
5. 冰V:冰V是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。
6. 冰VI:冰VI是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。
7. 冰VII:冰VII是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。
8. 冰VIII:冰VIII是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。
9. 冰IX:冰IX是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。
10. 冰X:冰X是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。
11. 冰XI:冰XI是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。
12. 冰XII:冰XII是在更高压力下形成的一种冰的结构。
它具有六方晶体结构,水分子排列更加紧密,相邻的水分子之间的距离更近。


冰的结构模型冰,是一种在自然界中常见的固态物质,也是地球上最普遍的水的固态形式。
它的结构模型是由水分子组成的,每个水分子由一个氧原子和两个氢原子组成,呈V字形排列。
在冰的结构模型中,水分子通过氢键相互连接。
氢键是一种弱的相互作用力,它是由氢原子与氧原子之间的电负性差引起的。
每个水分子可以与最多四个邻近的水分子通过氢键相连,形成一个三维网络。
这种网络结构使得冰具有稳定的固态性质。
根据冰的结构模型,冰可以分为多种不同的晶体形态。
其中最常见的是冰Ih,它是大部分冰的稳定相。
在冰Ih中,水分子排列成六边形的晶格,形成一个由六个水分子组成的环。
这种排列方式使得冰Ih具有规则的晶体结构,呈现出六角形的晶体形状。
除了冰Ih,还有其他形态的冰,如冰II、冰III等。
每种冰的结构模型都不同,具有不同的晶体结构和物理性质。
例如,冰II的结构模型是由六边形的环和六边形的环交替排列而成,具有较高的密度和硬度,可以在高压下形成。
而冰III的结构模型是由六边形的环和八边形的环交替排列而成,具有更高的密度和更复杂的结构。
冰的结构模型不仅仅是一种科学理论,它还对我们的日常生活产生着重要的影响。
首先,冰的结构模型决定了冰的物理性质,如硬度、导热性和熔点等。
这些性质使得冰成为一种重要的工业原料和热交换介质。
其次,冰的结构模型还决定了冰的形态和形状,如雪花、冰柱和冰山等。
这些美丽的冰的形态给人们带来了无尽的惊喜和欣赏的机会。
总结起来,冰的结构模型是由水分子组成的,通过氢键相互连接形成一个稳定的固态网络。
冰的结构模型决定了冰的物理性质和形态,对我们的生活产生着重要的影响。
了解冰的结构模型不仅可以增加对冰的认识,还可以帮助我们更好地利用和欣赏冰的美丽。
晶体晶胞结构讲解物质结构要点1、核外电⼦排布式外围核外电⼦排布式价电⼦排布式价电⼦定义:1、对于主族元素,最外层电⼦2、第四周期,包括3d与4S 电⼦电⼦排布图熟练记忆 Sc Fe Cr Cu2、S能级只有⼀个原⼦轨道向空间伸展⽅向只有1种球形P能级有三个原⼦轨道向空间伸展⽅向有3种纺锤形d能级有五个原⼦轨道向空间伸展⽅向有5种⼀个电⼦在空间就有⼀种运动状态例1:N 电⼦云在空间的伸展⽅向有4种N原⼦有5个原⼦轨道电⼦在空间的运动状态有7种未成对电⼦有3个 ------------------------结合核外电⼦排布式分析例23、区的划分按构造原理最后填⼊电⼦的能级符号如Cu最后填⼊3d与4s 故为ds区 Ti 最后填⼊能级为3d 故为d区4、第⼀电离能:同周期从左到右电离能逐渐增⼤趋势(反常情况:S2与P3 半满或全满较稳定,⽐后⾯⼀个元素电离能较⼤)例3、⽐较C、N、O、F第⼀电离能的⼤⼩ --------------- F >N>O>C例4、某元素的全部电离能(电⼦伏特)如下:回答下列各问:(1)I6到I7间,为什么有⼀个很⼤的差值?这能说明什么问题? _________________________(2)I4和I5间,电离能为什么有⼀个较⼤的差值_________________________________(3)此元素原⼦的电⼦层有 __________________层。
最外层电⼦构型为 ______________ 5、电负性:同周期从左到右电负性逐渐增⼤(⽆反常)------------F> O >N >C6、对⾓线规则:某些主族元素与右下⽅的主族元素的性质有些相似,被称为“对⾓线规则”如:锂和镁在空⽓中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱7、共价键:按原⼦轨道重叠形式分为:σ键和π键 (具有⽅向性和饱和性)单键 -------- 1个σ键双键------1个σ键和1个π键三键---------1个σ键和2个π键8、等电⼦体:原⼦总数相等,价电⼦总数相等----------具有相似的化学键特征例5、N2 CO CN-- C22-互为等电⼦体CO2 CS2 N2O SCN-- CNO-- N3- 互为等电⼦体从元素上下左右去找等电⼦体,左右找时及时加减电荷,保证价电⼦相等。
旋转-反演轴的对称操作
3
可以按倒格矢展开为傅立叶级数布里渊区(倒空间原胞)、界面方程
晶体可以作为X射线的衍射光栅奠定了固体物理基础!
光的反射定律
处原子散射波
0k r 1
k r
条件)的意义:
弹性散射近似
其它格点恰好是一个倒格矢,故方向发生衍射。
倒格子
晶体至胶片距离
定、确定原子位置最基本的方法。
S
1
S
1
其相位差:
因为衍射测量的是衍射强度,它正比于:
个原子:
:四个原子:
,,'h k l k k K −=方程不是真正的衍射加强条件,
因其含有消光点,必须采用几何结构因子来修正
SC
薄膜多晶衍射图
扫描探针显微术SPM
Si原子表面重构。