几种常见晶体结构分析
- 格式:docx
- 大小:368.04 KB
- 文档页数:21

材料的晶体结构表征方法晶体结构表征是研究材料性质和结构的重要手段之一。
准确了解材料的晶体结构可以帮助我们理解其物理和化学性质,以及在设计新材料和改良现有材料中的应用。
本文将介绍几种常用的晶体结构表征方法。
一、X射线衍射X射线衍射是一种应用X射线衍射定律研究晶体结构的技术。
它通过测量入射X射线与晶体相互作用后的衍射图案来确定晶体的晶胞参数和原子位置。
这种方法可以得到高分辨率的结构信息,常用于分析晶体的晶体结构。
X射线衍射实验通常需要使用X射线衍射仪器,如X射线衍射仪、X射线衍射分析软件等。
实验过程中要注意选择合适的X射线入射功率和测量角度范围,以保证得到可靠的结果。
二、扫描电子显微镜(SEM)扫描电子显微镜通过扫描样品表面并测量所产生的电子信号来获取样品的表面形貌和结构信息。
通过SEM可以观察到晶体的形貌、晶粒大小以及晶界等细节信息。
在进行SEM观察时,需要使用适当的样品制备方法,如金属镀膜、样品切割等,以确保样品表面平整和导电性。
同时,还要设置合适的电子束参数和探测器参数,以获取清晰的显微图像。
三、透射电子显微镜(TEM)透射电子显微镜通过透射样品的电子束来观察样品的内部结构。
TEM可以提供比SEM更高的分辨率,可以观察到原子级别的细节信息,如晶体排列、原子位置等。
使用TEM观察晶体结构时,需要适当的样品制备方法,如薄片切割、离子薄化等,以获得透过电子束的样品。
同时,还需要进行高分辨率的图像采集和处理,以获取清晰的晶体结构图像。
四、能谱分析能谱分析是通过测量材料中的元素组成和电子能级信息来表征材料晶体结构的方法。
常用的能谱分析技术包括X射线能谱分析、电子能谱分析等。
X射线能谱分析使用X射线与材料相互作用后产生的特征X射线谱线来判断材料中的元素组成。
电子能谱分析则使用电子束与材料相互作用后产生的特征能量损失谱线来得到材料的电子能级信息。
这些能谱信息能够提供材料中不同元素的分布、化学键的信息等。
在进行能谱分析时,需要准确的仪器设备和适当的样品制备方法。

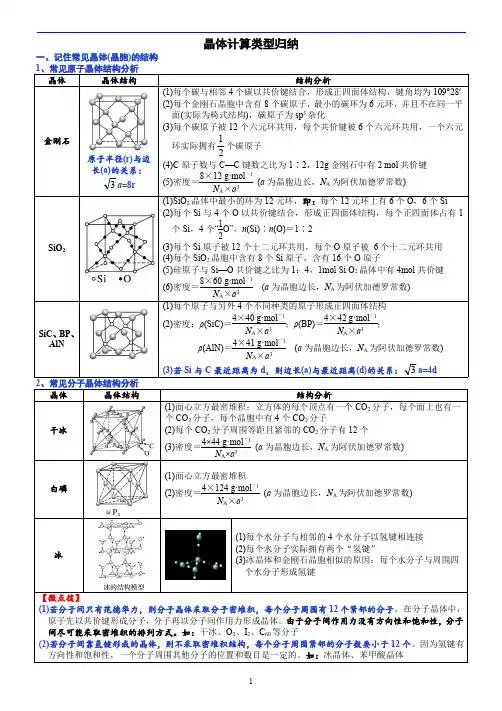
金属晶体常见类型一、晶体的概念和分类晶体是由周期排列的原子、离子或分子组成的固体,具有有序的结构和规则的几何形状。
根据晶体的结构特点,晶体可以分为单晶体和多晶体两种类型。
二、单晶体单晶体是指晶体中的原子、离子或分子排列有序,沿着一个方向生长,形成连续的完整晶格结构。
单晶体具有高度的结晶性和均匀性,其物理性质在各个方向上具有一致性。
单晶体常见的类型有以下几种:1. 立方晶系立方晶系是指晶体中的晶格具有立方对称性的晶体类型。
常见的立方晶体有金刚石、铁、铜等。
立方晶体具有均匀的原子排列和相同的结构特征。
2. 六方晶系六方晶系是指晶格具有六方对称性的晶体类型。
六方晶体的晶胞结构具有六个等边三角形的面和一个平行于晶轴的正方形面。
常见的六方晶体有纯净的钨、锡等。
3. 正交晶系正交晶系是指晶格具有直角对称性的晶体类型。
正交晶体的晶胞结构具有三个互相垂直的晶轴。
常见的正交晶体有铅、锌等。
4. 斜方晶系斜方晶系是指晶格具有斜角对称性的晶体类型。
斜方晶体的晶胞结构具有两个直角和一个倾斜的晶轴。
常见的斜方晶体有石膏、硫酸铜等。
5. 单斜晶系单斜晶系是指晶格具有一个二折射轴对称性的晶体类型。
单斜晶体的晶胞结构具有一个直角和一个倾斜的晶轴。
常见的单斜晶体有辉石、石膏等。
6. 三斜晶系三斜晶系是指晶格不具有任何对称性的晶体类型。
三斜晶体的晶胞结构没有直角和等边特征。
常见的三斜晶体有石墨、石英等。
三、多晶体多晶体是指晶体中存在多个晶粒,晶粒之间的晶格方向不一致。
多晶体的晶粒形状不规则,晶界处存在原子、离子或分子排列的错位。
多晶体具有各向异性,物理性质在不同方向上有差异。
多晶体常见的类型有以下几种:1. 等轴晶粒等轴晶粒是指晶粒的长、宽、高三个维度长度相近,没有明显的长径比差异。
等轴晶粒常见于均匀快速冷却的金属材料中。
2. 柱状晶粒柱状晶粒是指晶粒的高度远大于宽度和厚度,呈柱状或棒状。
柱状晶粒常见于有向凝固的金属材料中。
3. 银杏状晶粒银杏状晶粒是指晶粒的长径远大于宽度和厚度,呈扁平的银杏叶状。


常见晶体结构中的有关数据分析【摘要】在中学教材里,由于晶体各自结构的特殊性,学生在进行微观结构分析,尤其是与数据有关的分析时常常感到较困难。
而构建完整的空间概念,结合数学思维策略,是突破难点的最佳方法。
【关键词】晶体结构数据分析在中学教材里,涉及到结构的常见晶体有:离子晶体(NaCl晶体、CsCl晶体)、分子晶体(干冰晶体)、原子晶体(二氧化硅晶体、金刚石)以及过渡型晶体石墨等。
由于各自结构的特殊性,学生在进行微观结构分析,尤其是与数据有关的分析时常常感到较困难。
而构建完整的空间概念,结合数学思维策略,是突破难点的最佳方法。
在对各晶体结构进行分析前,先要弄清楚下面几个概念。
1.晶胞:在晶体结构中具有代表性的基本重复单位称为晶胞,晶胞在三维空间无限地重复就产生了宏观的晶体。
晶胞必须是平行六面体。
后面的举例都是以晶胞为分析对象。
2.晶胞中的实际含有粒子数:由于晶胞只是晶体中的一个单元,晶胞中的粒子不可避免地存在共有现象,因此,需要用均摊的方法计算出晶胞中实际含有的粒子数。
计算方法如下:(1)处于立方体顶点的粒子,同时为8个晶胞所共有,每个粒子实际只有1/8属于该晶胞;(2)处于棱上的粒子,同时为4个晶胞共有,每个粒子实际只有1/4属于该晶胞;(3)处于面上的粒子,同时为2个晶胞共有,每个粒子实际只有1/2属于该晶胞;(4)处于立方体内的粒子,则完全属于该晶胞。
3.晶体的密度:由于晶胞反应了晶体结构的一切特征,晶胞无限延伸即为晶体,所以,晶胞的密度即为晶体的密度。
4.配位数:在晶胞中与一个粒子(分子、原子或离子)最邻近的粒子(分子、原子或离子)数,叫做该粒子的配位数。
最邻近的粒子可能与中心粒子相同,也可能不同。
5.最近且等距的同种粒子数:与一种粒子最近且等距离的同种粒子数。
如果构成晶胞的只有一种粒子,则等于配位数。
现以上述各常见晶体进行具体分析:一、NaCl晶体1. NaCl晶胞(如右图)为立方体。
八个顶点及六个面心上排列同种离子,体心及十二条棱的棱心排列异种离子。

几种常见晶体结构分析晶体结构分析是研究晶体的空间结构和原子排列方式的科学方法。
通过晶体结构分析,可以确定晶体的晶系、晶胞参数和原子位置等重要的结构信息。
晶体结构分析方法主要包括X射线衍射、电子衍射和中子衍射等。
一、X射线衍射:X射线衍射是最常用的晶体结构分析方法。
它利用X射线与晶体中的原子发生相互作用后发生衍射现象,通过收集和测量衍射光的强度和角度等信息,可以推断晶体中原子的位置和排列方式。
1.单晶X射线衍射:单晶X射线衍射是一种通过测量单个晶体中的衍射光来推断晶体结构的方法。
这种方法需要得到高质量的单晶样品,并使用X射线源和衍射仪器对单晶样品进行测量,得到全息图样品的X射线衍射图案。
通过分析衍射图案的形状和强度,可以确定晶体的晶系、晶胞参数和原子位置等结构信息。
2.粉末X射线衍射:粉末X射线衍射是一种通过测量晶体样品中的多个晶粒的衍射光来推断晶体结构的方法。
这种方法适用于非晶态样品或无法得到高质量单晶样品的情况。
在粉末X射线衍射中,晶体样品首先被粉碎成细粉末,然后通过X射线衍射仪器测量粉末的衍射光。
通过分析衍射光的谱线形状和位置,可以得到晶体的晶胞参数和结构信息。
二、电子衍射:电子衍射是一种利用电子束与晶体中的原子发生相互作用后发生衍射现象来推断晶体结构的方法。
电子衍射通常借助透射电子显微镜(TEM)来观察和测量晶体样品的衍射图案。
通过分析衍射图案的形状和强度,可以确定晶体的晶系、晶胞参数和原子位置等结构信息。
电子衍射由于电子波的波长较短,能够分辨比X射线衍射更小的晶体和结构细节。
三、中子衍射:中子衍射是一种利用中子束与晶体中的原子发生相互作用后发生衍射现象来推断晶体结构的方法。
中子衍射和X射线衍射类似,但由于中子与晶体的相互作用较X射线更复杂,所得到的衍射图案在一定程度上可以提供更多的结构信息。
中子衍射通常借助中子源和衍射仪器进行测量,通过分析衍射图案的形状和强度,可以确定晶体的晶胞参数、原子位置以及磁性和动力学等信息。

高中化学常见晶体结构
高中化学常见晶体结构
1、六方晶系
六方晶系是最常见的晶体结构形式,它是比较复杂的立方晶系的一种特殊晶系结构。
它有六个面对称,每个晶体晶面都与等边三角型对称,比如金刚石的晶体结构。
2、立方晶系
立方晶系结构是一种具有八个面对称的晶体结构,每个晶体晶面都与等边正方形对称,比如氯化钠的晶体结构。
3、非六方晶系
非六方晶系是指其他晶体体系,如柱晶系、针晶系、釉晶系等,这些晶体的晶面并不都与等边三角形或等边正方形对称,比如电镀银的晶体结构。
- 1 -。


实验一、晶体结构分析一一、实验目的掌握14种空间格子的几何特征与球体密堆积理论,了解配位多面体的配置。
二、实验仪器十四种空间点阵结构模型,球形模型三、实验内容1.了解14种空间格子的几何形态,分析空间格子类型;2.熟悉密堆积理论,注意观察球体堆积时,周围空隙的类型、位置与数量情况;3.了解几种配位多面体的配置情况。
四、实验方法1.观察14种空间格子模型表征14种空间格子,用晶格常数α、β、γ和a、b、c;并判断其所属晶系。
2.观察球体密堆积模型用球体模型进行面心立方紧密堆积、六方紧密堆积和体心立方近似密堆积,分析球体周围空隙的类型、数目和位置分布。
观察分析面心立方紧密堆积、六方紧密堆积和体心立方近似密堆积的单位晶胞,注意其四、八面体空隙分布,判断其数量。
3.观察配位多面体模型模型五、实验报告1.绘制14种空间格子的几何形态,并用注明晶格常数的形式表示出所有14种空间格子;2.分析三种常见的球体堆积情况,绘制出其单位晶胞,画出其(111)、(110)(100)晶面原子排布图[ 密排六方需画出(0001)晶面 ];3.分析体心立方与面心立方单位晶胞中四、八面体空隙的位置分布与数量,并绘图;4.对不同配位多面体绘图,讨论其临界半径比。
(注:在预习报告中要将14种空间格子的几何图形画好)六、思考题面心立方结构中四面体空隙的数目有几个?他们都是如何分布的?八面体空隙有几个?如何分布?实验二、典型晶体结构分析一、实验目的掌握几种典型矿物的结构,了解晶胞的几何特征。
二、实验仪器晶体结构模型,球和短棒三、实验内容1.对照实际具体结构模型,熟悉金刚石、石墨、氯化钠、氯化铯、闪锌矿、纤锌矿、金红石、碘化镉、萤石、钙钛矿、尖晶石的晶体结构特征;2.观察层状和架状硅酸盐矿物的晶体结构模型的特点,注意观察高岭土、方石英的结构;3.标定萤石模型中所有质点的几何位置;4.组装一个晶体结构模型。
四、实验方法1.分析晶胞模型金刚石、石墨、氯化钠、氯化铯、闪锌矿、纤锌矿、金红石、碘化镉、萤石、钙钛矿、尖晶石均为一个单位晶胞,通过一个单位晶胞,分析晶胞所属空间格子类型及正负离子或原子所处的空间位置,对照模型,分析正负离子的配位数。

几种常见晶体结构分析河北省宣化县第一中学 栾春武 邮编 075131栾春武:中学高级教师,张家口市中级职称评委会委员。
河北省化学学会会员。
市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。
联系电话: E-mail :一、氯化钠、氯化铯晶体——离子晶体由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。
阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。
离子的配位数分析如下:离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为14,面上的微粒属于该单元中所占的份额为12,中心位置上(嚷里边)的微粒才完全属于该单元,即所占的份额为1。
1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。
每个Na +周围与其最近且距离相等的Na +有12个。
见图1。
| 晶胞中平均Cl -个数:8×18 + 6×12 = 4;晶胞中平均Na +个数:1 + 12×14 = 4因此NaCl 的一个晶胞中含有4个NaCl (4个Na +和4个Cl -)。
2.氯化铯晶体中每个Cs +周围有8个Cl -,每个Cl -周围有8个Cs +,与一个Cs +距离最近且相等的Cs +有6个。
晶胞中平均Cs +个数:1;晶胞中平均Cl -个数:8×18 = 1。
因此CsCl 的一个晶胞中含有1个CsCl (1个Cs +和1个Cl -)。
二、金刚石、二氧化硅——原子晶体1.金刚石是一种正四面体的空间网状结构。
每个C 原子以共价键与4个C 原子紧邻,因而整个晶体中无单个分子存在。
由共价键构成的最小环结构中有6个碳原子,不在同一个平面上,每个C 原子被12个六元环共用,每C —C 键共6个环,因此六元环中的平均C 原子数为6×112 = 12 ,平均C —C 键数为6×16 = 1。

金属中常见的三种晶格类型
《金属中常见的三种晶格类型》
金属结构的晶格是一种把金属原子依照某种排列模式组织起来的结构形式,是
金属结构特性的起源。
如今,金属中常见的三种晶格类型分别为:立方晶格结构、六方晶格结构和十二六方晶格结构。
首先,立方晶格是一种常见的结构形式,其晶格特点是它是均匀、正交的。
每
个立方晶格元素可以与直角锥截面中心的元素有6个接触,每个晶格元素都有六个相邻的邻居,称为六方晶系。
由于立方晶格的易切削性能较强,因此在金属加工中广泛应用。
具有立方晶格结构的金属有铜、铝、钢、铁、镍等。
其次,六方晶格是由六个方向相交的六角形自由组成的晶格结构。
其基本特征是,所有原子位相互等距,而且当空间有限时,每个原子的连接都有六个邻居,像以三角形排列在二维空间的六边形,但在三维空间中拓展而成,每个原子都具有六个共面夹角的晶胞边界的六面体被折叠而成的结构。
具有六方晶格结构的金属有镍、钛、钒、钽、锆等。
最后,十二六方晶格结构也称为特钟结构,它是由半径相同的面心立方晶格和
位于各八角晶体之间的六方晶格组合而成的。
在平面,它可以看作是十二个六角形,每个六角形有六个不同大小的正六边形组成,它们之间有六个接触。
十二六方结构可以把物理现象如温度和湿度等置入晶格,然后赋予晶体特殊的性质。
具有十二六方晶格的金属有磷、汞、冰石、海藻碱、金刚石等。
总之,金属中常见的三种晶格类型就是立方晶格、六方晶格和十二六方晶格,
它们非常重要的作用在于影响金属的物理特性,并将特质嵌入晶格模型中,从而为金属加工提供帮助。
晶体结构的特点分析通常采用均摊法来分析这些晶体的结构特点。
均摊法的根本原则是:晶胞任意位置上的原子如果是被n 个晶胞所共有,则每个晶胞只能分得这个原子的1/n 。
1. 氯化钠晶体由下图氯化钠晶体结构模型可得:每个Na +紧邻6个-Cl ,每个-Cl 紧邻6个+Na (上、下、左、右、前、后),这6个离子构成一个正八面体。
设紧邻的Na +与Cl -间的距离为a ,每个Na +与12个Na +等距离紧邻(同层4个、上层4个、下层4个),距离为-Cl 数为a 2。
由均摊法可得:该晶胞中所拥有的Na +数为4216818=⨯+⨯,441121=⨯+,晶体中Na +数与Cl -数之比为1:1,则此晶胞中含有4个NaCl 结构单元。
2. 氯化铯晶体每个Cs +紧邻8个Cl -,每个Cl -紧邻8个Cs +,这8个离子构成一个正立方体。
设紧邻的Cs +与Cl -间的距离为a 23,则每个Cs +与6个Cs +等距离紧邻(上、下、左、右、前、后)。
在如下图的晶胞中Cs +数为+Cs 数与812164112818=+⨯+⨯+⨯,-Cl 在晶胞内其数目为8,晶体中的-Cl 数之比为1:1,则此晶胞中含有8个CsCl 结构单元。
3. 干冰每个CO 2分子紧邻12个CO 2分子(同层4个、上层4个、下层4个),则此晶胞中的CO 2分子数为4216818=⨯+⨯。
4. 金刚石晶体(晶体硅同) 每个C 原子与4个C 原子紧邻成键,由5个C 原子形成正四面体结构单元,C-C 键的夹角为'28109︒。
晶体中的最小环为六元环,每个C 原子被12个六元环共有,每个C-C 键被6个六元环共有(用组合法计算一个碳原子所形成的4个键有C42= 6种两两相邻的组合,故一个碳原子最多可形成C42 ×2= 6× 2 =12个六元环;固定一个键,其余三个键与该键有C31 = 3种两两相邻的组合,故一个C-C 键最多可形成C31 ×2 = 6 个六元环.由"平均值原理"知一个六元环实际拥有6× 1/12 = 1/2个碳原子,拥有6× 1/6 = 1 个C-C 键.),每个环所拥有的C 原子数为211216=⨯,拥有的C-C 键数为1616=⨯,则C 原子数与C-C 键数之比为2:11:21=。
晶体结构类型晶体结构是指晶体中原子、离子或分子的排列方式和周期性。
不同的晶体结构类型具有不同的对称性和物理特性,对于研究材料的性质和应用具有重要意义。
本文将介绍几种常见的晶体结构类型及其特点。
简单立方晶体结构(Simple Cubic)简单立方是最简单的晶体结构类型,原子在三个坐标轴上等间距排列。
每个原子周围有6个临近原子,半径为原子半径的2倍。
这种结构具有最低的密堆度,只有52.4%。
简单立方晶体常见于一些稀有气体元素,如氩(Ar)和氙(Xe)。
由于其简单性,它们通常用作理论计算和模型研究中的基础。
面心立方晶体结构(Face-Centered Cubic)面心立方是最常见的金属晶体结构类型之一。
在面心立方中,除了每个顶点上都有一个原子之外,每个面中心也有一个原子。
这样一来,每个原子周围都有12个临近原子。
面心立方具有较高的密堆度,约为74%。
它具有良好的结构稳定性和热力学性质,因此在许多金属中广泛存在,如铜(Cu)、铝(Al)和银(Ag)。
体心立方晶体结构(Body-Centered Cubic)体心立方是另一种常见的金属晶体结构类型。
在体心立方中,除了每个顶点上都有一个原子之外,晶胞的中心也有一个原子。
这样一来,每个原子周围都有8个临近原子。
体心立方具有较高的密堆度,约为68%。
它具有较好的机械强度和热力学性质,在许多金属中广泛存在,如铁(Fe)和钠(Na)。
密排六方晶体结构(Close-Packed Hexagonal)密排六方是一种特殊的晶体结构类型,在该结构中,每个原子周围都有12个临近原子。
它由密堆六角形堆积而成,每层相对于前一层沿着垂直于六边形平面的轴移动1/3距离。
密排六方具有较高的密堆度,约为74%。
它在许多金属、陶瓷和半导体材料中都有发现,如钛(Ti)、锌(Zn)和碳化硅(SiC)。
复合晶体结构除了上述常见的晶体结构类型外,还存在许多复合晶体结构类型。
这些复合结构可以由多种基本结构组合而成,形成新的晶体结构。
最常见的三种晶体结构晶体结构,这个听起来像是科学家们的专属话题,其实和我们生活息息相关,真是让人意外啊!今天咱们就来聊聊最常见的三种晶体结构。
说实话,这可不是单纯的“死知识”,它们就像各自独特的明星,闪耀在物质的舞台上,各有千秋。
首先得提的就是立方晶体结构,这可是晶体界的“大明星”啊!想象一下,冰块、食盐,都是这个家族的成员。
它们的分子就像小方块一样,规规矩矩地排列在一起,仿佛在参加方阵。
嘿,这种排列让它们在物理上很稳固,也让它们的硬度和熔点都很高,真是强得让人惊叹!我们日常生活中用的食盐,虽然小小的,但它背后可是有着立方晶体的“背景”,每一颗都在默默支持着我们的美味。
再来看看六方密堆积结构,听起来是不是有点高深?其实它就像个小“蜂巢”,分子们像小蜜蜂一样,紧紧地堆在一起,形成一个个六边形的形状。
说真的,这种结构真的是聪明得让人佩服。
想想那些铝、镁,都是这个家族的成员,它们在工业上可是大显身手!轻便、强韧,真是让人不得不爱啊。
而且这种结构还让材料的密度更高,想象一下,搬家时那种感觉,能把重东西变轻的“超能力”,谁不想拥有?最后得提的是体心立方结构,这听起来可能有点复杂,但其实它的魅力不在于外表,而在于它的内涵。
就像有些人外表普通,但内心丰富。
这种结构的分子排列比较“散”,中心位置有一个原子,四周围绕着其他的原子,形成一种更立体的感觉。
比如铁就是这个家族的代表,正是因为它这种独特的排列方式,才能让铁变得强韧,适用于各种建筑和工具。
咱们日常用的铁器,都是受益于这种结构的“保护”,不信你试试,扔个铁块出去,绝对坚固得让你刮目相看!说到这里,真心觉得晶体结构不只是一堆公式和理论,它们其实就像生活中的小秘密,潜藏在我们周围,等待着我们去发现和珍惜。
每种结构都有它的特点,就像每个人都有自己的故事,组合在一起,才构成了我们这个丰富多彩的世界。
没错,科学并不只是冰冷的实验室和严肃的面孔,它其实和我们的生活息息相关。
几种常见晶体结构分析文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]几种常见晶体结构分析河北省宣化县第一中学 栾春武 邮编 075131栾春武:中学高级教师,张家口市中级职称评委会委员。
河北省化学学会会员。
市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。
联系电话: E-mail :一、氯化钠、氯化铯晶体——离子晶体由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。
阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。
离子的配位数分析如下:离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为14,面上的微粒属于该单元中所占的份额为12,中心位置上(嚷里边)的微粒才完全属于该单元,即所占的份额为1。
1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。
每个Na +周围与其最近且距离相等的Na +有12个。
见图1。
图1图2 NaCl晶胞中平均Cl-个数:8×18+ 6×12= 4;晶胞中平均Na+个数:1 +12×14= 4因此NaCl的一个晶胞中含有4个NaCl(4个Na+和4个Cl-)。
2.氯化铯晶体中每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,与一个Cs+距离最近且相等的Cs+有6个。
晶胞中平均Cs+个数:1;晶胞中平均Cl-个数:8×18= 1。
因此CsCl的一个晶胞中含有1个CsCl(1个Cs+和1个Cl-)。
二、金刚石、二氧化硅——原子晶体1.金刚石是一种正四面体的空间网状结构。
每个C原子以共价键与4个C原子紧邻,因而整个晶体中无单个分子存在。
由共价键构成的最小环结构中有6个碳原子,不在同一个平面上,每个C原子被12个六元环共用,每C—C键共6个环,因此六元环中的平均C原子数为6×112=12,平均C—C键数为6×16= 1。
C原子数: C—C键键数= 1:2; C原子数: 六元环数= 1:2。
2.二氧化硅晶体结构与金刚石相似,C被Si代替,C与C之间插氧,即为SiO2晶体,则SiO2晶体中最小环为12环(6个Si,6个O),图3 CsCl晶图4 金刚石晶最小环的平均Si原子个数:6×112=12;平均O原子个数:6×16= 1。
即Si : O= 1 : 2,用SiO2表示。
在SiO2晶体中每个Si原子周围有4个氧原子,同时每个氧原子结合2个硅原子。
一个Si原子可形成4个Si—O键,1mol Si原子可形成4mol Si—O键。
但是由此有许多学生认为二氧化硅晶体结构中一个最小的环是由8个原子构成的。
实际上,在二氧化硅晶体中每个硅原子与周围的四个氧原子的成键情况与金刚石晶体中的碳原子与周围的其它碳原子连接的情况是相同的。
即每个硅原子与周围的四个氧原子构成一个正四面体。
只是每个氧原子又处在由另一个硅原子为中心的一个正四面体上。
即每个氧原子为两个硅氧四面体共用。
如上图所示。
从此图中可以明确看出,构成二氧化硅晶体结构的最小环是由12个原子构成的椅式环,注意图中∠O-Si-O=109°28′。
三、干冰——分子晶体干冰晶体是一种立方面心结构,立方体的八个顶点及六个面的中心各排布一个CO2分子,晶胞是一个面心立方。
一个晶胞实际拥有的CO2分子数为四个(均摊法),每个CO2分子周围距离相等且最图7 CO2晶近的CO2分子共有12个。
分子间由分子间作用力形成晶体。
每个CO2分内存在共价键,因此晶体中既有分子间作用力,又有化学键,但熔、沸点的高低由分子间的作用力决定,重要因素是相对分子质量,因此当晶体熔化时,分子内的化学键不发生变化。
每个结构单元中含CO2分子数目为:8×18+ 6×12= 4四、石墨——混合型晶体石墨晶体是层状结构,在每一层内有无数个正六边形,同层碳原子间以共价键结合,晶体中C—C的夹角为120℃,层与层之间的作用力为范德瓦尔斯力,每个C原子被六个棱柱共用,每六个棱柱实际占有的C原子数为2个。
每个正六边形拥有的C原子数为:6×13=2 ;每个C原子平均形成32个共价键,C原子数与C—C键数之比为2 : 3。
石墨的独特结构决定了它的独特性质,该晶体实际介于原子晶体、分子晶体、金属晶体之间,因此具有各种晶体的部分性质特点,是一种混合型晶体。
如熔点高、硬度小、能导电等。
五、固态金属单质——金属晶体金属(除金属汞外)在常温下都是晶体,在金属中,金属原子好像许多硬球一样一层一层紧密地堆积着。
每个金属原子周围都有许多相同的金属原子围绕着。
其实由于金属原子的最外层电子都较少,故金属原子容易失去电子变成金属离子。
金属原子释放电子后形成的离子按一定图8 石墨的结规律堆积,释放的电子则在这个晶体里自由运动,这就是自由电子。
在金属晶体的内部,金属离子和自由电子之间存在较强的相互作用力,这个作用力便是金属键。
因此有人形象地将金属键比喻为金属阳离子沉浸在自由电子的海洋里。
例题分析:【例题1】现有四种晶体,其离子排列方式如下图所示,其中化学式正确的是A B CD解析:A 选项中处于顶点的B 原子8个,处于体心的A 原子1个,故A 的化学式为AB 。
B 选项中E 和F 均为4×18 = 12,故B 的化学式为EF 。
C 选项中位于体心的X 原子1个,位于面心的Y 原子为 6×12 =3,位于顶点的Z 原子8×18 =1,故C 的化学式为XY 3Z 。
D 选项与NaCl 的结构相同,故D 的化学式为AB 。
答案:C 、DA B AB 2F EEF 2X ZYXY 3ZAB AB点拨:均摊法确定某些晶体的化学式的方法:均摊法是指每个晶体中平均拥有的离子数目。
例如立方晶体中粒子个数比的求法:①处于顶点的粒子,同时为8个晶胞共有,每个粒子有18属于该晶胞;②处于棱上的粒子,同时为4个晶胞共有,每个粒子有14属于该晶胞;③处于面上的粒子,同时为2个晶胞共有,每个粒子有12属于该晶胞;④处于晶胞内的粒子,则完全属于该晶胞。
对于非长方体或正方体晶胞中粒子对晶胞的贡献看具体情况而定。
如石墨晶体,晶胞每一层内碳原子排列成正六边形,其顶点对六边形的贡献为13。
【例题2】NaCl的晶胞如图,每个NaCl晶胞中含有的Na+离子和Cl-离子的数目分别是A. 14,13B. 1,1C. 4,4D. 6,6【解析】Na+离子的数目:8×18+ 6×12= 4个;Cl-离子的数目:1+12×14= 4个答案:C【例题3】(2010年全国卷)下面关于SiO 2晶体网状结构的叙述正确的是A .最小的环上,有3个Si 原子和3个O 原子B .最小的环上,Si 和O 原子数之比为1 : 2C .最小的环上,有6个Si 原子和6个O 原子D .存在四面体结构单元,O 处于中心,Si 处于4个顶角解析:二氧化硅是原子晶体,结构为空间网状,存在硅氧四面体结构,硅处于中心,氧处于4个顶角,在SiO 2晶体中,每6个Si 和6个O 形成一个12元环(最小环),所以C 选项正确,A 、B 、D 选项均错误。
答案:C点拨:该题考查的是考生的空间想象能力和信息迁移能力,实际上第三册课本第一单元里面有SiO 2晶体网状结构结构示意图。
再次说明了化学学习要重视课课本,以本为本。
【例题4】(2010江苏高考)乙炔是有机合成工业的一种原料。
工业上曾用CaC 2与水反应生成乙炔。
(1) CaC 2中C 22-与O 22+互为等电子体,O 22+的电子式可表示为 ;1mol O 22+中含有的π键数目为 。
(2)将乙炔通入[Cu(NH 3)2]Cl 溶液生成Cu 2C 2红棕色沉淀。
Cu +基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。
丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。
CaC2晶体中1个Ca2+周围距离最近的C22-数目为。
解析:(1)根据等电子体原理可知,O22+的电子式,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键(2)Cu为29号元素,要注意3d轨道写在4s轨道的前面同时还有就是它的3d结构,Cu+ 的基本电子排布式为1s22s22p63s23p63d10(3)—通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp和sp2杂化,同一直线上有3个原子。
(4)依据晶胞示意图可以看出,从晶胞结构图中可以看出,1个Ca2+ 周围距离最近的C22-有4个,而不是6个,要特别主要题给的信息。
答案:(1)2NA(2)1s22s22p63s23p63d10(3)sp杂化 sp2杂化 3 (4)4【例题5】石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。
下列说法正确的是A.石墨烯与石墨互为同位素B.0.12g石墨烯中含有*1022个碳原子C石墨烯是一种有机物D.石墨烯中的碳原子间以共价键结合【解析】同位素的研究对象是原子,A 选项错误;0.12g 石墨烯的物质的量为,所含碳原子个数为,B 选项错误;有机物一般含有碳、氢元素,C 选项错误;由图示可知,石墨烯中碳原子间均为共价键结合,D 选项正确。
答案:D【例题6】(2010江苏高考)乙炔是有机合成工业的一种原料。
工业上曾用CaC 2与水反应生成乙炔。
(1) CaC 2中C 22-与O 22+互为等电子体,O 22+的电子式可表示为 ;1mol O 22+中含有的π键数目为 。
(2)将乙炔通入[Cu(NH 3)2]Cl 溶液生成Cu 2C 2红棕色沉淀。
Cu +基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H 2C =CH -C≡N)。
丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) CaC 2晶体的晶胞结构与NaCl 晶体的相似(如右图所示),但CaC 2晶体中含有的中哑铃形C 22-的存在,使晶胞沿一个方向拉长。
CaC 2晶体中1个Ca 2+周围距离最近的C 22-数目为 。
解析:(1)根据等电子体原理可知,O 22+的电子式 ,在1mol 三键含有2mol 的π键和1mol 的δ键,故1mol O 22+中,含有2N A 个π键O O2+(2)Cu 为29号元素,要注意3d 轨道写在4s 轨道的前面同时还有就是它的3d 结构,Cu + 的基本电子排布式为1s 22s 22p 63s 23p 63d 10(3)—通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp 和sp 2杂化,同一直线上有3个原子。