分子结构与晶体结构完美版
- 格式:pdf
- 大小:352.06 KB
- 文档页数:11

单晶结构解析讲义完美版晶体结构解析1.Shelxtl 使⽤流程※解析原始⽂件有hkl⽂件(或raw⽂件),包含衍射数据;p4p⽂件,包含晶胞参数※为⼀个晶体的数据建⽴project,该项⽬下所有⽂件具有相同的⽂件名;⼀旦在XPREP 中发⽣hkl⽂件的矩阵转换,则需要输出新⽂件名的hkl等⽂件,因此要建⽴新的project。
※⾸先运⾏XPREP,寻找晶体的空间群※然后运⾏XS,根据XPREP设定的空间群,寻找结构初解※在Xshell中观察初解是否合理,如不合理,需重回XPREP中设定其他的空间群2.Xshell 使⽤流程※找出重原⼦或者确定性⼤的原⼦※找出其余⾮氢原⼦※精修原⼦坐标※精修各项异性参数※找到氢原⼦(理论加氢或差值傅⾥叶图加氢)※反复精修,直到wR2等指标收敛。
最后的R1<0.06(0.08) wR2<0.16(0.18)※通过HTAB指令寻找氢键,判定氢的位置是否合理,并且将相关氢键信息通过HTAB和EQIV指令写进ins⽂件中※将原⼦排序(sort)3.cif ⽂件⽣成和检测错误流程※在步骤1、2完成后,在ins⽂件中加⼊以下三条命令bond $Hconfacta※此时⽣成了cif和fcf⽂件,将cif⽂件拷贝到planton所在⽂件夹中检测错误,也可以通过如下在线检测⽹址:/doc/aaaed6d749649b6648d74737.html /services/cif/checkcif.html※根据错误提⽰信息,修改或重新精修,将A、B类错误务必全部消灭,C类错误尽量消灭。
4.Acta E 投稿准备流程投稿前,请务必切实做好如下⼯作:※按步骤1、2、3解析晶体并⽣成相应cif和fcf⽂件。
※准备结构式图(Chemical structural diagram)、分⼦椭球图(Molecular ellipsoid diagram)和晶胞堆积图(Packing diagram),最好是pdf格式。



完美晶体的名词解释在材料科学领域,晶体是一种具有高度有序结构的固态物质。
晶体的原子、离子或分子排列呈现出规则的周期性重复性,使得晶体在宏观上呈现出平整的外观。
完美晶体是指具有无缺陷的晶体结构,其中原子、离子或分子的排列是完全有序的,形成了一种理想的周期性结构。
完美晶体的特征主要包括以下几个方面。
首先,完美晶体的排列是无缺陷的,即没有晶体缺陷存在。
晶体缺陷是指晶体结构中的缺陷点、线或面,由各种原因引起,如原子位错、晶格缺陷或外在应力等。
这些缺陷会影响晶体的力学性能、电学性能和光学性能,因此,完美晶体的无缺陷结构对于实现材料的理想性能至关重要。
其次,完美晶体的晶界是完全清晰的。
晶界是指两个晶粒之间的交界面,晶界上的原子排列通常会发生畸变,产生晶界能,限制了晶界的进一步生长。
完美晶体中的晶界能应尽可能小,以使晶体具有较高的热稳定性、力学强度和热导率。
此外,完美晶体的原子、离子或分子排列是具有周期性的。
晶体的周期性结构对于材料的性能有很大影响,如电子结构和光学性质。
在完美晶体中,晶体结构具有高度有序的平衡态,各个原子之间相对位置的关系是经过优化的,以实现材料的最佳性能。
然而,完美晶体在实际应用中较为罕见。
主要原因是在晶体生长过程中,由于外界条件和材料自身因素的影响,很难实现完美晶体的生长。
杂质、位错、晶粒边界等晶体缺陷的存在会导致晶体结构的畸变,从而影响晶体的性能。
然而,尽管完美晶体难以实现,科学家和工程师们正在不断努力寻求制备近乎完美的晶体材料。
通过精确的晶体生长和优化的制备工艺,可以在很大程度上减少晶体缺陷的生成。
例如,采用单晶生长技术和高纯度的起始材料,可以制备出较为接近完美晶体结构的单晶材料。
此外,通过控制晶体生长条件和添加适量的掺杂剂,也可以改善晶体的品质。
完美晶体的研究对于材料科学的发展具有重要意义。
它不仅有助于深入理解晶体结构与性能之间的关系,还为优化材料的设计和制备提供了理论和实践基础。


材料化学导论第2章-完美晶体的结构第2章完美晶体的结构绝⼤多数材料以固体形态使⽤。
因此研究固体的结构⼗分重要。
固体可以划分为如下种类:⽆定形体和玻璃体[固体中原⼦排列近程有序、远程⽆序](Amorphous and Glassy)固体(Solid states) 完美晶体[原⼦在三维空间排列⽆限延伸(Perfect crystals)有序,并有严格周期性]晶体(Crystals)缺陷晶体[固体中原⼦排列有易位、错(Defect crystals)位以及本体组成以外的杂质] 由于晶体结构是固体结构描述的基础,我们在本章中描述完美晶体的结构,下⼀章则讲授缺陷晶体的结构。
§2.1 晶体的宏观特征和微观结构特点§2.1.1晶体的宏观特征晶体的宏观特征主要有四点:1.规则的⼏何形状所有晶体均具有⾃发地形成封闭的⼏何多⾯体外形能⼒的性质。
规则的⼏何多⾯体外形表明晶体内部结构是规则的。
当然晶体的外形由于受外界条件的影响,往往同⼀晶体物质的各种不同样品的外形可能不完全⼀样。
因此,晶体的外形不是晶体品种的特征因素。
例如,我们⼤家熟知的⾷盐晶体在正常结晶条件下呈⽴⽅晶体外形,当在含有尿素的母液中结晶时,则呈现出削取顶⾓的⽴⽅体甚或⼋⾯体外形。
2.晶⾯⾓守恒在适当条件下晶体能⾃发地围成⼀个凸多⾯体形的单晶体。
围成这样⼀个多⾯体的⾯称作晶⾯。
实验测试表明,同⼀晶体物质的各种不同样品中,相对应的各晶⾯之间的夹⾓保持恒定,称作晶⾯⾓守恒。
例如,⽯英晶体根据结晶条件不同,可有各种⼏何外形,但对应晶⾯之间的夹⾓却是不变。
晶体的晶⾯相对⼤⼩和外形都是不重要的,重要的是晶⾯的相对⽅向。
所以,可以采⽤晶⾯法线的取向表征晶⾯的⽅位,⽽共顶点的晶⾯法线的夹⾓表⽰晶⾯之间的夹⾓。
3.有固定的熔点晶体熔化过程是晶体长程序解体的过程。
破坏长程序所需的能量就是熔化热。
所以晶体具有特定的熔点。
反之,也说明晶体内部结构的规则性是长程有序的。

第六章分子结构与晶体结构教学内容:1.掌握杂化轨道理论、2.掌握两种类型的化学键(离子键、共价键)。
3.了解现代价键理论和分子轨道理论的初步知识,讨论分子间力和氢键对物质性质的影响。
教学时数:6学时分子结构包括:1.分子的化学组成。
2.分子的构型:即分子中原子的空间排布,键长,键角和几何形状等。
3.分子中原子间的化学键。
化学上把分子或晶体中相邻原子(或离子)之间强烈的相互吸引作用称为化学键。
化学键可分为:离子键、共价键、金属键。
第一节共价键理论1916年,路易斯提出共价键理论。
靠共用电子对,形成化学键,得到稳定电子层结构。
定义:原子间借用共用电子对结合的化学键叫做共价键。
对共价键的形成的认识,发展提出了现代价键理论和分子轨道理论。
1.1共价键的形成1.1.1 氢分子共价键的形成和本质(应用量子力学)当两个氢原子(各有一个自旋方向相反的电子)相互靠近,到一定距离时,会发生相互作用。
每个H原子核不仅吸引自己本身的1s电子还吸引另一个H原子的1s电子,平衡之前,引力>排斥力,到平衡距离d,能量最低:形成稳定的共价键。
H原子的玻尔半径:53pm,说明H2分子中两个H原子的1S轨道必然发生重叠,核间形成一个电子出现的几率密度较大的区域。
这样,增强了核间电子云对两核的吸引,削弱了两核间斥力,体系能量降低,更稳定。
(核间电子在核间同时受两个核的吸引比单独时受核的吸引要小,即位能低,∴能量低)。
1.1.2 价键理论要点①要有自旋相反的未配对的电子H↑+ H↓ -→ H↑↓H 表示:H:H或H-H②电子配对后不能再配对即一个原子有几个未成对电子,只能和同数目的自旋方向相反的未成对电子成键。
如:N:2s22p3,N≡N或NH3这就是共价键的饱和性。
③原子轨道的最大程度重叠(重叠得越多,形成的共价键越牢固)1.1.3 共价键的类型①σ键和π键(根据原子轨道重叠方式不同而分类)s-s :σ键,如:H-Hs-p :σ键,如:H-Clp-p :σ键,如:Cl-Cl π键,单键:σ键双键:一个σ键,一个π键叁键:一个σ键,两个π键例:N≡Nσ键的重叠程度比π键大,∴π键不如σ键牢固。
σ键π键原子轨道重叠方式头碰头肩并肩能单独存在不能单独存在沿轴转180O符号不变符号变牢固程度牢固差含共价双键和叁键的化合物的重键容易打开,参与反应。
②非极性共价键和极性共价键根据共价键的极性分(电子云在两核中的分布),由同种原子组成的共价键为非极性共价键。
例: H2,O2,N2等一般来说,不同种原子组成的共价键为极性共价键。
例: HCl,H2O,NH3等共价键极性的强弱,可由成键原子的电负性的大小来表示。
极性共价键是非极性共价键和离子键的过渡键型。
③配位共价键(配位键) :原子或离子有空轨道,有孤对电子。
1.1.4共价键的特征饱和性:一个原子有几个未成对电子,就只能和同数目的自旋方向相反的未成对电子配对成键。
方向性:共价键尽可能沿着原子轨道最大重叠的方向形成。
如形成HCl时,只有氢原子沿着X轴与氯原子的P轨道成键时,轨道重叠最多。
1.2、键参数表征共价键的物理量叫键参数。
键能:共价键的强度键长、键角:以共价键形成的分子的空间构型(几何构型)1、键能:衡量共价键强弱的物理量。
指298.15K,101.3KPa条件下,AB(g)-→ A(g)+ B(g)所需的E(KJ/mol)双原子分子,其键能 = 离解能D,如Cl2,HCl多原子分子,指的是平均键能:2、键长(用X射线法):成键的两个原子核之间的距离。
两个原子共价半径之和 = 键长键长越短,键能越大,共价键越牢固。
3、键角键长和键角确定,分子构型就确定了。
价键理论比较简明地阐述了共价键的形成过程和本质,并成功地解释了共价键的饱和性和方向性,但在解释分子的空间构型(结构)方面发生一定困难。
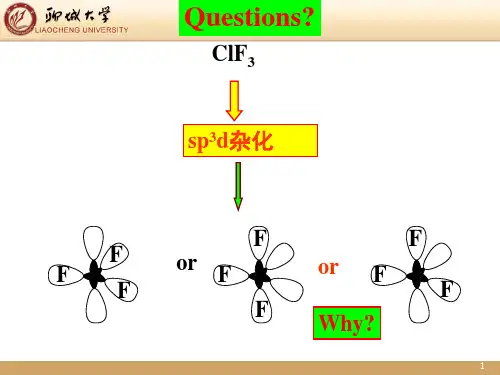
第二节杂化轨道理论和分子的几何构型CH4,C的四价问题1931年,Pauling、Slater在价键理论的基础上,提出杂化轨道理论。
一、杂化轨道的概念1. 什么叫杂化轨道?能量相近的原子轨道混合起来,重新组成一组能量相同的轨道,这一过程,称原子轨道杂化,组成的新轨道叫杂化轨道。
2. 原子轨道杂化后,使一头大,电子云分布更集中,成键能力更强。
3.杂化后,体系的能量降的更低, 生成的分子也更稳定。
二、杂化轨道的类型和体系分子的几何构型1. SP杂化和分子的几何构型一个S轨道和一个轨道P 之间进行的杂化。
例: HgCl2Hg 5d106s2BeCl2,ⅡB族形成的AB2型分子都为直线形。
2. SP2杂化和分子的几何构型一个S轨道和二个轨道P 之间进行的杂化.例:BF33. SP3杂化和分子的几何构型一个S轨道和三个轨道P 之间进行的杂化.例:CCl4如CH4,SiH4,SiCl4,CCl4等三、不等性杂化1、有孤对电子参加的不等性杂化①H2O分子的几何构型孤对电子不成键,能量较低,对成键电子云排斥更大,使两个O-H键角压缩成104.5O,(而正四面体型为109.5O)(两孤对电子之间夹角>109.5O)斥力:孤对电子-孤对电子>孤对电子-成键电子>成键电子-成键电子②NH3的几何构型2、无孤对电子参加的不等性杂化电子对数构型实例2 直线型BeCl2、HgCl23 平面三角形BF3、BCl34 正四面体CH4、NH4+、CCl4、SiCl4、5 三角双锥PCl5、PF3Cl2、SbCl56 正八面体SF6、MoF6第三节离子键一、离子键的形成和特征1.离子键的形成电负性相差大的元素相遇,一失电子,一得电子,它们之间以静电引力相结合,形成离子键。
阴阳离子间具有静电引力,两原子的电子云间存在排斥力,两原子核间存在相互吸引力,当两原子接近到一定距离,引力=斥力,(此时整个体系能量最低),形成离子键。
2.离子键的特征①本质:阴、阳离子间的静电引力②无方向性、饱和性只要空间允许,尽可能多地吸引带相反电荷的离子(任何方向,尽可能多)。
但总体来说,有一定比例。
二.离子的特性1、离子的电荷简单离子的电荷由原子得到或失去形成的,其电荷绝对值为得失的电子数。
离子化合物AmBn:A n+,B m-2、离子的电子层结构简单阴离子的电子构型,一般与同周期希有气体原子电子层构型相同。
简单的阳离子构型:3、离子半径将阴阳离子看成是保持着一定距离的两个球体。
d = r++ r-单位:pm(10-12m)规律:①同一元素:负离子半径>原子半径>正离子半径低价负离子半径>高价负离子半径低价正离子半径>高价正离子半径例:②同一周期从左到右,阳离子:正电荷数↑,半径↓阴离子:负电荷数↓,半径↓③同一主族电荷数基本相同,从上到下,半径↑(∵电子层增加)离子半径↓,离子间引力↑,离子键强度↑,熔、沸点↑,硬度↑第四节分子间力和分子晶体一.分子间力1、分子的极性任何以共价键结合的分子中,存在带正电荷的原子核、带负电荷的电子。
∴分子中存在正电荷中心(“+”极)、负电荷中心(“-”极)。
两中心重合,整个分子无极性,称为非极性分子;两中心不重合,整个分子有极性,称为极性分子。
①由共价键结合的双原子分子,键的极性和分子极性一致;例: O2、N2、H2、Cl2非极性键,非极性分子。
HI、HBr 极性键,极性分子。
②由共价键结合的多原子分子,键的极性与分子极性不完全一致,而与几何构型有关③分子极性的大小通常用偶极矩来度量。
μ = q × dμ:偶极矩,由实验测得;是矢量,方向从正极到负极q:原子的正或负中心,一端的电荷量,单位:库仑(C),1个电子的电量 = 1.602×10-19Cd:正负电荷中心间距离,单位:米(m),其数量级相当于原子距离,≈10-11 mμ≈10-30 C·m测定μ,①可判断分子极性大小;②可判断多原子分子是否具有对称结构。
2.分子的变形性①什么叫分子的变形性?在外电场作用下,分子中的正负电荷中心的位置发生改变,产生"诱导偶极",这种现象称为分子的极化或变形极化。
分子受极化后,分子外形发生改变,称为分子的变形。
②影响分子变形性的内在因素分子中的原子数越多,原子半径越大(分子越大),分子中电子数越多,变形性越大。
③分子在外电场作用下的变形程度,用极化率α来度量3.分子间力①分子间力范德华,1873年首先提出,又称为范德华力。
说明分子间距离很近时,存在作用力。
a)色散力(一切分子之间)一段时间内某一瞬间总的情况(由于原子核、电子云的不断运动)色散力与分子的变形性(以极化率度量)成正比,与分子间距离R6成反比。
色散力↑,熔、沸点↑。
b)诱导力极性分子非极性分子产生诱导偶极诱导力与极性分子的μ2成正比;与被诱导分子的变形性成正比;与分子间距离的R6成反比。
发生在非极性分子与极性分子之间及极性分子与极性分子之间。
c)取向力(极性分子与极性分子之间)诱导力与极性分子的μ2成正比;与T成反比;与分子间距离的R6成反比。
非极性分子之间,存在:色散力 P224,表8-5极性分子与非极性分子间:色散力、诱导力极性分子之间,存在:色散力、取向力、诱导力②分子间作用力的特性a)分子间作用力是存在于分子间的一种永久性吸引作用。
b)是一种短程力,作用范围:300-500pm,因此,只有当分子之间距离很近时,才有分子间作用力。
当距离很远时,这种力消失。
c)没有方向性和饱和性。
(分子间力实质为静电引力)d)强度为化学键的1/10~1/100 。
e)除μ很大的分子(如H2O)外,分子间作用力以色散力为主。
③分子间作用力对物质物理性质的影响4、氢键氢化物ⅦA HF HCl HBr HIb.p.(℃)19.5 -84.9 -67 -35.4ⅥA H2O H2S H2Se H2TeⅤA NH3PH3AsH3SbH3①氢键形成的条件O、N、F电负性大,原子半径小,具有孤对电子,易形成氢键。
注意:a)不同分子亦会形成氢键 H3N……H-O-Hb)分子内亦会形成氢键②氢键的强度和性质a)强度:比化学键小得多与分子间力相同数量级,是键能的1/20。
b)具有方向性和饱和性二.物质溶解度原理结构相似者(溶剂、溶质结构相似)易溶,即“相似相溶”。
L-L:CH3OH,C2H5OH在水(H-O-H)中易溶。
S-L:离子型盐易溶于氢键型溶剂(极性大);非极性化合物易溶于非极性或低极性溶剂。
不论何时,都要尽可能让思考与反省预见到突发的激情,这于审慎者可轻而易举做到。
心烦意乱之时,首先要做的就是意识到这一点。
先控制住自己的情绪,下决心不再使之加剧。
有了这种高明的防范,就能很快终止怒气。
要懂得制怒之法,且止息于当止之时:奔跑时停下来最难;狂怒时保持头脑清醒也一样难。
过分激动,不论程度高低,都会影响理智。
一旦对发怒有了这种警醒,就不会使你因怒气而失控,也不会使你损害良好的辨别力。