第十五章 伏安法与极谱法
- 格式:doc
- 大小:72.00 KB
- 文档页数:7



伏安法与极谱法一、概论伏安法与极谱分析是一种特殊的电解方法,以小面积易极化的电极作为工作电极,以大面积不易极化的电极作为参比电极组成电解池,由所得的电流-电压特性曲线来进行定量/定性分析。
以滴汞为工作电极时的伏安法称为极谱法,相对极谱法伏安法重现性较差。
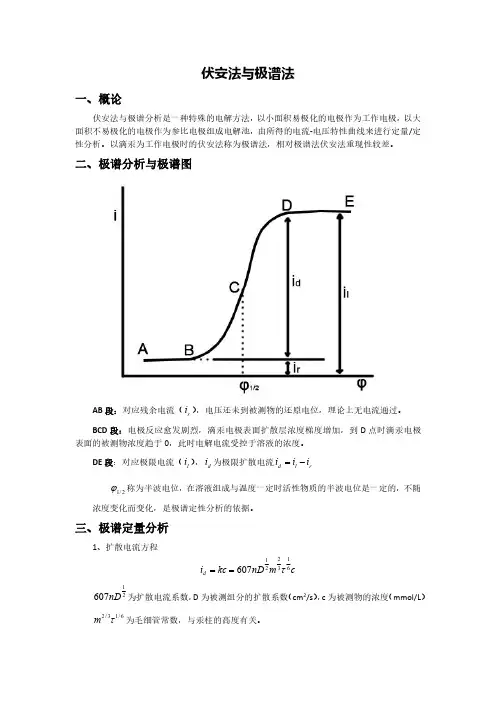
二、极谱分析与极谱图AB 段:对应残余电流(r i ),电压还未到被测物的还原电位,理论上无电流通过。
BCD 段:电极反应愈发剧烈,滴汞电极表面扩散层浓度梯度增加,到D 点时滴汞电极表面的被测物浓度趋于0,此时电解电流受控于溶液的浓度。
DE 段:对应极限电流(l i ),d i 为极限扩散电流rl d i i i -=2/1ϕ称为半波电位,在溶液组成与温度一定时活性物质的半波电位是一定的,不随浓度变化而变化,是极谱定性分析的依据。
三、极谱定量分析1、扩散电流方程cm nD kc i d 613221607τ==21607nD 为扩散电流系数,D 为被测组分的扩散系数(cm 2/s ),c 为被测物的浓度(mmol/L )6/13/2τm 为毛细管常数,与汞柱的高度有关。
2、三切线法测量波高3、标准加入法XS X S S X hV V V H hV c c -+=)(h 为加标准溶液前的波高,H 为加标准溶液后的波高。
4、多组分分别测定:V E 2.0<∆可分别测量四、干扰电流及其消除方法残余电流迁移电流极谱极大氧电流产生微量杂质的电解电流电迁移产生的电流汞滴生长产生的对流效应导致的极谱曲线上的突发电流峰氧气在电极被还原消除作图法扣除加入大量支持电解质(惰性)加入表面活性剂使汞滴表面张力均匀通惰性气体、在中性或碱性下加Na2SO3、强酸中加入Fe 粉五、极谱法特点1、电解是在静止、不搅拌的条件下进行的2、该方法不适用于阴离子的测定,汞滴作阳极时易被氧化3、汞滴与周围溶液始终保持新鲜,保证了在不同电压下的重现性4、汞易纯化,但易堵塞毛细管。

第15章伏安法与极谱法15.1 在直流极谱中,当到达极限扩散电流区域后,继续增加外加电压,是否还引起滴汞电极电流的改变及参加电解反响的物质在电极外表浓度的变化?在线形扫描伏安法中,当电流到达峰电流后,继续增加外加电压,是否引起电极电流的改变及参加电极反响物质在电极外表浓度的改变?答:从电流极谱波可知,当到达极限扩散电流区域后,继续增加外加电压,滴汞电极电流不会改变,参加电解反响的物质在电极外表浓度不会变化。
当到达峰电流后,继续增加外加电压,电极电流会减小,溶液中的可复原物质要从更远处向电极外表扩散,扩散层厚度改变,参加电极反响物质在电极外表浓度为零。
15.2 对于可逆极谱波,极谱波上每一点都受扩散速度所控制,而对于不可逆极谱呢?答:对于不可逆极谱波,一般情况在波的底部,电流完全受电极反响的速度所控制,波的中部,电流既受电极反响速度控制也受扩散速度控制,到达极限电流时,平安受扩散速度控制。
15-3 根据Cottrell 方程式来测量扩散系数D。
如果在极谱测得2×10-4mol·L-1μA,汞滴的生长周期为2s,汞滴落下时的体积为3,电子转移数为2,试计算该物质的扩散系数。
解:根据Cottrell 方程式得:id=nFAD01/2C0b/ t那么扩散系数为D0 那么D0= (d2·∏·t)/(n·F·A·C 0b)2×10-6A t=2s C0b=2×10-4mol·L-1 n=2F=96485 C/mol V=4/3∏R3×10-6dm3⇨×10-3 dm⇨A=4∏R2=4××××10-6=×10-4 dm2⇨D0××10-12×2)/(2×96485C/mol××10-4 dm2×2×10-4 mol·L-1)×10-6 (cm2/s)·s-1 ,滴下时间为3.87 s,该离子的扩散系数为8×10-6 cm2/s,其浓度为4×10-3 mol·L-1 ,试计算极限扩散电流及扩散电流常数。





第15章伏安法与极谱法15、1 在直流极谱中,当达到极限扩散电流区域后,继续增加外加电压,就是否还引起滴汞电极电流得改变及参加电解反应得物质在电极表面浓度得变化?在线形扫描伏安法中,当电流达到峰电流后,继续增加外加电压,就是否引起电极电流得改变及参加电极反应物质在电极表面浓度得改变?答:从电流极谱波可知,当达到极限扩散电流区域后,继续增加外加电压,滴汞电极电流不会改变,参加电解反应得物质在电极表面浓度不会变化。
当达到峰电流后,继续增加外加电压,电极电流会减小,溶液中得可还原物质要从更远处向电极表面扩散,扩散层厚度改变,参加电极反应物质在电极表面浓度为零、15。
2对于可逆极谱波,极谱波上每一点都受扩散速度所控制,而对于不可逆极谱呢?答:对于不可逆极谱波,一般情况在波得底部,电流完全受电极反应得速度所控制,波得中部,电流既受电极反应速度控制也受扩散速度控制,达到极限电流时,安全受扩散速度控制。
15—3 根据Cottrell方程式来测量扩散系数D。
如果在极谱测得2×10-4mol·L—1得某物质得极限扩散电流为0、520μA,汞滴得生长周期为2s,汞滴落下时得体积为0.5mm3,电子转移数为2,试计算该物质得扩散系数。
解:根据Cottrell方程式得:id=nFAD01/2C0b/则扩散系数为D0则D0= (d2·∏·t)/(n·F·A·C0b)2id=0、520×10-6A t=2sC0b=2×10—4mol·L—1 n=2F=96485 C/mol V=4/3∏R3=0。
5×10-6dm3⇨R=4、9×10-3dm⇨A=4∏R2=4×3.14×4.9×4。
9×10-6=3、04×10-4dm2⇨D0=(0。
520×0.520×10-123。
14×2)/(2×96485C/mol×3、04×10—4dm2×2×10-4mol·L—1)ﻩ=1、23×10-6(cm2/s)15-4 某两价阳离子在滴汞电极上还原为金属并生成汞齐,产生可逆极谱波。
滴汞流速为1。
54mg·s-1 ,滴下时间为3、87 s,该离子得扩散系数为8×10-6 cm2/s,其浓度为4×10—3mol·L—1 ,试计算极限扩散电流及扩散电流常数、解: 根据伊尔科维奇方程式id=607·nD1/2m2/3t1/6C由题意知:D=8×10-6cm2/s C=4×10—6m mol·L-1 m=1、5mg/s t=3.87s =>id=607×2×(8×10—6) ×(1。
5) 2/3×(3、87)1/6×4×10-6=23(μA)则扩散电流常数=607·n·D1/2=607×2×(8×10—6)1/2=3。
4315-5在同一试液中,从三个不同得滴汞电极得到下表所列数据。
试估算电极A与C得id/c值解: 有尤考维奇方程可知:id=607nDm t c根据题意:B电极:id/c=4.86t=2、36s qm=3。
92mg/s代入上式得:607nD1/2=i d/m2/3t1/6c=4、86/(2361/6*3、922/3 )=1.69对A电极而言:id/c=607nD1/2m2/3t1/6=1。
69*0、9822/3*6。
531/6=2、29对C电极而言:id/c=607nD1/2m2/3t1/6=1、69*6。
962/3*1.371/6=6、5115-6酸性介质中,Cu2+得半波电位约为0V,Pb2+得半波电位约为—0。
4V,Al3+得半波电位在氢波之后。
试问:用极谱法测定铜中微量得铅与铝中微量得铅时,何者较易?为什么?解:用极谱法测定铝中微量得铅容易点因为铝与铅得半波电位差比铜与铅得半波电位差大,且铝得半波电位在氢之后,所以在酸性溶液中不能测定,干扰小15-7在3mol/L盐酸介质中,Pb与In还原为金属产生极谱波。
它们得扩散系数相同,半波电位分别为—0.46V与-0、66V。
当0、001mol/L得与未知浓度得共存时,测得它们极谱波高分别为30mm与45mm,计算In得浓度、ﻫ解:水中铅、铟离子得浓度分别为C(Pb)、C(In),C(Pb)=0、001mol/L;30=2kC(Pb);=3kC(In);ﻫC(In)=0.001mol/Lﻫ15—8在3mol/L盐酸介质中还原45k=15000;ﻫ时,所产生得极谱波得半波电位为-0、46V,今在滴汞电极电位为-0、70V时(已经完全浓差极化)测得下列各溶液得电流值为溶液电流i/vAﻫ(1)6mol/LHCl25mL,稀释至50mL; 0。
15ﻫ(2)6mol/LHCl25mL,加试样溶液10。
00ml稀释至50mL; 1.23ﻫ(3)6mol/LHCl25mL,加0。
001mol/L标准溶液5、00mL稀释至50mL; 0、94(1)计算试样溶液中得铅得质量浓度(以mg/mL计); ﻫ(2)在本实验中,除采用通惰性气体除氧外,尚可用什么方法除氧?0。
94-0、15=k*0。
001*5/50ﻫk=7900ﻫ1、解:设试样中铅得浓度为Cxﻫ23—0.15=k*10*Cx/50ﻫCx=0.000684mmol/mL=0、14mg/mL15-9.采用加入标准溶液法测定某试样中得微量镉。
取试样1。
000g溶解后,加入NH3—NH4Cl底液,稀释至50mL、取试样10.00mL,测得极谱波高为10格。
加入标准溶液(含镉1mg·mL·1 )0、50mL。
后,波高为20格、计算试样中镉得质量分数.解:h=kCxH=k(VxCx+VsCs)/(Vx+Vs)即10=kCx20=k(10、00Cx+0。
50*1)/(10。
00+0、50)解得Cx=0、5/11 mg·mL·12+ =0。
5*50/11*1。
000*103WCd=0。
23%15-10。
用极谱法测定某溶液中得微量铅、取试液5 mL,加1g·L·1明胶5 mL,用水稀释至50mL.倒出部分溶液于电解杯中,通氮气10min,然后在-0.2~-0.6V间记录极谱图,得波高50格、另取5 mL试液,加标准铅溶液(0。
50mg·mL-1)1、00mL,然后照上上述步骤同样处理,得波高80格。
(1) 解释操作规程中个步骤得作用;(2)计算式样中Pb2+得含量(以g·L·1计);(3) 能不能用加铁粉、亚硫酸钠或通二氧化碳除氧?解:(1) ①取试液5 mL,加1g·L·1明胶5 mL,作用消除极谱极大②用水稀释至50mL定容,③倒出部分溶液于电解杯中,通氮气10min,作用就是为了除氧,④在-0.2—0、6间使Pb2+被还原记录极谱图。
⑵h=kCxH=k(Cx+0、50*1、00)即50=kCx80=k(Cx+0.50)解得Cx=2、5/3 mg试样中Pb2+ 得含量为2、5/3*5 g·L·1=0.167 g·L·1⑶不能加铁粉、亚硫酸钠或通二氧化碳除氧因为:①Fe+2H+=Fe2++H2↑, Fe消耗H+,使溶液酸性不足, Pb2+发生水解, Pb2++ H2O=Pb(OH)++H+②亚硫酸钠要在中性或碱性溶液中才能除氧,与实验条件不符,且2SO32—+O2=2SO42—Pb2++ SO42-= PbSO4↓③CO2+ H2O+ Pb2+=PbCO3 ↓+2 H+、三者都消耗Pb2+,影响测量结果。
15、11在0.1mol/LKCl溶液中,Co(NH3)63+在滴汞电极上进行下列得电极反应而产生极谱波.Co(NH3)63++e-=Co(NH3)62+ E1/2=—0、25VCo(NH3)63++2e—=Co++6NH3E1/2=—1。
20V(1)绘出它们得极谱曲线;(2)两个波中哪个波较高,为什么?解:(1)阴极电位阳极(2)15.12 在强酸行溶液中,锑(Ш)在滴汞电极上进行下列电极反应而产生极谱波。
Sb3++3e— +Hg =Sb(Hg) E1/2= -0.30V在强碱行溶液中,锑(Ш)在滴汞电极上进行下列电极反应而产生极谱波.Sb(OH)4-+2OH-=Sb(OH)6- +2e-E1/2=0。
40V(1)分别绘出它们得极谱图;(2)滴汞电极在这里就是正极还就是负极?就是阳极还就是阴极?(3)极化池在这里就是自发电池还就是电解电池?(4)酸度变化时,极谱波得半波电位有没有发生变化?如果有,则指明变化方向。
解: (1)电位阴极阳极-0.30.4(2) 在强酸性溶液中,就是负极在强碱中溶液中,就是正极(3) 在强酸与强碱中都发生极谱波,为电解电池(4) 在强酸溶液中,酸度变化对半波电位无影响E 1/2=E Θ +0。
059/nl gD a 1/2/D s 1/2在强碱中,酸度变化有影响(E 1/2)c = E Θ+0。
059/nlgD a 1/2/D S b(OH)6-1/2 —0、059/lgK c –b0。
059/nlg(OH —)(OH —)降低,(E1/2)c 后移,变大;(OH -)上升,左移,减小15-13 Fe(CN)63- 在0。
1m ol/L 硫酸介质中,在滴汞电极上进行下列电极反应而出现极谱波: Fe(C N)63-+e —=Fe(CN)64— E 1/2=0、24V氯化物在0.1mol/L 得硫酸介质中,在滴汞电极上进行下列电极反应而出现极谱波: 2Hg+2C l—=Hg2Cl 2+2e - E 1/2=0、25V (1) 分别绘出它们得极谱图;(2)滴汞电极在这里就是正极还就是负极?就是阳极还就是阴极?(3)极化池在这里就是自发电池还就是电解电池?解:(1)根据半波电位可画出大概得极谱图:(2) F e(C N)63-在0.1mol /L 硫酸介质中,在滴汞电极上发生了还原反应,所以这里滴汞电极就是负极,也就是阴极;氯化物在0、1mo l/L 得硫酸介质中,Hg 在滴汞电极上发生了氧化反应,所以这里滴汞电极就是正极,也就是阳极。
(3)因为极谱法本身就就是一种特殊得电解分析法,所以极化池就就是电解池。
15-14 在25度时,测得某可逆还原波在不同电位时得扩散电流值如下:极限扩散电流为3.24微伏,试计算电极反应中得电子转移数及半波电位。