溶解度曲线图解题规律
- 格式:ppt
- 大小:7.13 MB
- 文档页数:7

巧用溶解度曲线在九年级化学第九单元第 2 课题中溶解度曲线是反应溶解度与温度数学表示法,是溶解度曲线概念直观形象的表达方式。
利用溶解度曲线可以解决很多的问题技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游弋上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5个字,就低不就高)1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶)技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。
1、同一温度下,某物质的饱和溶液的质量分数比其不饱和溶液的质量分数要大。
(同温下饱和溶液的质量分数最大)。
×100%,溶解度S越大质量分数越大。
(质量分数最大的2、某温度下某饱和溶液的质量分数=S100g+S是该温度下的饱和溶液)特殊点的处理方法:溶解度曲线是一笨拙饱和线,线上方的点表示的溶液的质量分数与该温度下的饱和溶液的质量分数相等。
(等效法)×100%3、线上的点及线下的点表示的溶液的质量分数=S纵S纵+100g技巧引入:例:已知:40℃时氯化钾的溶解度为40g,其含义为。
(1)在40℃时,向100g水中加入20gKCl,搅拌至完全溶解,形成溶液A,此时,溶液A中KCl的质量分数为,溶液为(填“饱和”或“不饱和”)。
(2)在40℃时氯化钾的饱和溶液B的质量分数为。
(3)在40℃时,向100g水中加入50g氯化钾,充分搅拌形成溶液C。
此时溶液C中氯化钾的质量分数为。

溶解度曲线图解题技巧
溶解度曲线图解题技巧
溶解度曲线图是现今科学研究中一种常见的实验方法,其在大学化学课程中也用来让学生们学习物质的溶解性。
大学的化学考试也会经常考查溶解度曲线图的知识,那么接下来,就让我们来聊聊溶解度曲线图解题技巧吧。
一、理解溶解性的基本概念
首先,在尝试解溶解度曲线图题之前,我们需要先了解物质溶解性的基本概念。
溶解度是指一定量的溶质溶解在一定量的溶剂中可达到相容性的最大量,溶解度越高物质越容易溶解。
二、图形解读技巧
接下来,我们来聊聊溶解度曲线图解题技巧。
溶解度曲线图由曲线组成,曲线表示着物质溶解度随温度的变化曲线。
曲线向上凸起表示溶解度随温度的升高而升高,反之则降低。
解题时我们可以先根据曲线的特点来判断出相关的参数值,比如曲线的相对最大值等。
这样,我们就可以定位到某一个特定温度及其溶解度值,从而轻松解决图题了。
三、实验模拟
此外,在学习如何解溶解度曲线图题时,我们也可以尝试模拟一些常见的化学实验,观察过程中溶解度随温度的变化趋势,从而帮助我们更好地理解溶解度曲线图解题思路。
总的来讲,溶解度曲线图解题技巧比较简单,因为曲线本身就提供了一定的参考信息,只要我们运用正确的方法去解答,就能够快速熟悉曲线解题技巧,最终解决相关题目。

有关溶解度曲线的解题思路1、比较不同物质溶解度的大小,必须在同一温度下进行2、曲线上的交点,表示在某一温度下,两物质的溶解度相等3、M 、A 、N 三点相对于甲物质的曲线来讲,M 点表过饱和溶液,即溶液中还有未溶解的溶质;A 点表示饱和溶液;N 点表示不饱和溶液。
4、结晶方法的选择:①降温结晶(冷却热饱和溶液):溶解度受温度变化影响较大的物质(从甲物质的饱和溶液中得到甲)②蒸发结晶(蒸发溶剂):溶解度受温度变化影响不大的物质(从乙物质的饱和溶液中得到乙)③升温结晶:溶解度随温度的升高而减小的物质(从丙物质的饱和溶液中得到丙)5、物质提纯方法的选择想提纯什么物质,就看该物质适用于什么结晶方法。
① 甲溶液中含有少量的乙,提纯甲物质用降温结晶的方法② 固体甲中含有少量的固体乙,提纯固体甲的方法加水溶解、加热浓缩、降温结晶、过滤、洗涤(冷水)、干燥 ③ 乙溶液中含有少量的甲,提纯乙物质用蒸发结晶的方法④ 固体乙中含有少量的固体甲,提纯固体乙的方法●M ●A●N加水溶解、蒸发结晶、过滤、洗涤(热水)、干燥6、甲乙两种溶液降温不一定有晶体析出,必须是饱和溶液降温才有晶体析出。
7、要比较甲乙两种物质降温后析出晶体的多少,必须是等量的饱和溶液才能比较。
8、t3℃时,等量的甲乙丙三种物质的饱和溶液中,甲中所含水的量最少(或者说在t3℃时将等的甲乙丙三种物质配成饱和溶液,甲物质需要的水最少)因为在t3℃时甲物质的溶解度最大,溶液能力最强(或者说在等量的水中甲物质溶解的最多)9、升温或降温后比较三种溶液中溶质质量分数的大小依据公式:S/100g+S ×100% 溶解度大的,溶质质量分数就大①饱和溶液→饱和溶液根据末温下的溶解度计算溶质质量分数(溶解度发生变化,溶质的质量分数发生变化)②饱和溶液→不饱和溶液根据初温下的溶解度计算溶质质量分数(溶解度虽然发生变化,但溶液变为不饱和溶液,溶质的质量分数没有发生变化,所以按初温下的溶解度计算溶质的质量分数)例:现有t1℃的甲乙丙三种物质的饱和溶液,升温到t3℃,则溶液中溶质的质量分数由大到小的顺序是:分析:从t1℃升温到t3℃时,甲乙由饱和溶液变为不饱和溶液,则根据t1℃时甲乙物质的溶解度来计算溶质的质量分数,从图可以看出,t1℃时乙物质的溶解度大于甲物质,所以乙溶液中溶质的质量分数大于甲,从t1℃升温到t3℃时,丙物质的溶解度降低,还是饱和溶液,则根据t 3℃时的溶解度计算丙溶液中溶质的质量分数,丙物质的溶解度比t1℃时甲物质的溶解度小,所以三种溶液中溶质的质量分数由大到小的顺序是:乙﹥甲﹥丙10、大多数物质由饱和溶液转化为不饱和溶液的方法有:①加入溶质(温度不变,溶质的质量分数变大)②蒸发溶剂(温度不变,溶质的质量分数变大)③降低温度(温度变化,溶质的质量分数不变)11、常用计算公式:①饱和溶液中溶解度(S )= 溶剂质量溶质质量×100g(已知某温度下饱和溶液中溶质和溶剂的质量,可以求出该温度下的溶解度) ②饱和溶液中g S 100=溶剂质量溶质质量(已知某温度下,某物质的溶解度,可以判断一定量的溶质能否溶解在一定量的水中)③溶质的质量分数=溶液质量溶质质量×100%(已知其中两个量,可以求第三个量)④饱和溶液中溶质的质量分数=S g S +100×100%(已知某温度下,某物质的溶解度,便可以求出饱和溶液中溶质的质量分数)⑤ 饱和溶液中S g S +100=溶液质量溶质质量(已知某温度下,某物质的溶解度,可以求出一定量的饱和溶液中所含溶质的质量)⑥ 饱和溶液中溶质:溶剂:溶液=S:100g:(100g+S)。

溶解度曲线图解题技巧什么是溶解度曲线图溶解度曲线图是描述某种物质在不同温度下溶解度变化的图表。
通常,横轴表示温度,纵轴表示溶解度,通过绘制曲线来表示溶解度随温度的变化关系。
溶解度曲线图可帮助我们了解物质溶解度随温度变化的规律,并在化学实验和计算中起到重要作用。
溶解度曲线图解题技巧1.理解溶解度的定义和表示方法在使用溶解度曲线图解题之前,我们首先需要理解溶解度的定义。
溶解度是指单位溶剂中能够溶解的最大溶质的物质量。
通常,溶解度用质量百分比(如g/100g溶剂)或质量分数(如%w/w)表示。
2.分析曲线的走势首先,观察溶解度曲线的走势。
曲线可能是上升的、下降的或呈其他形状。
我们可以通过分析曲线的走势来得出某种物质在不同温度下溶解度的变化趋势。
–上升曲线:表示溶解度随温度增加而增加,通常用于描述固体在液体中的溶解过程。
–下降曲线:表示溶解度随温度增加而减少,通常用于描述气体在液体中的溶解过程。
3.确定反应条件在使用溶解度曲线图解题时,通常需要确定特定的反应条件,例如温度或溶剂的种类。
根据题目给出的条件,我们可以在溶解度曲线图上找到相应的数据点,以便计算或推导出所需的结果。
4.利用曲线计算溶解度一些题目可能需要我们根据溶解度曲线图计算某种物质在特定温度下的溶解度。
在这种情况下,我们可以通过读取曲线上的数据点,并进行线性插值或直接读取数值来计算溶解度。
5.判断饱和溶液条件根据溶解度曲线图,我们还可以判断饱和溶液的条件。
饱和溶液是指在一定温度下,溶质达到最大溶解度而不能再溶解的溶液。
通过观察曲线图上的数据点,我们可以确定饱和溶液的溶质和溶剂的比例,以及可能出现的沉淀和溶液的稳定性。
6.考虑其他因素在使用溶解度曲线图解题时,我们还应该考虑其他因素,如压力、固体颗粒大小和搅拌等。
这些因素可能会对溶解度产生影响,因此我们需要在解题过程中将其纳入考虑。
总结溶解度曲线图是化学中重要的工具,可以帮助我们了解溶解度随温度变化的规律。
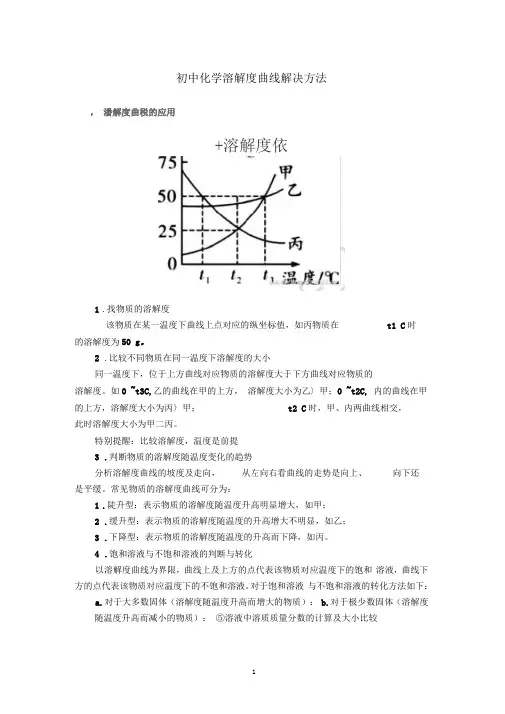
初中化学溶解度曲线解决方法,潘解度曲税的应用+溶解度依1.找物质的溶解度该物质在某一温度下曲线上点对应的纵坐标值,如丙物质在t1 C时的溶解度为50 g。
2.比较不同物质在同一温度下溶解度的大小同一温度下,位于上方曲线对应物质的溶解度大于下方曲线对应物质的溶解度。
如0 ~t3C,乙的曲线在甲的上方,溶解度大小为乙〉甲;0 ~t2C, 内的曲线在甲的上方,溶解度大小为丙〉甲;t2 C时,甲、内两曲线相交,此时溶解度大小为甲二丙。
特别提醒:比较溶解度,温度是前提3.判断物质的溶解度随温度变化的趋势分析溶解度曲线的坡度及走向,从左向右看曲线的走势是向上、向下还是平缓。
常见物质的溶解度曲线可分为:1.陡升型:表示物质的溶解度随温度升高明显增大,如甲;2.缓升型:表示物质的溶解度随温度的升高增大不明显,如乙;3.下降型:表示物质的溶解度随温度的升高而下降,如丙。
4.饱和溶液与不饱和溶液的判断与转化以溶解度曲线为界限,曲线上及上方的点代表该物质对应温度下的饱和溶液,曲线下方的点代表该物质对应温度下的不饱和溶液。
对于饱和溶液与不饱和溶液的转化方法如下:a.对于大多数固体(溶解度随温度升高而增大的物质):b.对于极少数固体(溶解度随温度升高而减小的物质):⑤溶液中溶质质量分数的计算及大小比较通过计算可比较溶质质量分数的大小。
对于饱和溶液的溶质质量分数 有:当0< t < t3时,甲、乙两种饱和溶液的溶质质量分数为乙 >甲;当t = t3时,甲、乙两种饱和溶液的溶质质量分数相等; t > t3 时,甲、乙两种 饱和溶液的溶质质量分数为甲 >⑥温度变化时溶液质量、溶剂质量、溶质质量及溶质质量分数的变化 1、根据有无晶体析出2、根据曲线走向(饱和溶液适用)物质溶解度增大口溶剂、溶质 质量、溶质质量分数均不变 物质溶解度减小3溶剂质量不 变,溶质、溶质质量分数减小物质溶解度减小e 溶剂质量不 变,溶质、溶质质量分数减小物质溶解度增大溶剂、溶质 质量、溶质质量分救均不变溶液中溶质质量分数=溶质质量 溶液质量xlOO%若溶液为饱和溶液,则:溶液的溶质质量分数=溶解度溶解度+ 100gxlOO%温度升高: L 温度下降:温度,升商:〔温度下降:⑦判断物质结晶或提纯的方法溶解度曲线升降情况结晶蝴纯方法陡升型(如甲)降温结晶(或冷却热饱和溶液)缓升型(如乙)恒温蒸发溶剂下降型(如丙)蒸发结晶(或i 口热)-升/ W/H-E-7下降型(如丙)蒸发结晶(或加热)才二4 i [ f丁/m e判断两种物质的溶解度变化趋势和两物质溶解度相等的温度范围。

恒温条件下解离度溶解度曲线图解题技巧利用溶解度曲线可以解决很多的问题
技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游式上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5个字,就低不就高)
1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温)混合物分离的方法(蒸发结晶或降温结晶) 技巧四:通过点的位置(高低) ,比较不同温度,不同状态下溶液的质量分数的大小。
1、同一温度下,某物质的饱和溶液的质量分数比其不饱和溶液的质量分数要大。
(同温下饱和溶液的质量分数最大)。
2、某温度下某饱和溶液的质量分数,溶解度 S越大质量分数越大。
(质量分数最大的是该温度下的饱和溶液)
特殊点的处理方法:溶解度曲线是一笨拙饱和线,线上方的点表示的溶液的质量分数与该温度下的饱和溶液的质量分数相等。
(等效
法)
3、线上的点及线下的点表示的溶液的质量分数。

化学知识点之溶解度曲线变化的规律归纳与总结化学知识点之溶解度曲线变化的规律归纳与总结化学会考知识点之溶解度曲线变化的规律对于化学中溶解度曲线变化的规律知识,我们做下面的内容讲解学习,希望可以很好的帮助同学们对此知识的巩固学习。
溶解度曲线变化的规律大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线“坡度”比较“陡”,如硝酸钾;少数固体物质的溶解度受温度的影响较小,表现在曲线的“坡度”比较“平缓”,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线的“坡度”下降,如熟石灰。
通过上面对溶解度曲线变化的规律知识的巩固学习,相信同学们已经能很好的掌握了吧,后面我们进行更多的化学知识讲解学习。
化学会考知识点之溶解度概念对于化学的学习中,关于溶解度概念知识,我们做下面的理解学习哦。
溶解度概念:在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。
通过上面对化学中溶解度概念知识的讲解学习,希望上面的内容给同学们的学习很好的帮助,相信同学们会从中收获很多的吧。
初中化学结晶的方法知识点讲解同学们对化学中结晶的方法知识还记得吧,下面我们一起来学习哦。
结晶的方法(1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。
适用范围:溶解度受温度变化影响不大的物质,如氯化钠。
(2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出。
适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
上面对化学中结晶的方法知识的讲解学习,希望同学们都能很好的掌握上面的知识,相信同学们会从中学习的很好的哦。
初中化学固体物质的溶解度知识点讲解下面是对化学中固体物质的溶解度知识的内容讲解,同学们可以很好的参考下面的讲解知识学习哦。
固体物质的溶解度固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数。
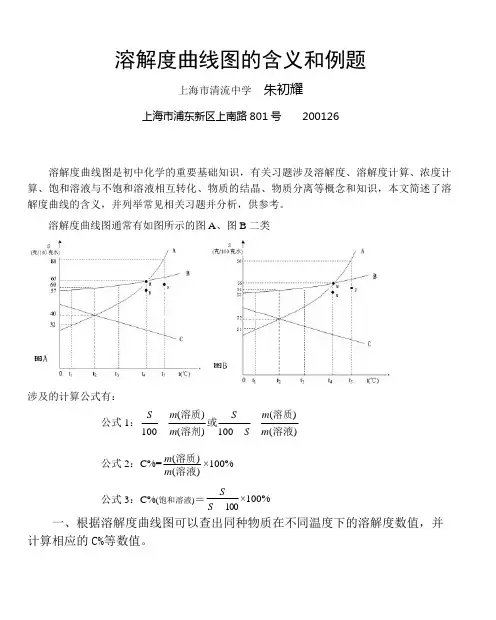
溶解度曲线图的含义和例题上海市清流中学朱初耀上海市浦东新区上南路 801 号 200126溶解度曲线图是初中化学的重要基础知识,有关习题涉及溶解度、溶解度计算、浓度计 算、饱和溶液与不饱和溶液相互转化、物质的结晶、物质分离等概念和知识,本文简述了溶 解度曲线的含义,并列举常见相关习题并分析,供参考。
溶解度曲线图通常有如图所示的图 A 、图 B 二类涉及的计算公式有:公式 1:S m (溶质) S m (溶质)或 100 m (溶剂) 100 S m (溶液)公式 2:C%=m (溶质) m (溶液)×100%公式3:C%(饱和溶液)=SS 100×100% 一、根据溶解度曲线图可以查出同种物质在不同温度下的溶解度数值,并 计算相应的 C%等数值。
例1:由曲线溶解度图A回答下列问题:①t2 时,B 物质的饱和溶液中溶质和溶剂的质量比为∶②t1时,将30克A物质投入60克水中,求所得溶液中溶质的质量分数为③t4时, 90克B物质溶解在150克水中,所得溶液为不饱和溶液,为了得到B物质的饱和溶液,问:a. 维持温度不变,至少要蒸发掉克水,才能使溶液饱和。
b. 维持温度不变,原溶液中至少再加入B物质克,才能使溶液饱和。
c.不改变溶液组成,只要把温度降低到℃,也能使溶液恰好达到饱和。
④要配制C%为28.6%的C物质溶液,配制时的温度应控制在℃。
解:①由图A知t2 时,S B=60 克∕100 克水,根据溶解度定义:在一定温度下,某物质在100 克溶剂里达到饱和时所溶解的克数,即当溶剂的质量为100 克时,溶质的质量为60 克,则溶质和溶剂的质量比为60∶100 或 3:5。
②由图A知t1时,S A=32克∕100克水,根据公式1计算可知,在60克水中最多溶解19.2克A物质,即30克A物质不能全部溶解,则根据公式2计算C%=19.219.260×100%=24.2%③a:已知t4时,S B=65克∕100克水,设90克B物质完全溶解并形成饱和溶液只需要溶剂水为x 克,根据公式1,65 90100 xx=138 克,由于原溶剂为150克,则150-138=12克,即蒸发12克水能使溶液达到饱和。

溶解度曲线题技巧引言溶解度曲线题是化学考试中常见的题型之一,要求学生根据给定的溶解度曲线图和相关的实验条件,回答与溶解度相关的问题。
掌握一些解题技巧可以帮助我们更快、更准确地解决这类题目。
本文将介绍几种常见的溶解度曲线题解题技巧。
技巧一:理解溶解度曲线图的基本概念在解决溶解度曲线题之前,首先要理解溶解度曲线图的基本概念。
溶解度曲线图是描述溶质在溶剂中的溶解度与温度、浓度或其他实验条件之间关系的图形表示。
通常,曲线上的每一个点代表了特定温度或浓度下的溶解度。
技巧二:注意浓度和溶解度的区别在解答溶解度曲线题时,不要混淆浓度和溶解度的概念。
浓度是指单位体积溶液中溶质的质量或摩尔数,通常用g/L 或mol/L 表示。
溶解度是指在一定温度下,饱和溶液中所能溶解的最大溶质质量或摩尔数,通常用 g/100 g 溶剂或 mol/L 表示。
技巧三:寻找溶解度与温度的关系通常,在溶解度曲线题中,需要我们根据给定的曲线图判断溶解度与温度的关系。
一般来说,随着温度升高,大多数物质的溶解度会增大,因为在高温下溶质分子活动增强,溶解过程更容易进行。
但也有个别物质的溶解度随温度的升高而降低,如 NaCl 的溶解度曲线。
技巧四:利用实验条件解题在解答溶解度曲线题时,经常会给出一些实验条件,如溶质的初始质量、溶解过程中是否加热或冷却等。
利用这些实验条件可以帮助我们更加准确地回答问题。
例如,当题目给出了溶质的初始质量和最终溶液的体积时,我们可以通过计算溶质的浓度来解题。
技巧五:注意溶解度曲线图上的标记点溶解度曲线图上通常标有一些特定点,如溶解度最大点(饱和点)、溶解度达到50%的点(半饱和点)等。
注意这些标记点的位置和含义,可以帮助我们更好地理解溶解度曲线图,答题更加准确。
技巧六:综合考虑多个因素解题在一些复杂的溶解度曲线题中,可能需要我们综合考虑多个因素来确定答案。
例如,根据溶解度曲线图和溶解过程中的实验条件,结合物质的溶解特性和溶解度的变化规律,我们可以分析出溶质在不同温度下的溶解程度,进而回答问题。


溶解度曲线解题窍门一、溶解度曲线解题窍门哎呀,宝子们!溶解度曲线的题其实没那么难搞啦。
1. 看曲线走势曲线上升,就说明溶解度随温度升高而增大。
像硝酸钾这种典型的,温度越高,能溶得就越多。
这就好比你吃小零食,给你的小盒子越大(温度越高),你能装的零食(溶质)就越多。
曲线下降呢,那就是溶解度随温度升高而减小,氢氧化钙就是这样的调皮鬼。
2. 交点的秘密溶解度曲线的交点可是个大宝藏哦。
这个点表示在该温度下,两种物质的溶解度相等。
就好像两个人在这个温度下,能吃一样多的小零食呢。
比如在某个温度下,A物质和B物质在水里能溶解的量一样多。
3. 温度变化时溶质质量分数的变化当温度升高,对于溶解度随温度升高而增大的物质,如果原来是饱和溶液,没有溶质析出,溶质质量分数不变。
要是有溶质析出,那溶质质量分数就变小啦。
这就像你本来有一盒子满满的小零食,温度一变,有些小零食掉出去了,那你盒子里小零食占的比例就小了。
对于溶解度随温度升高而减小的物质,温度升高时,饱和溶液中有溶质析出,溶质质量分数也变小。
4. 比较溶解度大小比较溶解度大小的时候,一定要看温度哦。
不同温度下,物质的溶解度是不一样的。
就像你不能拿夏天和冬天你能吃的冰淇淋数量直接比一样,得在相同的温度条件下比较物质能溶解多少。
5. 饱和与不饱和溶液的转化对于溶解度随温度升高而增大的物质,饱和变不饱和可以升高温度或者增加溶剂。
不饱和变饱和可以降低温度、增加溶质或者减少溶剂。
这就像你调整你的小零食盒子的状态一样,想让盒子里的小零食不饱和(有空间再装),你可以把盒子变大(升高温度相当于增大溶剂容纳溶质的能力)或者直接再加点小零食(增加溶质)。
对于溶解度随温度升高而减小的物质,饱和变不饱和可以降低温度或者增加溶剂,不饱和变饱和可以升高温度、增加溶质或者减少溶剂。
高中化学题型之溶解度曲线的计算溶解度曲线是化学中常见的一种重要图像,它描述了在一定温度下溶质在溶剂中的溶解度随溶质的浓度变化的关系。
在化学学习中,我们经常需要计算溶解度曲线上的各个点的数值,以便更好地理解和应用溶解度曲线。
本文将以具体题目为例,说明溶解度曲线的计算方法和相关考点。
首先,让我们来看一个典型的题目:题目:某溶质在水中的溶解度随温度的变化如下表所示:温度(℃)溶解度(g/100 mL)20 1030 2040 3050 4060 50请根据上述数据绘制溶解度曲线,并回答以下问题:1. 温度为35℃时,溶解度为多少?2. 溶解度为25g/100 mL时,温度为多少?解析:首先,我们需要将给定的数据绘制成溶解度曲线图。
横轴表示温度(℃),纵轴表示溶解度(g/100 mL)。
根据表中的数据,我们可以得到以下溶解度曲线图:(插入溶解度曲线图)接下来,我们来解答第一个问题:温度为35℃时,溶解度为多少?根据溶解度曲线图,我们可以看到35℃对应的溶解度应该在20和30之间。
为了更精确地计算出溶解度,我们可以使用线性插值法。
线性插值法的基本原理是根据已知数据点的坐标,通过直线的斜率来估算未知点的坐标。
首先,我们找到温度为30℃和40℃时的溶解度,分别为20g/100 mL和30g/100 mL。
然后,我们可以根据这两个点的坐标计算出直线的斜率:斜率 = (30 - 20) / (40 - 30) = 1接下来,我们计算35℃对应的溶解度。
根据线性插值法的公式:溶解度 = 20 + (35 - 30) * 1 = 25g/100 mL因此,温度为35℃时,溶解度为25g/100 mL。
接下来,我们来解答第二个问题:溶解度为25g/100 mL时,温度为多少?根据溶解度曲线图,我们可以看到溶解度为25g/100 mL对应的温度应该在30℃和40℃之间。
同样地,我们可以使用线性插值法来计算温度。
首先,我们找到溶解度为20g/100 mL和30g/100 mL时的温度,分别为30℃和40℃。
巧用溶解度曲线在九年级化学第九单元第2 课题中溶解度曲线是反应溶解度与温度数学表示法,是溶解度曲线概念直观形象的表达方式。
利用溶解度曲线可以解决很多的问题技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游弋上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5 个字,就低不就高)1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶)技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。
1、同一温度下,某物质的饱和溶液的质量分数比其不饱和溶液的质量分数要大。
(同温下饱和溶液的质量分数最大)。
S2、某温度下某饱和溶液的质量分数=100g + S× 100%,溶解度S 越大质量分数越大。
(质量分数最大的是该温度下的饱和溶液)特殊点的处理方法:溶解度曲线是一笨拙饱和线,线上方的点表示的溶液的质量分数与该温度下的饱和溶液的质量分数相等。
(等效法)S纵3、线上的点及线下的点表示的溶液的质量分数=S纵+ 100g × 100%技巧引入:例:已知:40℃时氯化钾的溶解度为40g,其含义为。
(1)在40℃时,向100g 水中加入20gKCl,搅拌至完全溶解,形成溶液A,此时,溶液A 中KCl 的质量分数为,溶液为(填“饱和”或“不饱和”)。
(2)在40℃时氯化钾的饱和溶液B 的质量分数为。
(3)在40℃时,向100g 水中加入50g 氯化钾,充分搅拌形成溶液C。
溶解度曲线图试题题型总结standalone; self-contained; independent; self-governed;autocephalous; indie; absolute; unattached; substantive正确的说法:1、t2℃时,甲、乙两饱和溶液溶质质量分数相等,2、甲、乙饱和溶液变为不饱和溶液,可升温。
而丙的饱和溶液变为不饱和溶液,可降温。
3、t2℃时,甲、乙两种物质各50g分别加入到100g水中,充分溶解得到溶液质量都是140g。
4、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达到饱和状态需要加入甲的质量大于乙。
5、当甲中混有少量乙时可用降温结晶的方法提纯。
6、若要将N点的甲溶液转变为M点的甲溶液,可在恒温条件下采用蒸发溶剂法。
7、分别将t3℃时,甲、乙、丙的饱和溶液降温至t1℃,则所得三种溶液中溶质质量分数大小关系:乙>甲>丙。
不正确的说法:1、t3℃时,甲、乙两饱和溶液的溶质质量相等。
2、将乙的溶液由t3℃降低到t2℃,乙溶液中一定有固体析出。
3、t3℃时,将甲、乙的饱和溶液降温到t2℃时,析出晶体的质量一定大于乙。
4、将甲、乙、丙的饱和溶液从t3℃降温到t2℃溶液中均有固体析出。
5、t3℃时,甲、乙、丙三种物质的饱和溶液中溶质质量由大到小的顺序是:甲>乙>丙。
6、t3℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数。
7、t3℃时,将47g甲完全溶于100g水中,得到甲的饱和溶液。
8、t2℃时,甲、乙饱和溶液的溶质质量分数都为40%。
9、t2℃时,甲、乙的饱和溶液分别降温至t0℃,甲溶液饱和,乙溶液不饱和。
10、t3℃时,甲、乙、丙三种物质的饱和溶液,分别蒸发相等质量的水后恢复到t3℃,析出溶质质量:丙>乙>甲。
11、将t2℃时,甲、乙、丙三种物质的饱和溶液降温至t1℃时,所得溶液溶质质量分数关系是:乙>甲=丙。
初中化学溶解度曲线图的解读与分析方法溶解度是指在一定温度下溶质在溶剂中溶解成溶液的最大量。
溶解度曲线图是描述溶解度随温度变化的图表。
通过解读和分析溶解度曲线图,我们可以了解不同物质溶解度的规律性,并对溶解过程进行深入理解。
解读溶解度曲线图的第一步是观察曲线的趋势。
溶解度曲线通常呈现出不同的形态,如正常溶解度曲线、倒U型曲线、S型曲线等。
根据曲线的形态,我们可以初步判断物质的溶解过程特点。
例如,正常溶解度曲线代表溶解度随温度的升高而增加,这表明溶解过程是吸热的;倒U型曲线则表示溶解度随温度的升高先增加后减少,这表明在一定温度范围内溶解度最大,超过该温度后溶解度降低;S型曲线则表示溶解度随温度的升高先减少后增加,这可能是由于溶质在低温下产生了某种结晶,而在高温下重新溶解所导致。
在进一步分析时,我们需要关注曲线上的特殊点或特征。
首先,峰值点通常表示溶解度达到最大值的温度。
通过观察峰值点的位置,我们可以比较不同物质的溶解度大小。
其次,曲线上的水平线段表示溶解度在该温度范围内保持不变。
这些水平线段可能与某种相变过程相关,如晶体水合物的结晶水的脱失。
最后,曲线上的斜率表示溶解度随温度变化的速率。
斜率的变化率可以反映溶解过程的速度,例如,斜率越大,表示溶解过程越快。
为进一步深入分析溶解度曲线图,我们可以考虑以下几个方面:1. 温度变化对溶解度的影响:通过比较不同物质的溶解度曲线,我们可以观察不同物质在不同温度下的溶解度变化规律。
这有助于我们理解物质的溶解特性以及温度对溶解过程的影响。
2. 物质的溶解热:根据溶解度曲线的形态,我们可以初步判断溶解过程是吸热还是放热的。
进一步分析可以计算出物质的溶解热,并比较不同物质的溶解热大小。
3. 溶液中溶质的浓度变化:通过分析溶解度曲线,我们可以了解溶质浓度随温度变化的趋势。
这可以帮助我们理解溶解过程中溶质在溶液中的分布规律。
4. 物质的晶体结构:溶解度曲线的特殊点和特征可以与物质的晶体结构相关联。
巧用溶解度曲线在九年级 化学第九单元第2 课题中溶解度曲线是反应溶解度与温度数学表示法,是溶解度曲线概念直观形象的表达方式。
利用溶解度曲线可以解决很多的问题技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游弋上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5个字,就低不就高)1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶)技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。
1、同一温度下,某物质的饱和溶液的质量分数比其不饱和溶液的质量分数要大。
(同温下饱和溶液的质量分数最大)。
2、某温度下某饱和溶液的质量分数=,溶解度S 越大质量分数越大。
(质量分数最大的S100g +S ×100%是该温度下的饱和溶液)特殊点的处理方法:溶解度曲线是一笨拙饱和线,线上方的点表示的溶液的质量分数与该温度下的饱和溶液的质量分数相等。
(等效法)3、线上的点及线下的点表示的溶液的质量分数=S 纵S 纵+100g ×100%技巧引入:例:已知:40℃时氯化钾的溶解度为40g ,其含义为 。
(1)在40℃时,向100g 水中加入20gKCl ,搅拌至完全溶解,形成溶液A ,此时,溶液A 中KCl 的质量分数为 ,溶液为 (填“饱和”或“不饱和”)。
(2)在40℃时氯化钾的饱和溶液B 的质量分数为 。
(3)在40℃时,向100g 水中加入 50g 氯化钾,充分搅拌形成溶液C 。