溶解度曲线-专题复习
- 格式:ppt
- 大小:536.50 KB
- 文档页数:2





专题06 溶解度曲线一、判断某物质在某温度下的溶解度或比较某温度下各物质溶解度的大小;二、计算某溶质的质量分数或比较不同物质的溶质质量分数大小;三、温度变化时,溶解度或溶质质量分数的变化和比较;四、比较等质量的不同溶质配成饱和溶液所需溶剂质量(或等质量的溶剂配成饱和溶液所需不同溶质质量)大小;五、饱和溶液与不饱和溶液的转化方法;六、物质的净化方法等本考点主要以文字叙述结合两条线或三条线的坐标曲线图在选择题或填空题中考查。
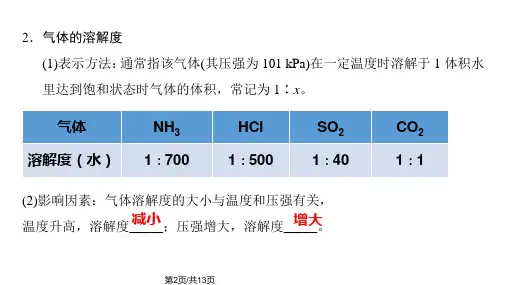
归纳1 溶解度1.固体物质的溶解度(1)固体的溶解度表示在下,某固态物质在溶剂里达到时所溶解的。
四要素:a.一定温度下;b.100 g溶剂里;c.达到饱和;d.溶解的质量。
(2)影响固体溶解度的因素内因:a.的性质,b.的性质;外因:c.温度。
2.气体溶解度(1)气体溶解度,表示该气体的压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。
(2)影响气体溶解度的因素内因:a.的性质;b.的性质;外因:c.压强;d.温度。
(3)气体溶解度与温度、压强的关系①压强越大,溶解度;②温度越高,溶解度。
(4)会用气体溶解度的影响因素解释简单实际问题:①喝汽水易打嗝是因为:。
②打开汽水瓶盖会冒出大量气泡是因为:。
④水沸腾前就会出现气泡是因为:。
归纳2 溶解度曲线1.溶解度曲线应用:(注:A、B、C代表物质依次为——硝酸钾、氯化钠、熟石灰或气体)⑴会比较S大小:0℃时溶解度大小顺序为,t2℃时三种物质溶解度大小顺序为。
⑵会查S并进行简单推算、判断:①t2℃50g水中最多能溶解A物质。
②t2℃一瓶饱和A溶液的浓度为。
③t2℃把25gA物质放入100g 水中,所得溶液质量为,浓度为,所得溶液是否饱和:;降温至t1℃,所得溶液质量为,此时溶液是否饱和:。
⑶会判断饱和溶液浓度随温度变化情况:①t2℃三物质的饱和溶液降温至t1℃,A溶液浓度将,B溶液浓度将,C溶液浓度将。
②t1℃三物质的饱和溶液升温至t2℃,A溶液浓度将,B溶液浓度将,C溶液浓度将。

专项五 溶解度曲线【考情分析】中考题型有选择题、填空题。
中考重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对固体溶解度曲线及其使用等相关知识的理解和掌握情况,以及运用它们来解决实际问题的能力等。
溶解度曲线的中考试题中考化学的重点,因此有必要对此进行专题复习和练习巩固。
溶解度曲线是用来表示溶解度的图像,是借助于图像把溶解度知识加以展示,因而属于把化学概念的理解与图像的信息处理结合在一起,具有灵活多变的命题角度和命题方式,该考点的命题方向主要是通过设置相关的实验、问题情景或图表信息等,来考查学生对固体溶解度曲线及其使用的理解和掌握情况,以及对固体溶解度的溶概念和意义、固体溶解度的影响因素等相关问题的分析、推断、表达的能力和对知识的迁移能力等。
经常将其与“饱和溶液和不饱和溶液的概念、特点及其相互转变方法”、“固体溶解度的概念和意义”、“溶质质量分数及其有关计算”、“物质的溶解和结晶方法”等关联起来考查,涉及的知识点多,所以固体溶解度曲线及其应用是重要的中考考点。
一、认识溶解度曲线1.曲线上的点、交点、曲线下方的点的意义:P :t 3℃时,A 物质的溶解度为ag ;O :t 1℃时,A.C 两种物质的溶解度相等,都为bg (均为同一个值);t 1℃时,A.C 两种物质的饱和溶液中溶质的质量分数相等;(ω=%100100⨯+b b ) ω表示溶质的质量分数 Q : t 3℃时A.B 两种物质的不饱和溶液;要使其变成饱和溶液可采用的方法:对于A 物质而言:①恒温蒸发溶剂至刚有晶体析出;②加入A 物质至不再溶解可变成t 3℃时的饱和溶液;③降低温度至t 2℃时可变成t 2℃时的饱和溶液;对于B 物质而言: ①恒温蒸发溶剂至刚有晶体析出;②加入B 物质至不再溶解可变成t 3℃时的饱和溶液。
2.其中两个重要的等量关系式:一定温度时,某物质的饱和溶液中:(该温度条件下,该物质的溶解度为S )①m(溶质):m(溶剂) :m(溶液)=S :100g:(100g+S)②ω(溶质)=)m )m 溶液溶质((×100%=S g S +100×100%=a%﹤S% S=aa -100×100g 3.根据溶解度曲线确定从饱和溶液中析出晶体或进行混合物分离提纯的方法:(1)从A 的饱和溶液中析出A 晶体:降温结晶;(2)从B 的饱和溶液中析出B 晶体;蒸发溶剂结晶;(3)从C 的饱和溶液中析出C 晶体:升温结晶。

微专题5 溶解度曲线及溶解度表分析考向一溶解度曲线分析1、解答此类题目的关键(1)明确溶解度曲线上点的含义(某点是在某温度时某物质的溶解度是多少g。
交点是在某温度时,两物质的溶解度相等。
线上方的点表示是饱和溶液,下方的点表示不饱和溶液);(2)明确物质的溶解度随温度变化的趋势(线越陡,表示该物质溶解度受温度影响较大);(3)明确饱和溶液中溶质的质量大小的判断方法;(4)明确判断溶质的质量分数大小关系的方法。
2、溶解度曲线:线的含义:三线:①“陡升型” :大多数固体物的溶解度随温度升高而升高。
如KNO3;②“缓升型”:少数固体物质的溶解度受温度的影响很小。
如NaCl;③“下降型”:极少数物质溶解度随温度升高而降低。
如Ca(OH)2。
3、点的含义:四点:①曲线上的点:所示某温度下某物质的溶解度是多少(该温度下饱和状态)。
②两曲线的交点:表示在该点所示的温度下,两种物质的溶解度相等。
③线上方的点表示:在该温度下,该溶液是饱和且有部分晶体;③线下方的点表示:该温度下,该溶液是不饱和溶液。
1. 【2023四川内江真题】甲、乙两种物质的溶解度曲线如图所示,下列有关说法错误的是()A. 两种物质的溶解度都随温度升高而增大B. t1°C时,甲、乙两物质的溶液中溶质质量分数一定相等C. 通常采用蒸发结晶的方法从乙的溶液中获得晶体D. t2°C时,在100g水中加入25g甲,可形成甲的不饱和溶液【答案】B【解析】A. 由溶解度曲线可知,两种物质的溶解度都随温度升高而增大,此选项正确;B. t1°C时,甲、乙两物质的溶解度相等,则t1°C时,甲、乙两物质的饱和溶液中溶质质量分数一定相等,此选项错误;C. 乙的溶解度受温度影响不大,对于溶解度受温度影响不大的物质,一般采用蒸发结晶法从溶液中获取晶体,此选项正确;D. 由溶解度曲线可知,t2°C时,甲的溶解度大于25g,则在100g水中加入25g甲,可形成甲的不饱和溶液,此选项正确。
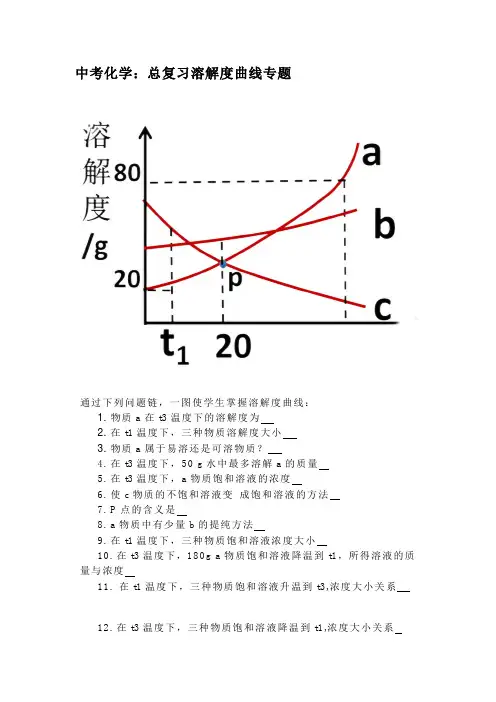
中考化学:总复习溶解度曲线专题通过下列问题链,一图使学生掌握溶解度曲线:1. 物质a在t3温度下的溶解度为2. 在t1温度下,三种物质溶解度大小3. 物质a属于易溶还是可溶物质?4. 在t3温度下,50 g水中最多溶解a的质量5. 在t3温度下,a物质饱和溶液的浓度6. 使c物质的不饱和溶液变成饱和溶液的方法7. P点的含义是8. a物质中有少量b的提纯方法9. 在t1温度下,三种物质饱和溶液浓度大小10. 在t3温度下,180g a物质饱和溶液降温到t1,所得溶液的质量与浓度11. 在t1温度下,三种物质饱和溶液升温到t3,浓度大小关系12. 在t3温度下,三种物质饱和溶液降温到t1,浓度大小关系13. 在t3温度下,把50ga物质放入50g水中,充分溶解,得到溶液的质量是多少?14. 在t3温度下,等质量的a、b、c三种物质,加适量水溶解,刚好形成饱和溶液,得到溶液的质量大小关系?15. 把t3温度下,等质量的a的饱和溶液与b的饱和溶液,降温到20度,所得溶液质量大小关系?答案:1.80g2.c>b>a3.易溶4.40g5.44.4%6.加溶质,蒸发溶剂,升高温度7.在t2温度下,a和c的溶解度相同8.降温结晶(冷却结晶)9. c>b>a 10.120g 16.7%11. b>a>c 12. b>a>c13. 90g 14. c>b>a 15. b>a溶解度曲线应知应会:1.溶解度曲线由于固体物质的溶解度随温度变化而变化,随温度一定而一定,这种变化可以用溶解度曲线来表示.我们用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
2.溶解度曲线的意义:①表示同一种物质在不同温度时的溶解度;②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小.若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;④根据溶解度曲线能进行有关的计算。

溶解度曲线专题复习》 本专题需要明确的两个问题:1、溶解度曲线的横纵坐标分别代表什么?2、固体的溶解度随温度变化的规律是怎样的?、判断不同物质溶解度随温度变化情况:二、比较不同物质溶解度大小:五、判断溶液的溶质质量分数变化情况:1、在ti e 时,分别用100g 水配制A 、B 、C 三种物质的饱和溶液,所得溶液的溶质质量分数的大小关系为 __________________ ;当温度升至t2 C 时,所得溶液的溶质质量分数的大小关系为1、 的溶解度随温度的升高而迅速增大;2、的溶解度受温度的影响很小(略升);3、的溶解度随温度的升高而降低。
1、 时,A 、B 两物质的溶解度相等;2、时, A 的溶解度大于 B 的溶解度;3、时,A 、B 、C 的溶解度大小关系 为A > B > C ;4、引申:① B >A >C ②B >C >A ③C >B >A ④ B >A , B >C三、解决饱和溶液与不饱和溶液转化的问题:1、分别通过加入溶质、蒸发溶剂、降低温度使不饱和溶液变为饱和溶液的是物质;2、分别通过加入溶剂、升高温度使饱和溶液变为不饱和溶液的是 物质;3、对于A 物质来说,配制t2 C 时的饱和溶液,若升温至t3 e ,它是__不饱和”),若降温至t1 C ,它是 _____________ 溶液(同上)溶液(填 “饱和 ”、四、确定物质结晶的方法:1、从A 物质的饱和溶液中析出 A,—般采用的方法是 ____________________________中析出B ,一般采用的方法是 _______________ ;从C 物质的饱和溶液中析出;从 B 物质的饱和溶液C , 一般采用的方法是2、当A 中含有少量B 时,可通过_ 通过—的方法提纯A ;当 的方法提纯 B ;B 中含有少量 A 时,可2、在t2 C 时,分别用100g 水配制A 、B 、C 三种物质的饱和溶液,所得溶液的溶质质量分数 的大小关系为 __________________ ;当温度降至ti e 时,所得溶液的溶质质量分数的大小关系为六、解决简单的配制溶液问题:在t1 C 时,能不能配制出溶质质量分数为 10 %的A 溶液?要配制溶质质量分数为9.1 %的A 溶液,那么配制时的温度为多少?溶解度曲线综合题例析,综合性强,常涉及饱和溶液与不饱和溶液、溶解 度、溶质质量分数等知识,是中考化学的重点,也是学生的失分点。

溶解度曲线专题一、溶解度曲线基本知识(1)概念:表示物质的溶解度随______________________________________________(2)意义:曲线上的点表示物质在该点所示温度的________两曲线的交点表示两物质在该点所示温度下_________ 表示同一物质在不同________下的________或表示________随________变化的情况________________________________例:(1)t 3℃时,A 的溶解度为_________,此时溶质的质量分数为_________(2)P 点的含义:________________________________(3)t 1℃时,A 、B 、C 溶解度由大到小的顺序________________________________(4)N 点为t 3℃时,A 的 ______________溶液(5)从 A 、B 的溶液中获取B 晶体的方法_________________________从 A 、B 的混合溶液中获取A 晶体的方法_________________________(6)t 3℃时,等质量的A 、B 、C 饱和溶液各W 克,从t 3℃降温到t 1℃,会析出晶体的有_________ 晶体质量的大小为_________,无晶体析出的有_________(7)t 3℃时,A 、B 、C 的饱和溶液降温到t 1℃,则溶质的质量分数大小为_________(8)t 1℃时,A 、B 、C 的饱和溶液升温到t 3℃,则溶质的质量分数大小为_________(9)t 3℃时,将A 、B 饱和溶液恒温蒸发等质量的溶剂,析出晶体的质量大小为_________(10)t 3℃时,60gA 放入100g 水中形成_________g 饱和溶液,其溶质质量分数为________二、常见命题方式归纳根据右图所示的溶解度曲线,判断下列说法是否正确,并说明理由。