2020高考化学 冲刺核心素养微专题6 四大平衡常数(Ka、Kh、Kw、Ksp)的综合应用练习(含解析)
- 格式:doc
- 大小:2.32 MB
- 文档页数:6



6大平衡常数
6大平衡常数指的是在化学反应中常用的六个平衡常数,分别是酸解离常数(Ka)、碱解离常数(Kb)、水的离子积常数(Kw)、配位
化学中的形成常数(Kf)、反应物与产物浓度的比值(Kc)和气相反
应中压强的比值(Kp)。
1. 酸解离常数(Ka):指的是酸在水中分解时产生带正电荷的离
子和水解产物的比值。
Ka越大,说明酸的离解越强,pKa值越小。
2. 碱解离常数(Kb):指的是碱在水中分解时产生带负电荷的离
子和水解产物的比值。
Kb越大,说明碱的离解越强,pKb值越小。
3. 水的离子积常数(Kw):指的是水分解为氢离子和氢氧离子的
反应常数。
Kw表征了水的弱酸性和弱碱性,其值随温度的变化而变化。
4. 配位化学中的形成常数(Kf):指的是配位反应中配体与中心
离子形成配合物的反应常数。
Kf越大,说明配位反应越容易发生,配
合物越稳定。
5. 反应物与产物浓度的比值(Kc):指的是反应物和产物的浓度
比值,可以表征一个化学反应的平衡状况。
6. 气相反应中压强的比值(Kp):指的是气相反应中各组分的分
压比值,可以表征一个气相反应的平衡状况。
Kp与Kc之间存在一定的关系,因为气体分子的压强和浓度有一定的比例关系。

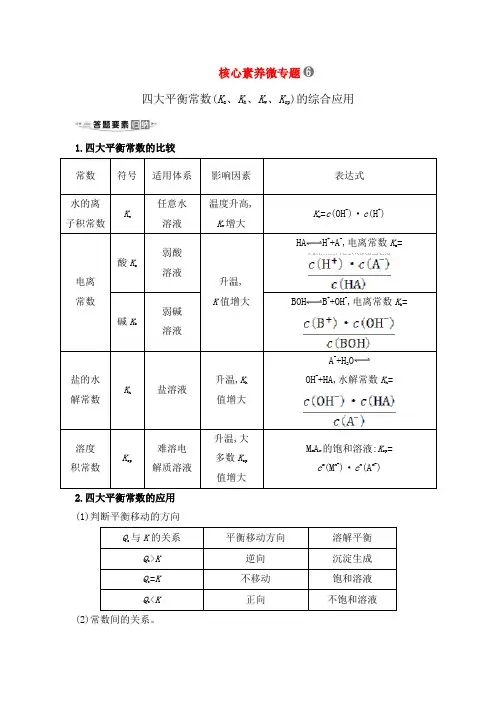
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数Kw任意水溶液温度升高,Kw增大Kw=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a= 碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数Kh盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数Ksp难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Qc与K的关系平衡移动方向溶解平衡Qc>K逆向沉淀生成Qc=K不移动饱和溶液Qc<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以。
温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K w任意水溶液温度升高,K w增大K w=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a=碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数K h盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数K sp难溶电解质溶液升温,大多数K spM m A n的饱和溶液:K sp=c m(M n+)·值增大c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Q c与K的关系平衡移动方向溶解平衡Q c>K逆向沉淀生成Q c=K不移动饱和溶液Q c<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。




1. 了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。
考纲 2. 了解水的电离、离子积常数。
了解溶液 pH 的含义及其测定方法,能进行 pH 的简 要求 单计算。
理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。
3. 了解难溶电解质的沉淀溶解平衡。
理解溶度积(Ksp)的含义,能进行相关的计算。
四大平衡常数的重要应用四大平衡常数是指化学平衡常数、弱电解质的电离平衡常数、 水的离子积常数及难溶电解质的溶度积常数,这部分知识为新课标的热考内容,在高 专家 考题中出现频繁。
特别是化学平衡常数及溶度积常数的应用更是考试的热点内容。
该 解读 类试题常与生产、生活、环境及新技术的应用相联系,信息量大,思维容量高。
侧重 考查考生阅读相关材料,把握和提炼关键信息或数形结合等综合分析能力,数据处理 及计算能力、知识的迁移应用能力。
平衡常数将以新的化工生产为载体,直接考查其相关计算。
对于电离常 数和水的离子积,会与酸的酸性强弱比较、水的电离平衡相结合、离子浓度大小比 较相结合。
而溶度积常数则依然会与化工生产相结合,根据溶度积的大小判断溶液 中沉淀的转化问题,另外溶度积曲线也可能会出现。
一、四大平衡常数的比较化学平衡常数(K)电离常数(Ka、Kb)概 在一定温度下,当一 在一定条件下达到电水的离子积常 数(Kw)难溶电解质的 溶度积常数 (Ksp)一定温度下,水 在一定温度下,念 个可逆反应达到化 离平衡时,弱电解质 或稀的水溶液 在难溶电解质学平衡时,生成物浓 电离形成的各种离子 中 c(OH−)与 的饱和溶液中,度幂之积与反应物 的浓度的乘积与溶液 c(H+)的乘积 各离子浓度幂浓度幂之积的比值 中未电离的分子的浓之积为一常数是一个常数,这个常 度之比是一个常数,数就是该反应的化 这个常数称为电离常学平衡常数数影响 只与温度有关因素只与温度有关,升高 温度,K 值增大只与温度有关, 只与难溶电解升高温度,Kw 质的性质和温增大度有关二、化学平衡常数1.求解平衡常数;2.由平衡常数计算初始(或平衡)浓度; 常考题型3.计算转化率(或产率);4.应用平衡常数 K 判断平衡移动的方向(或放热、吸热等情况)。

高中化学五大平衡常数高中化学中常见的五大平衡常数是酸碱离子对的离解常数(Ka)、酸碱指数(pKa)、溶解度积常数(Ksp)、物质转化平衡常数(Kc)和气体混合物转化平衡常数(Kp)。
下面将详细介绍这五个平衡常数及其在化学反应中的作用。
一、酸碱离子对的离解常数(Ka):酸碱反应是化学中广泛存在的一种反应类型,它涉及到酸、碱及其离子之间的相互转化。
当酸溶液中的酸分子与水分子发生反应,产生氢离子(H+)时,称为强酸。
而酸溶液中的酸分子与水分子不发生反应,酸分子直接释放H+离子时,称为弱酸。
离解常数Ka表示弱酸分子在溶液中与水发生反应生成H+离子的程度。
Ka越大,说明酸性越强。
二、酸碱指数(pKa):酸碱指数是对弱酸或弱碱的酸碱强度的度量。
pKa与Ka之间的关系为:pKa = -log10(Ka)。
pKa越小,酸性越强。
三、溶解度积常数(Ksp):溶解度是指物质在给定温度和压力下能溶解在溶剂中的最大量。
溶解度积常数Ksp描述了溶质离解为离子的程度。
当溶液中的离子浓度达到溶解度积常数时,溶质已经溶解到了饱和状态。
Ksp越大,溶解度越大。
四、物质转化平衡常数(Kc):物质转化平衡常数描述了化学反应中物质转化的程度。
对于一个化学反应:aA + bB ↔ cC + dD,其平衡常数Kc为:Kc = [C]^c[D]^d / [A]^a[B]^b,其中[]表示浓度。
Kc的大小与反应前后各组分的浓度有关,当Kc>1时,反应倾向于生成产物;当Kc<1时,反应倾向于反应物。
五、气体混合物转化平衡常数(Kp):当化学反应中涉及气体组成时,可以使用气体混合物转化平衡常数Kp来描述反应的平衡状态。
Kp采用的是压强单位(单位为帕斯卡),与Kc之间的关系为:Kp =Kc (RT)^Δn,其中R为气体常数,T为温度,Δn为所生成的气体分子数减去反应物的气体分子数。
Kp与压强相关,与浓度无关。
综上所述,酸碱离子对的离解常数(Ka)、酸碱指数(pKa)、溶解度积常数(Ksp)、物质转化平衡常数(Kc)和气体混合物转化平衡常数(Kp)分别描述了化学反应中酸碱离子对的离解程度、酸碱强度、固体溶解度、物质转化程度和气体反应平衡状态。
2020届高考化学总复习提升方案——四大平衡常数1.四大平衡常数对比电离常数(K a、K b)水的离子积常数(K w) 难溶电解质的溶度积常数(K sp)盐类的水解常数(K h)概念在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离常数一定温度下,水或稀的水溶液中c(OH-)与c(H+)的乘积在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一个常数在一定温度下,当盐类水解反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的盐类水解平衡常数表达式(1)对于一元弱酸HA:HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)(2)对于一元弱碱BOH:BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)K w=c(OH-)·c(H+)M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)以NH+4+H2O NH3·H2O+H+为例影响因素只与温度有关,升高温度,K值增大只与温度有关,升高温度,K w增大只与难溶电解质的性质和温度有关盐的水解程度随温度的升高而增大,K h随温度的升高而增大2.“四大常数”间的两大等式关系(1)K W、K a(K b)、K sp、K h之间的关系①一元弱酸强碱盐:K h=K W/K a;②一元弱碱强酸盐:K h=K W/K b;③多元弱碱强酸盐,如氯化铁:Fe3+(aq)+3H2O(l)Fe(OH)3(s)+3H+(aq)K h=c3(H+)/c(Fe3+)。
将(K W)3=c3(H+)×c3(OH-)与K sp=c(Fe3+)×c3(OH-)两式相除,消去c3(OH-)可得K h=(K W)3/K sp。
(2)M(OH)n悬浊液中K sp、K w、pH间关系,M(OH)n(s)M n+(aq)+n OH-(aq)K sp=c(M n+)·c n(OH-)=c(OH-)n·cn(OH-)=c n+1(OH-)n=1n(K w10-pH)n+1。
专题:有关电解质溶液中的“四大常数”Ka 、Kb 、Kw 、Kh 、Ksp 的综合运用电离平衡常数(Ka 、Kb )、水的离子积常数(Kw )、盐的水解常数(Kh )、溶度积常数(Ksp )是电解质 溶液中的四大常数,综合性强、信息量大、思维强度大,是高考的热点,也是中学化学的重点与难点。
“四大常数”它们 均只与温度有关 ;电离平衡常数(Ka 、Kb)、水的离子积常数(Kw)以及盐的水解常 数(Kh)均随着温度的 升高而增大 ,因为弱电解质的 电离 、水的 电离 及盐的 水解 均为 吸热反应 。
而溶度积常数(K sp )大小随着温度的 升高不一定增大 ,因为溶度积还与难溶电解质的 性质和温度 有关。
【强调】:(1)有关常数的应用与计算,要紧紧围绕它们只与 温度有关 ,而不随其离子浓度的变化而变化来进行。
(2)相同类型 的难溶电解质的K sp 越小,溶解度越小,越难溶。
【高考真题】:例1、(17新课标I )常温下将NaOH 溶液滴加到己二酸(H 2X )溶液中, 混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是A.a 22(H X)K 的数量级为610- B. 曲线N 表示pH与2(HX )lg(H X)c c -的变化关系C. NaHX 溶液中(H )(OH )c c +->D. 当混合溶液呈中性时,2(Na )(HX )(X )(OH )(H )c c c c c +---+>>>=例2、(17新课标II)改变0.1 mol/L 二元弱酸H 2A 溶液的pH ,溶液中的H 2A 、HA -、A 2-的物质的量分数(X)δ随pH 的变化如图所示[已知22(X)(X)(H A)(HA )(A )c c c c δ--=++]。
下列叙述错误的是A .pH=1.2时,c(H 2A)=c(HA -)B .22lg[(H A)] 4.2K =-C .pH=2.7时,c(HA -)>c(H 2A)=c(A 2-)D .pH=4.2时,c(HA -)=c(A 2-)=c(H +)例3、(17新课标Ⅲ)在湿法炼锌的电解循环溶液中,较高浓度的Cl -会腐蚀阳极板而增大电解能耗。
四大高考化学平衡常数的相互关系与运算电解质溶液中的电离常数、水的离子积常数、水解常数及溶度积常数是在化学平衡常数基础上的延深和拓展,它是定量研究平衡移动的重要手段。
在复习时就要以化学平衡原理为指导,以判断平衡移动的方向为线索,以勒夏特列原理和相关守恒定律为计算依据,以各平衡常数之间的联系为突破口,联系元素及化合物知识,串点成线,结线成网,形成完整的认识结构体系.1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K W任意水溶液温度升高,K W增大K W=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h值增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp 难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数间的关系(1)CH3COONa、CH3COOH溶液中,K a、K h、K W的关系是K W=K a·K h。
(2)NH4Cl、NH3·H2O溶液中,K b、K h、K W的关系是K W=K b·K h。
(3)M(OH)n悬浊液中K sp、K W、pH间的关系是K sp=c(M n+)·c n(OH-)=c(OH-)n·cn(OH-)=c n+1(OH-)n=1n⎝⎛⎭⎫K W10-pHn+1。
3.四大平衡常数的应用(1)判断平衡移动方向Q c与K的关系平衡移动方向溶解平衡Q c>K逆向沉淀生成Q c=K不移动饱和溶液Q c<K正向不饱和溶液(2)判断离子浓度比值的大小变化如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离常数为c(NH+4)·c(OH-)c(NH3·H2O),此值不变,故c(NH+4)c(NH3·H2O)的值增大。
“四大平衡常数”综合问题1.(2018·漳州八校联考)已知 298 K 时,HNO 2 的电离常数K a =5×10-4。
硝酸盐和亚硝酸盐有广泛应用。
(1)298 K 时,亚硝酸钠溶液中存在:NO 2-+H 2OHNO 2+OH -K h 。
K h =________。
(2)常温下,弱酸的电离常数小于弱酸根离子的水解常数,则以水解为主。
0.1 mol·L -1NaOH 溶液和 0.2mol·L -1 HNO2 溶液等体积混合,在混合溶液中c (H +)________(填“>”“<”或“=”)c (OH -)。
(3)检验工业盐和食盐的方法之一:取少量样品溶于水,滴加稀硫酸酸化,再滴加 KI 淀粉溶液,若溶液变蓝 色,产生无色气体,且气体遇空气变红棕色,则该样品是工业盐。
写出碘离子被氧化的离子方程式: _________________________________________。
(4) 在酸性高锰酸钾溶液中滴加适量亚硝酸钠溶液,溶液褪色,写出离子方程式: ________________________________________________________________________。
(5)硝酸银溶液盛装在棕色试剂瓶中,其原因是硝酸银不稳定,见光分解生成银、一种红棕色气体和一种无 色气体。
写出硝酸银见光分解的化学方程式:_______________________________________。
(6)已知:298 K 时,K sp (AgCl)=2.0×10-10,K sp (Ag 2CrO 4)=1.0×10-12。
用标准 AgNO 3 溶液滴定氯化钠溶液中的 Cl -,用 K 2CrO 4 作指示剂。
假设起始浓度c (CrO 24-)=1.0×10-2mol·L -1,当 Ag 2CrO 4 开始沉淀时,c (Cl -)=________。
四大平衡常数(K a、K h、K w、K sp)的综合应用
1.四大平衡常数的比较
常数符号
适用
体系
影响因素表达式
水的离
子积常数K w
任意水
溶液
温度升高,
K w增大
K w=c(OH-)·c(H+)
电离常数酸K a
弱酸
溶液
升温,
K值增大
HA H++A-,电离常数K a= 碱K b
弱碱
溶液
BOH B++OH-,电离常数K b=
盐的水
解常数K h盐溶液
升温,K h
值增大
A-+H2O
OH-+HA,水解常数K h=
溶度
积常数K sp
难溶电
解质溶液
升温,大
多数K sp
值增大
M m A n的饱和溶液:K sp=
c m(M n+)·
c n(A m-)
2.四大平衡常数的应用
(1)判断平衡移动的方向
Q c与K的关系平衡移动方向溶解平衡
Q c>K逆向沉淀生成
Q c=K不移动饱和溶液
Q c<K正向不饱和溶液
(2)常数间的关系。
①K h=②K h=
(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1 NaOH溶液分别滴定体积均为
20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH 溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算
【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;
②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以V1<V2;
(2)反应平衡时溶液中c(Na+)=c(CH3COO-),依据溶液中电荷守恒c(Na+)+c(H+)=c(OH-)+
c(CH3COO-),反应后的溶液呈中性,c(H+)=c(OH-)=10-7mol·L-1;假设醋酸和氢氧化钠体积为1 L,得到n(Na+)=0.01 mol,n(CH3COOH)=a mol,反应后溶液中醋酸的电离常数
K===。
答案:(1)①Ⅰ②< (2)
1.(电离常数)相同温度下,根据三种酸的电离常数,下列判断正确的是 ( )
酸HX HY HZ
电离常数K9×10-79×10-610-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX溶液的电离常数
【解析】选B。
表中电离常数大小关系:10-2>9×10-6>9×10-7,所以酸性排序为HZ>HY>HX,可见A、C错。
电离常数只与温度有关,与浓度无关,D不正确。
2.(水的离子积常数)水的电离平衡曲线如图所示,下列说法不正确的是( )
A.图中五点K w间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
【解析】选C。
水的离子积常数只是温度的函数,温度越高离子积常数越大,温度不变则离子积常数不变;A点到D点氢离子浓度增大,可采用加入酸的方法;从A点到C点水的离子积常数增大,只能采用升高温度的方法;处在B点时水的离子积常数为10-12,pH=2的硫酸溶液c(H+)=10-2 mol·L-1,pH=10的KOH溶液c(OH-)=
10-2 mol·L-1,等体积混合恰好完全反应同时生成强酸强碱盐硫酸钾,因此混合液显中性。
3.(溶度积常数)Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s)Cu2+(aq)+2OH-(aq),在常温下,K sp=2×10-20。
某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调整pH,使溶液的pH大于( )
A.2
B.3
C.4
D.5
【解析】选D。
Cu(OH)2(s)Cu2+(aq)+2OH-(aq),其中K sp=c(Cu2+)·c2(OH-),要使Cu(OH)2沉淀需达到其K sp,故c(OH-)>= mol·L-1,故c(OH-)>1×10-9 mol·L-1,
则c(H+)<1×10-5 mol·L-1,因此pH应大于5。
【加固训练】
1.化学平衡常数(K)、弱酸的电离平衡常数(K a)、难溶物的溶度积常数(K sp)是判断物质性质或变化的重要的平衡常数。
下列关于这些常数的说法中,正确的是
(
)
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数K a变小
C.K sp(AgCl)>K sp(AgI) ,由此可以判断AgCl(s) + I-(aq)AgI(s)+ Cl-(aq)能够发生
D.K a(HCN)<K a(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
【解析】选C。
平衡常数的大小与温度有关,与浓度、压强、催化剂无关,A不正确;电离是吸热的,加热促进电离,电离常数增大,B不正确;酸的电离常数越大,酸性越强,D不正确。
2.草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用。
草酸在100 ℃开始升华,157 ℃时大量升华,并开始分解。
电离方程式电离常数
K1=5.4×10-2
H2C2O4H++HC2
K2=5.4×10-5
HC2H++C2
NH3·H2O N+OH-K=1.8×10-5
(1)(NH4)2C2O4溶液的pH____ 7(填“>”“<”或“=”)。
(2)用惰性电极电解饱和草酸溶液可制得乙醛酸(OHC—COOH)。
阴极的电极反应式为_______________________________________________ 。
(3)草酸钠是一种重要的还原剂。
合成草酸钠的操作如下:
草酸草酸钠晶体
①75%酒精的作用是________________________________ 。
②当草酸与碳酸钠的物质的量按2∶1充分混合后,溶液中pH<7。
请将该溶液中离子浓度按由大到小的顺序排列________________________________。
(4)已知某温度下CaC2O4的K sp为2.5×10-9。
将0.02 mol·L-1澄清石灰水和0.01 mol·L-1H2C2O4溶液等体积混合,所得溶液中C2的物质的量浓度为________ 。
【解析】(1)由题给表格可知,H2C2O4、HC2、NH3·H2O的电离常数大小为H2C2O4>HC2>NH3·H2O,故草酸铵溶液显酸性。
(2)阴极得电子发生还原反应:2H++HOOC—COOH+2e-HOOC—CHO+H2O。
(3)①加入酒精是为了降低草酸钠的溶解度,便于晶体析出。
②二者反应后溶质为草酸氢钠,因为溶液显酸性,所以HC2的电离程度大于其水解程度,则离子浓度大小顺序为c(Na+)>c(HC2)>c(H+)>c(C2) >c(OH-)。
(4)混合后所得溶液中c(Ca2+) =0.005 mol·L-1,K sp(CaC2O4)=c(Ca2+)·c(C2)=2.5×10-9,则
c(C2)= mol·L-1=5×10-7 mol·L-1。
答案:(1)<
(2)2H++HOOC—COOH+2e-HOOC—CHO+H2O
(3)①降低草酸钠的溶解度,便于晶体析出
②c(Na+)>c(HC2)>c(H+)>c(C2) >c(OH-)
(4)5×10-7 mol·L-1。