2020年高考化学专题复习“四大平衡常数”综合问题
- 格式:docx
- 大小:261.61 KB
- 文档页数:12


高三化学四大平衡常数及转化率一、电离平衡常数(K a、K b)二、水解平衡常数(K h)【习题】1、(1)常温下,将a mol·L-1CH3COONa溶于水配成溶液,向其中滴加等体积的b mol·L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数K a=________。
(2)在一定条件下,可用甲醇与CO反应生成醋酸消除CO污染。
常温下,将a mol·L-1的CH3COOH与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数K a=________(用含a和b的代数式表示)。
2、(1)已知25 ℃时,NH3·H2O的电离平衡常数K b=1.8×10-5mol·L-1,该温度下1 mol·L-1的NH4Cl溶液中c(H+)=________ mol·L-1。
(已知 5.56≈2.36)(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡________移动(填“向左”、“向右”或“不”)。
试计算溶液中c SO2-3c HSO-3=________。
(常温下H2SO3的电离平衡常数K a1=1.0×10-2,K a2=6.0×10-8)3、已知:25℃时某些弱酸的电离平衡常数。
下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是()CH3COOH HClO H2CO3K a=1.8×10-3Ka=3.0×10-8K a1=4.1×10-7 K a2=5.6×10-11A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-C. 图像中a点酸的总浓度大于b点酸的总浓度D. 图像中a、c两点处的溶液中相等(HR代表CH3COOH或HClO)三、水的离子积常数1、题型特点常考点:(1)计算温度高于室温时的K W;(2)利用K W的大小比较温度的高低;(3)利用K W=c(H+)·c(OH-)进行c(H+)与c(OH-)的相互换算;(4)溶液pH、水电离的c(H+)或c(OH-)的计算。


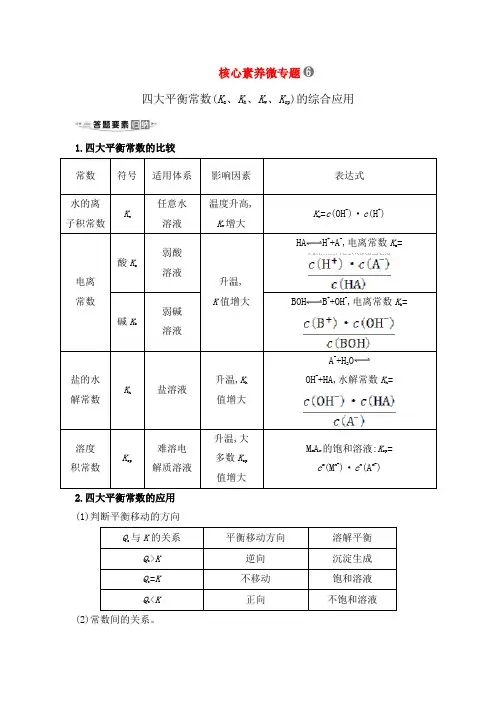
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数Kw任意水溶液温度升高,Kw增大Kw=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a= 碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数Kh盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数Ksp难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Qc与K的关系平衡移动方向溶解平衡Qc>K逆向沉淀生成Qc=K不移动饱和溶液Qc<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以。



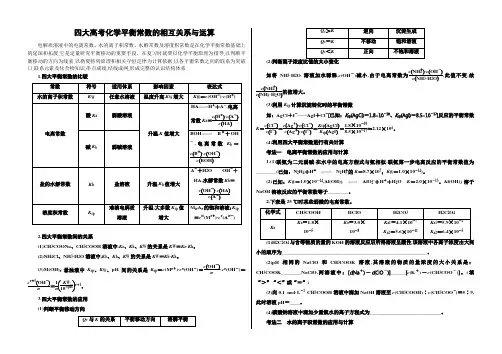
四大高考化学平衡常数的相互关系与运算电解质溶液中的电离常数、水的离子积常数、水解常数及溶度积常数是在化学平衡常数基础上的延深和拓展,它是定量研究平衡移动的重要手段。
在复习时就要以化学平衡原理为指导,以判断平衡移动的方向为线索,以勒夏特列原理和相关守恒定律为计算依据,以各平衡常数之间的联系为突破口,联系元素及化合物知识,串点成线,结线成网,形成完整的认识结构体系.1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K W任意水溶液温度升高,K W增大K W=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h值增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp 难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数间的关系(1)CH3COONa、CH3COOH溶液中,K a、K h、K W的关系是K W=K a·K h。
(2)NH4Cl、NH3·H2O溶液中,K b、K h、K W的关系是K W=K b·K h。
(3)M(OH)n悬浊液中K sp、K W、pH间的关系是K sp=c(M n+)·c n(OH-)=c(OH-)n·cn(OH-)=c n+1(OH-)n=1n⎝⎛⎭⎫K W10-pHn+1。
3.四大平衡常数的应用(1)判断平衡移动方向Q c与K的关系平衡移动方向溶解平衡Q c>K逆向沉淀生成Q c=K不移动饱和溶液Q c<K正向不饱和溶液(2)判断离子浓度比值的大小变化如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离常数为c(NH+4)·c(OH-)c(NH3·H2O),此值不变,故c(NH+4)c(NH3·H2O)的值增大。

“四大平衡常数”综合问题1.(2018·漳州八校联考)已知 298 K 时,HNO 2 的电离常数K a =5×10-4。
硝酸盐和亚硝酸盐有广泛应用。
(1)298 K 时,亚硝酸钠溶液中存在:NO 2-+H 2OHNO 2+OH -K h 。
K h =________。
(2)常温下,弱酸的电离常数小于弱酸根离子的水解常数,则以水解为主。
0.1 mol·L -1NaOH 溶液和 0.2mol·L -1 HNO2 溶液等体积混合,在混合溶液中c (H +)________(填“>”“<”或“=”)c (OH -)。
(3)检验工业盐和食盐的方法之一:取少量样品溶于水,滴加稀硫酸酸化,再滴加 KI 淀粉溶液,若溶液变蓝 色,产生无色气体,且气体遇空气变红棕色,则该样品是工业盐。
写出碘离子被氧化的离子方程式: _________________________________________。
(4) 在酸性高锰酸钾溶液中滴加适量亚硝酸钠溶液,溶液褪色,写出离子方程式: ________________________________________________________________________。
(5)硝酸银溶液盛装在棕色试剂瓶中,其原因是硝酸银不稳定,见光分解生成银、一种红棕色气体和一种无 色气体。
写出硝酸银见光分解的化学方程式:_______________________________________。
(6)已知:298 K 时,K sp (AgCl)=2.0×10-10,K sp (Ag 2CrO 4)=1.0×10-12。
用标准 AgNO 3 溶液滴定氯化钠溶液中的 Cl -,用 K 2CrO 4 作指示剂。
假设起始浓度c (CrO 24-)=1.0×10-2mol·L -1,当 Ag 2CrO 4 开始沉淀时,c (Cl -)=________。
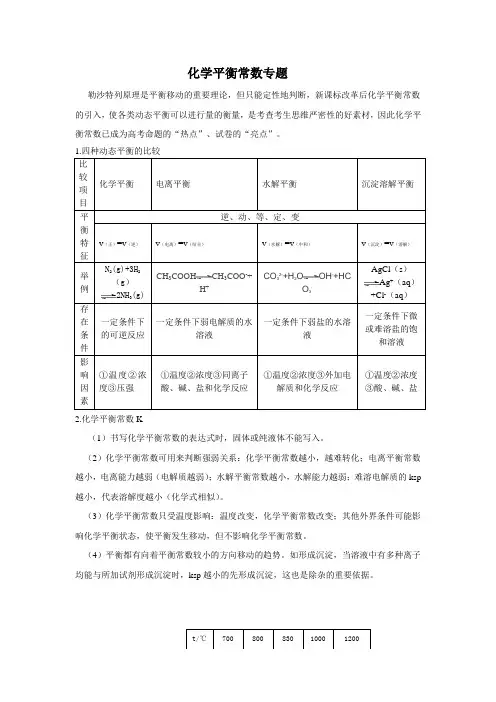
化学平衡常数专题勒沙特列原理是平衡移动的重要理论,但只能定性地判断,新课标改革后化学平衡常数的引入,使各类动态平衡可以进行量的衡量,是考查考生思维严密性的好素材,因此化学平衡常数已成为高考命题的“热点”、试卷的“亮点”。
比较项目化学平衡电离平衡水解平衡沉淀溶解平衡平衡特征逆、动、等、定、变v(正)=v(逆)v(电离)=v(结合)v(水解)=v(中和)v(沉淀)=v(溶解)举例N2(g)+3H2(g)2NH3(g)CH3COOH CH3COO-+H+CO32-+H2O OH-+HCO3-AgCl(s)Ag+(aq)+Cl-(aq)存在条件一定条件下的可逆反应一定条件下弱电解质的水溶液一定条件下弱盐的水溶液一定条件下微或难溶盐的饱和溶液影响因素①温度②浓度③压强①温度②浓度③同离子酸、碱、盐和化学反应①温度②浓度③外加电解质和化学反应①温度②浓度③酸、碱、盐2.化学平衡常数K(1)书写化学平衡常数的表达式时,固体或纯液体不能写入。
(2)化学平衡常数可用来判断强弱关系:化学平衡常数越小,越难转化;电离平衡常数越小,电离能力越弱(电解质越弱);水解平衡常数越小,水解能力越弱;难溶电解质的ksp 越小,代表溶解度越小(化学式相似)。
(3)化学平衡常数只受温度影响:温度改变,化学平衡常数改变;其他外界条件可能影响化学平衡状态,使平衡发生移动,但不影响化学平衡常数。
(4)平衡都有向着平衡常数较小的方向移动的趋势。
如形成沉淀,当溶液中有多种离子均能与所加试剂形成沉淀时,ksp越小的先形成沉淀,这也是除杂的重要依据。
t/℃700 800 830 1000 1200【例1】在一恒容密闭容器中有:K 0.5 0.9 1.0 1.6 2.5A(g)+B (g)2C(g)+2D(s),其化学平衡常数K和温度t的关系如下表,回答下列问题:(1)该反应的化学平衡常数表达式为_______________;该反应为__________(填“吸热”或“放热”)反应。
2020届高考化学总复习提升方案——四大平衡常数1.四大平衡常数对比电离常数(K a、K b)水的离子积常数(K w) 难溶电解质的溶度积常数(K sp)盐类的水解常数(K h)概念在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离常数一定温度下,水或稀的水溶液中c(OH-)与c(H+)的乘积在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一个常数在一定温度下,当盐类水解反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的盐类水解平衡常数表达式(1)对于一元弱酸HA:HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)(2)对于一元弱碱BOH:BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)K w=c(OH-)·c(H+)M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)以NH+4+H2O NH3·H2O+H+为例影响因素只与温度有关,升高温度,K值增大只与温度有关,升高温度,K w增大只与难溶电解质的性质和温度有关盐的水解程度随温度的升高而增大,K h随温度的升高而增大2.“四大常数”间的两大等式关系(1)K W、K a(K b)、K sp、K h之间的关系①一元弱酸强碱盐:K h=K W/K a;②一元弱碱强酸盐:K h=K W/K b;③多元弱碱强酸盐,如氯化铁:Fe3+(aq)+3H2O(l)Fe(OH)3(s)+3H+(aq)K h=c3(H+)/c(Fe3+)。
将(K W)3=c3(H+)×c3(OH-)与K sp=c(Fe3+)×c3(OH-)两式相除,消去c3(OH-)可得K h=(K W)3/K sp。
(2)M(OH)n悬浊液中K sp、K w、pH间关系,M(OH)n(s)M n+(aq)+n OH-(aq)K sp=c(M n+)·c n(OH-)=c(OH-)n·cn(OH-)=c n+1(OH-)n=1n(K w10-pH)n+1。
“四大平衡常数”综合问题1.(2018·漳州八校联考)已知 298 K 时,HNO 2 的电离常数K a =5×10-4。
硝酸盐和亚硝酸盐有广泛应用。
(1)298 K 时,亚硝酸钠溶液中存在:NO 2-+H 2OHNO 2+OH -K h 。
K h =________。
(2)常温下,弱酸的电离常数小于弱酸根离子的水解常数,则以水解为主。
0.1 mol·L -1NaOH 溶液和 0.2mol·L -1 HNO2 溶液等体积混合,在混合溶液中c (H +)________(填“>”“<”或“=”)c (OH -)。
(3)检验工业盐和食盐的方法之一:取少量样品溶于水,滴加稀硫酸酸化,再滴加 KI 淀粉溶液,若溶液变蓝 色,产生无色气体,且气体遇空气变红棕色,则该样品是工业盐。
写出碘离子被氧化的离子方程式: _________________________________________。
(4) 在酸性高锰酸钾溶液中滴加适量亚硝酸钠溶液,溶液褪色,写出离子方程式: ________________________________________________________________________。
(5)硝酸银溶液盛装在棕色试剂瓶中,其原因是硝酸银不稳定,见光分解生成银、一种红棕色气体和一种无 色气体。
写出硝酸银见光分解的化学方程式:_______________________________________。
(6)已知:298 K 时,K sp (AgCl)=2.0×10-10,K sp (Ag 2CrO 4)=1.0×10-12。
用标准 AgNO 3 溶液滴定氯化钠溶液中的 Cl -,用 K 2CrO 4 作指示剂。
假设起始浓度c (CrO 24-)=1.0×10-2mol·L -1,当 Ag 2CrO 4 开始沉淀时,c (Cl -)=________。
解析: (1)K h =c HNO 2·c -OH -=c HNO 2·c -OH -+·c H +=K W = 1×10--14 = 2×10 - 11 。
(2)NaOH + c NO 2c NO 2·c HK a 5×10 4HNO 2===NaNO 2+H 2O ,则混合后得到等物质的量浓度的 NaNO 2 和 HNO 2 的混合溶液,由(1)知 HNO 2 的电离常数大于 NO 2-的水解常数,故混合溶液中以 HNO 2 的电离为主,混合溶液呈酸性。
(3)酸性条件下亚硝酸钠氧化碘 离子,离子方程式为 2NO 2-+4H ++2I -===2NO ↑+I 2+2H 2O 。
(4)在强氧化剂存在的条件下,亚硝酸盐表现还原性:2MnO 4-+5NO 2-+6H +===2Mn 2++5NO 3-+3H 2O 。
(5)由氧化还原反应原理知,银、氮元素的化合价降低,则氧元素的化合价升高,无色气体为 O 2。
硝酸银见光分解的化学方程式为 2AgNO 3===光==2Ag +2NO 2↑+O 2↑。
(6)c 2(Ag +)·c (CrO 42-)=K sp (Ag 2CrO 4),c (Ag +)= 1.0×10--12 mol·L -1=1.0×10-5 mol·L -1。
c (Cl -)=K sp AgCl + =1.0×10 2c Ag2.0×10--10 mol·L -1=2.0×10-5 mol·L -1。
1.0×10 5 答案:(1)2×10-11(2)>(3)2NO 2-+4H ++2I -===2NO ↑+I 2+2H 2O(4)2MnO 4-+5NO 2-+6H +===2Mn 2++5NO 3-+3H 2O(5)2AgNO 3===光==2Ag +2NO 2↑+O 2↑ (6)2.0×10-5 mol·L -12.已知K 、K a 、K W 、K h 、K sp 分别表示化学平衡常数、弱酸的电离常数、水的离子积常数、盐的水解常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是____________。
a .它们都能反映一定条件下对应变化进行的程度b .它们的大小都随温度的升高而增大c .常温下,CH 3COOH 在水中的K a 大于在饱和 CH 3COONa 溶液中的K ad .一定温度下,在 CH 3COONa 溶液中,K W =K a ·K h (2)25 ℃时,将a mol·L -1 的氨水与 0.01 mol·L -1 的盐酸等体积混合所得溶液中c (NH 4+)=c (Cl -),则溶液显 ________(填“酸”“碱”或“中”)性;用含a 的代数式表示 NH 3·H 2O 的电离常数K b =________。
(3)25 ℃时,H 2SO 3HSO 3-+H +的电离常数K a =1×10-2mol·L -1,则该温度下 pH =3、c (HSO 3-)=0.1 mol·L-1的 NaHSO 3 溶液中c (H 2SO 3)=________。
(4)高炉炼铁中发生的反应有:FeO(s)+CO(g)Fe(s)+CO 2(g) ΔH <0该反应的平衡常数表达式K =________;已知 1 100 ℃时,K =0.25,则平衡时 CO 的转化率为________;在该温度下,若测得高炉中c (CO 2)=0.020 mol·L -1,c (CO)=0.1 mol·L -1,则此时反应速率是v 正________v逆(填“>”“<”或“=”)。
(5)已知常温下 Fe(OH)3 和 Mg(OH)2 的K sp 分别为 8.0×10-38、1.0×10-11,向浓度均为 0.1 mol·L -1 的 FeCl 3、MgCl 2 的混合溶液中加入碱液,要使 Fe 3+完全沉淀而 Mg 2+不沉淀,应该调节溶液 pH 的范围是________。
(已知 lg 2=0.3,离子浓度低于 10-5mol·L -1 时认为沉淀完全)解析:(1)对于正反应为放热反应的化学平衡,升高温度,平衡逆向移动,平衡常数减小,b 选项错误;温度不变,CH 3COOH 的电离常数不变,c 选项错误。
(2)根据电荷守恒得c (H +)+c (NH 4+)=c (Cl -)+c (OH -),因为+ - + -c NH 4·c OH - 10-9c H ·c HSO 3c (NH 4 )=c (Cl ),所以c (H )=c (OH ),故溶液显中性。
K b = = 。
(3)由K a =, c NH 3·H 2O a -0.01c H 2SO 3代入数据得c (H 2SO 3)=0.01 mol·L -1。
(4)根据方程式可得K =c CO 2;设开始时c (CO)=a mol·L -1,平衡时c (CO 2) c CO=b mol·L-1,则b =0.25,得a=5b,则平衡时CO 的转化率为b=b×100%=20%;Q c=c CO2=0.20<0.25,a-b a 5b c CO故v正>v逆。
(5)K sp[Fe(OH)3]=c(Fe3+)·c3(OH-),Fe3+完全沉淀时c3(OH-)=8.0×10--38,得c(OH-)=2×10-11 mol·L 10 5-1.0×10-111,pH=3.3,Mg(OH)2开始沉淀时c2(OH-)==1.0×10-10,得c(OH-)=1×10-5 mol·L-1,pH=9,0.1调节pH 范围为[3.3,9)。
答案:(1)ad (2)中10-9 (3)0.01mol·L-1 a-0.01(4)c CO220% >(5)[3.3,9)c CO3.(2018·青岛模拟)(1)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)Cu2++2OH-K sp=2.2×10-20Cu2++4NH3·H2O3)4]2+(深蓝色)+4H2O Kβ=7.24×1012①请用数据说明利用反应:Cu(OH)2(s)+4NH3·H2O3)4]2++4H2O+2OH-配制铜氨溶液是否可行:_______________________________________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+3)4]2++4H2O K=5.16×102。
向盛有少量Cu(OH)2 固体的试管中加入14 mol·L-1 的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为______________________________________ ;解释出现该现象的原因是________________________________________________________________________。
(2)乙二酸俗名草酸(二元弱酸,结构简式:HOOC—COOH),被广泛的应用于抗生素类药物的合成。
①实验室中经常利用酸性KMnO4 溶液滴定法测其纯度。
已知草酸与酸性KMnO4 溶液反应过程有无色无味气体产生,且KMnO4 溶液紫色褪去,写出草酸与酸性KMnO4 溶液反应的离子方程式:____________________________________________________;②资料表明:25 ℃时草酸的电离平衡常数K a1=6.0×10-2;K a2=6.4×10-5;据此分析,室温时草酸氢钾(KHC2O4) 的水解反应平衡常数K h =________( 单位省略,计算结果保留两位有效数字) ,其溶液中c(H2C2O4)______c(C2O24-)(填“小于”“等于”或“大于”)。
解析:(1)①根据平衡常数定义,K=c2(OH-)×c{[Cu(NH3)4]2+}/c4(NH3·H2O)=c2(OH-)×c{[Cu(NH3)4]2+}×c(Cu2 +)/[c4(NH3·H2O)×c(Cu2+)]=K sp×Kβ=2.2×10-20×7.24×1012=1.6×10-7<10-5,此反应很难进行。