(新)高考化学复习四大平衡常数的综合应用PPT
- 格式:ppt
- 大小:1.40 MB
- 文档页数:16

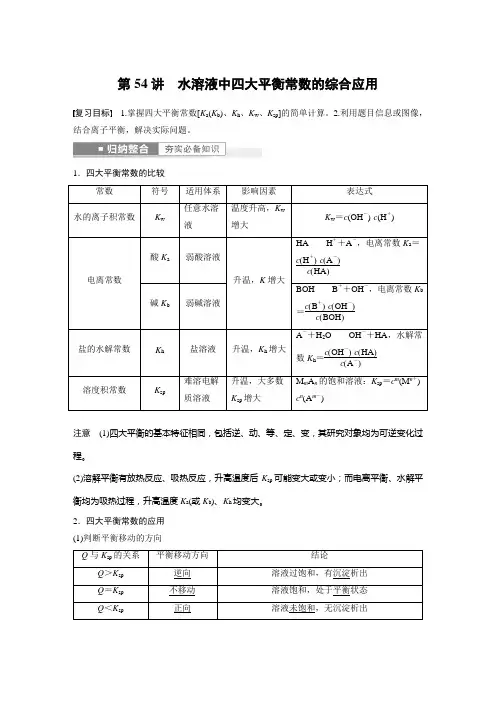
第54讲水溶液中四大平衡常数的综合应用复习目标 1.掌握四大平衡常数[K a(K b)、K h、K w、K sp]的简单计算。
2.利用题目信息或图像,结合离子平衡,解决实际问题。
1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K w 任意水溶液温度升高,K w增大K w=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp 难溶电解质溶液升温,大多数K sp增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)注意(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a(或K b)、K h均变大。
2.四大平衡常数的应用(1)判断平衡移动的方向Q与K sp的关系平衡移动方向结论Q>K sp逆向溶液过饱和,有沉淀析出Q=K sp不移动溶液饱和,处于平衡状态Q<K sp正向溶液未饱和,无沉淀析出(2)常数间的关系 ①强碱弱酸盐:K h =K w K a ;②强酸弱碱盐:K h =K wK b。
(3)判断离子浓度比值的大小变化。
如将NH 3·H 2O 溶液加水稀释,c (OH -)减小,由于电离平衡常数为c (NH +4)·c (OH -)c (NH 3·H 2O ),此值不变,故c (NH +4)c (NH 3·H 2O )的值增大。

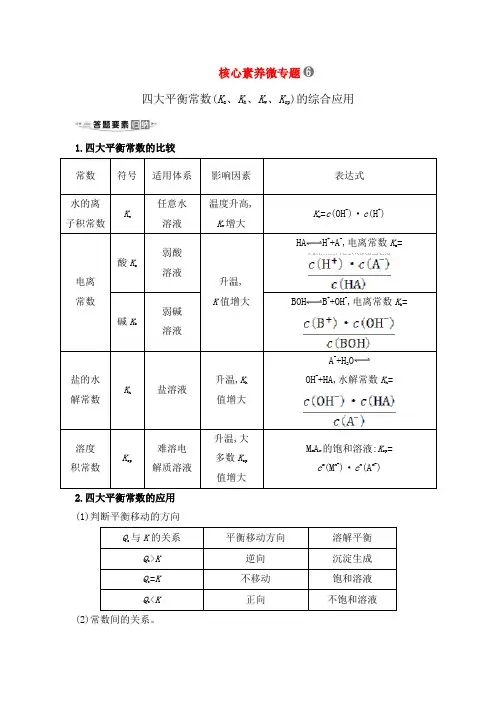
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数Kw任意水溶液温度升高,Kw增大Kw=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a= 碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数Kh盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数Ksp难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Qc与K的关系平衡移动方向溶解平衡Qc>K逆向沉淀生成Qc=K不移动饱和溶液Qc<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以。



四大平衡常数(Ka 、Kh 、Kw 、Ksp)的综合应用1.四大平衡常数的比较常数 符号适用 体系影响因素 表达式水的离子积常数 K w任意水 溶液温度升高, K w 增大K w =c(OH -)·c(H +) 电离 常数酸K a弱酸溶液升温, K 值增大 HAH ++A -,电离常数K a =碱K b弱碱 溶液BOHB ++OH -,电离常数K b =盐的水 解常数K h 盐溶液升温,K h 值增大A -+H 2OOH -+HA,水解常数K h =溶度 积常数K sp难溶电解质溶液升温,大 多数K sp值增大M m A n 的饱和溶液:K sp =c m(M n+)· c n(A m-)2.四大平衡常数的应用 (1)常数间的关系。
①K h =②K h =(2)判断离子浓度比值的大小变化。
如将NH 3·H 2O 溶液加水稀释,c(OH -)减小,由于电离平衡常数为,此值不变,故的值增大。
(3)利用四大平衡常数进行有关计算。
【典例】(1)用0.1 mol ·L -1 NaOH 溶液分别滴定体积均为20.00 mL 、浓度均为0.1 mol ·L -1的盐酸和醋酸溶液,得到滴定过程中溶液pH 随加入NaOH 溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以V1<V2;(2)反应平衡时溶液中c(Na+)=c(CH3COO-),依据溶液中电荷守恒c(Na+)+c(H+)=c(OH-)+ c(CH3COO-),反应后的溶液呈中性,c(H+)=c(OH-)=10-7 mol·L-1;假设醋酸和氢氧化钠体积为1 L,得到n(Na+)=0.01 mol,n(CH3COOH)=a mol,反应后溶液中醋酸的电离常数K===。



