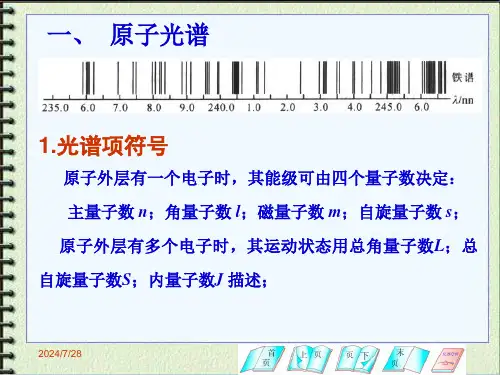
多电子原子的光谱项概述(PPT52页)
- 格式:ppt
- 大小:2.88 MB
- 文档页数:51

结构化学 2.18 多电子原子的能级和光谱的选律
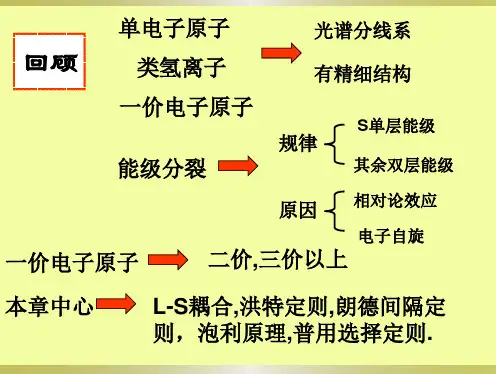
2.18.1 多电子原子的能级
S 最大的谱项能量最低;
若S 相同,则其中L 最大者的能量最低;
若S 和L 都相同:正光谱的J 越小,能量越低;
反光谱的J 越大,能量越低。
正光谱项——未半充满或半充满的组态所导出的光谱项,
如p 1,p 2,p 3等组态所导出的光谱项;
反光谱项——由半充满以后的组态如p 4,p 5组态等导出
的光谱项。
(1) 光谱项能级高低的判断
(2) 多电子原子能级图
(3) 多电子原子光谱的选律电子在2个不同能级间的跃迁,并非总是能发生,而是遵守下面的选律:。






结构化学 2.17多电子原子的光谱项——等价电子光谱项推引这类电子要考虑Pauli禁律,光谱项的求法较复杂。
p2组态为例考虑到自旋,p状态的简并度=6,两个电子在这六个状态中的分布方式有15种,也就是说,有15种微观状态。
这15种状态如表所示。
65152×=2根据此表可求光谱项:表中最大的M L=2,说明最大的M L, Z = 。
根据L的加和规则断定有一L=2的轨道角动量,即应有一个D项。
而第1个态的M S= 0。
由M S= 0可断定其S= 0,所以这个态应属于1D。
但1D并不止包含第一个态:对于L= 2,M L的可能取值为2、1、0、-1、-2等五种;对于S = 0,M S的可能取值只有0一种,两者结合起来可有5个态,这5个态的M L和M S分别为M L210-1-2M S00000它们都属于光谱项1D,挑选出这五个态,第3和第6个态都有M L=1,M S=0,只要任意选出一个就行了,在表中选出了第1、3、5、12、15等5个态属于1D。
得到了1D后,将属于1D的这五个态去掉,在所剩下的十个态中再重复上述手续。
第2个态M L= 1,因而L=1,这应有一个P项。
M S= 1,因而S= 1,所以这个态属于3P。
将属于3P的态都挑选出来:L=1时M L的可能取值为1、0、-1,所以3P项应M L10-110M S 11100-110-10-1-1-1挑选出第2、4、6、7、8、9、11、13、14等九个态属于3P再去掉这九个态,只剩下第10个态:其M L = 0,M S = 0,可断定L =0,S = 0,属于1S 。
而此光谱项也只包含这一状态。
得到了等价电子p 2组态的三个光谱项:1S 、2P 、1D说明:(1)在非等价电子光谱项中,凡是L +S =偶数的,为其等价电子的光谱项(只适用于2个电子的组态)例如,非等价电子(2p 13p 1)组态的光谱项:3D ,3P ,3S ,1D ,1P ,1S 对应的L= 2 1 0 2 1 0S = 1 1 1 0 0 0L +S = 3 2* 1 2* 1 0*(2) 满壳层结构电子组态(s 2、p 6、d 10、f 14)的光谱项:1S 0M L = 0,L =0 M = 02S +1=1,J =0带*号为等价电子光谱项。

电子行业多电子原子的光谱项概述在电子行业,多电子原子的光谱项是研究原子和分子性质的重要工具之一。
本文将介绍电子行业中多电子原子的光谱项的概念、原理、应用以及未来的发展方向。
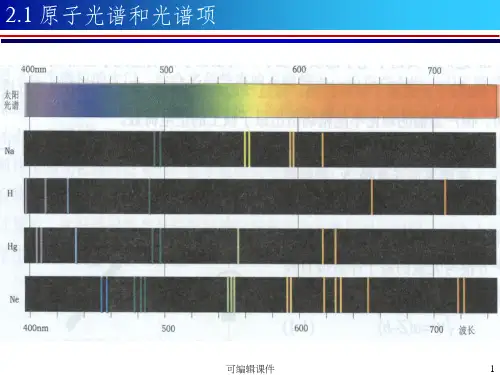
多电子原子的光谱项多电子原子是指其原子核周围存在多个电子的原子。
在多电子原子中,由于电子之间的相互作用,会出现复杂的光谱效应。
多电子原子的光谱项代表了不同能级跃迁引起的光谱线。
在光谱中,每个光谱项对应着一种特定的跃迁,每个跃迁会有不同的能级差和频率。
在多电子原子中,由于电子间的相互作用,普通原子的单个电子能级会分裂成多个能级,形成光谱项。
这些能级分裂是由于原子核的静电场和电子间的库伦排斥力导致的。
多电子原子的光谱项不仅受到能级分裂的影响,还受到电子的角动量、自旋和磁矩等因素的影响。
多电子原子的光谱项的原理多电子原子的光谱项的形成是由于原子核周围多个电子的相互作用引起的。
这些相互作用包括库伦排斥力、电子之间的相互吸引力、角动量耦合等。
库伦排斥导致了电子能级的分裂,电子之间的相互吸引力导致了能级的再结合,而角动量耦合则决定了光谱项的具体形式。
在多电子原子中,光谱项由两个基本量子数n 和l唯一确定。
其中n表示主量子数,代表能级的大小,l表示轨道量子数,描述电子的角动量。
每个光谱项可以由一个或多个谱线组成,每个谱线对应着一个特定的跃迁。
多电子原子的光谱项的能级跃迁通常有两种类型:电价电子跃迁和内层电子跃迁。
电价电子跃迁是指电子从价层跃迁到束缚态或者自由态,导致可见光谱线的出现;内层电子跃迁是指电子从内层到外层跃迁,导致X射线、紫外线或者软X 射线的辐射。
多电子原子的光谱项的应用多电子原子的光谱项在电子行业有着广泛的应用。
以下是一些常见的应用领域:光谱分析多电子原子的光谱项可以提供原子和分子性质的重要信息,因此被广泛应用于光谱分析领域。
通过分析光谱项的位置、强度和形状,可以确定物质的成分、浓度、温度等参数。
光谱分析在材料科学、环境监测、药物研发等领域都有着重要的应用。