橙汁饮料中Vc含量的测定
- 格式:doc
- 大小:67.50 KB
- 文档页数:3

2013届毕业项目摘要:果汁饮料的主要原料就是水果,其中的主要营养成分是维生素C。
维生素C又称为抗坏血酸,属于水溶性维生素,在水溶液中易被空气和其他氧化剂氧化,但在弱酸性条件下较稳定,所以本次用碘量法测定果汁中的维生素C的含量。
本次方法简单,可靠,准确度较高,在实验室得到广泛应用。
关键词:果汁饮料;维生素C;碘量法
2013届毕业项目
目录
1绪论 (1)
1.1果汁饮料的概念 (1)
1.2果汁饮料的发展 (1)
1.3对果汁饮料中维生素C测定意义 (1)
2.实验部分 (3)
2.1实验原理 (3)
2.2实验仪器与试剂 (3)
2.3实验步骤 (4)
2.4数据处理 (5)
3.结果与分析 (7)
3.1数据变动原因 (7)
3.2不同方法对比实验 (7)
3.3酸碱性对维生素C测定的影响.......................................................................
3.4含量影响因素...................................................................................................
4.结论........................................................................................................
参考文献 (11)
致谢 (12)
1。

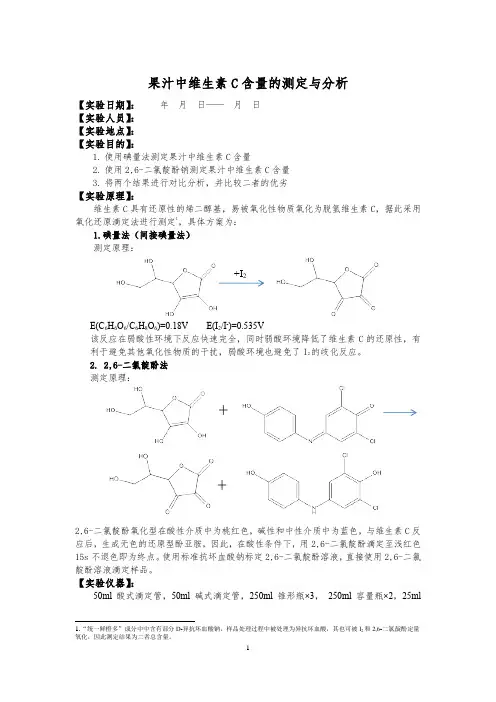
果汁中维生素C含量的测定与分析【实验日期】:年月日——月日【实验人员】:【实验地点】:【实验目的】:1.使用碘量法测定果汁中维生素C含量2.使用2,6-二氯靛酚钠测定果汁中维生素C含量3.将两个结果进行对比分析,并比较二者的优劣【实验原理】:维生素C具有还原性的烯二醇基,易被氧化性物质氧化为脱氢维生素C,据此采用氧化还原滴定法进行测定1,具体方案为:1.碘量法(间接碘量法)测定原理:+I2E(C6H6O6/C6H8O6)=0.18V E(I2/I-)=0.535V该反应在弱酸性环境下反应快速完全,同时弱酸环境降低了维生素C的还原性,有利于避免其他氧化性物质的干扰,弱酸环境也避免了I2的歧化反应。
2. 2,6-二氯靛酚法测定原理:1.“统一鲜橙多”成分中中含有部分D-异抗坏血酸钠,样品处理过程中被处理为异抗坏血酸,其也可被I2和2,6-二氯靛酚定量氧化,因此测定结果为二者总含量。
++2,6-二氯靛酚氧化型在酸性介质中为桃红色,碱性和中性介质中为蓝色,与维生素C反应后,生成无色的还原型酚亚胺,因此,在酸性条件下,用2,6-二氯靛酚滴定至浅红色15s不退色即为终点。
使用标准抗坏血酸钠标定2,6-二氯靛酚溶液,直接使用2,6-二氯靛酚溶液滴定样品。
【实验仪器】:50ml酸式滴定管,50ml碱式滴定管,250ml锥形瓶×3,250ml容量瓶×2,25ml移液管,10ml量筒,100ml量筒,玻璃棒,表面皿。
电子分析天平(0.0001g),真空循环水泵,抽滤瓶。
【实验试剂】:K2Cr2O7(基准试剂),KIO3(基准试剂),VC(基准试剂),Na2S2O3·5H2O(分析纯)、KI(分析纯)H2C2O4·2H2O(分析纯),淀粉溶液(5%)市售“统一鲜橙多”(瓶装2500ml)2【实验内容】:2.由于“统一鲜橙多”中维生素C的含量比较高(25mg/100ml),而其他饮料中维生素C的含量都是10mg/100ml以下,为了使实验现象更明显,故选用“统一鲜橙多”饮料,用来测定其维生素C的含量。

常见水果饮料Vc 含量测定报告课题主要目的是研究并测定水果或饮料中Vc 的含量.通过对Vc 的认识,及其各种测定的方法,以小组为单位开展以实验为主的课题研究.以下是我高一(10)班研究小组的研究成果报告.维生素C (686O H C ).具有较强的还原性,加热或在溶液中易氧化分解,在碱性条件下更易被氧化.能够促进提高人体的免疫功能.可以说是人体必不可少的重要物质.测定Vc 有助于了解Vc 深入化学世界.在日常学习中知道碘单质具有氧化性Vc 可以被碘单质氧化.因此我们根据关键反应方程式进行了讨论.关键反应方程式:HI O H C I O H C 22662682+−→−+根据这个实验基本目的开始了实验.实验试剂:1.需测定的含有Vc 的溶液.(为了简单直接.我小组选用了学校出售的"鲜橙多"饮料.Vc 含量10-100mg/100ml)2.淀粉溶液.3.已经由指导老师配制好的含碘溶液(硫代硫酸钠.KI.氯水使 碘离子子不易流失)实验器材:酸氏滴定管.小烧杯.锥形瓶.移液管.铁架台等实验基本操作:由组内的实验员负责进行操作滴定.以下为实验过程把"鲜橙多"饮料打开倒足量到烧杯,用移液管移取其到锥形瓶里(溶液恰好到0刻度时开始移取).在移取好的溶液里加入2-3滴淀粉溶液震荡摇匀.放在避光处.向滴定管里倒入碘溶液,需倒在0刻度以上.(操作之前.滴定管活塞处于关闭状态).夹于铁架台上.用左手操作活塞(活塞开关在右手边)把滴定管内的多余气泡冲掉.并且把液面降至0刻度以下.不要降得太多了.我组先将液面降至2ml 处.把待测溶液的锥形瓶放于滴定管下.开始滴定.缓慢操作活塞让碘溶液一滴一滴地加入待测液.一边震荡锥形瓶使其均匀反应.待溶液呈现微兰色且不会褪色的时候表示实验结束且成功了.记录下目前数据.滴定管内液面约在3.95ml 处.即用去了1.95ml 碘溶液.重复以上实验方法.对新的待测液进行滴定.同样记录下数据.液面越在 6.00ml 处.即用去了2.05ml 碘溶液.实验完毕.把数据整理下.计算下.实验数据:两次用去的碘溶液体积是1.95ml 和2.05ml根据已知的公式计算的出结果:分别是11.84mg/100ml12.22mg/100ml将以上结果求平均值:12mg/100ml实验用的饮料瓶上标明Vc含量为10-100mg/100ml.比对下看看哦.实验的出的结果与之相类似.看来实验是成功了.那么就是.我组实验用的橙汁饮料中Vc含量为12mg/100ml,与标准数据相符合.小组对实验成功的分析:根据关键反应公式.维生素C与碘单质发生氧化还原反应.日常学习中所知碘单质遇到淀粉-KI溶液会变兰色.正是因为这样.在滴定的时候向有淀粉的待测液里加入碘单质溶液.与维生素C反应溶液不会变兰色.可是一旦维生素C反应完全了.那就碘单质过量.在碘单质过量的情况下溶液显微兰色.表明维生素C反应光了,没了.只要变成微兰色就可以了.一旦变成了偏棕红色就表示加入的碘溶液过量了.实验失败.需要重新去做一次.实验的关键在于.滴定操作的熟练程度.还好组内实验员能力值得信赖.才得以成功.本次课题的收获有通过亲自动手来进行Vc含量的测定不仅仅增广了我们的知识面.还提高了我们的动手能力.小组之间的合作能力.管理分工达到明确.对实验操作的熟练度训练.还有对某些时候实验连续失败的忍耐力.还有哦.不光知道这一种实验测定的方法.在查阅资料的时候还有如:间接碘量法,荧光法等.然则现今的我们不容易理解也不会去做.本次研究课课题对个人,对学习大有帮助.以上高一(10)班研究小组组员:高翔赵斌王宵驰评语:报告结构完整,数据真实、详细。

工业技术科技创新导报 Science and Technology Innovation Herald41维生素C是人体重要的维生素之一,其参与体内的氧化还原反应、多种羟化反应,有防止贫血的作用,可促进伤口愈合,维持牙齿、骨骼、血管和肌肉的正常功能。
人体不能自身制造维生素C,所以人体必须不断地从食物中摄入维生素C。
德国营养研究会建议,每人每天应摄取50~100 m g的维生素C。
而30 m g的维生素C是人体1 d摄取维生素C的最少值,如果低于30 m g,身体就会缺乏维生素C,使得部分机能无法正常运作,长期以往,甚至出现坏血症。
1 实验原理维生素C 分子式C 6H 8O 6,在空气中稳定,但在水溶液中易被空气和其他氧化剂氧化,生成脱氢抗坏血酸。
分子结构中的烯二醇基具有还原性,可被I 2定量地氧化成二酮基,抗坏血酸分子中的烯二醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,因而可用I 2标准溶液直接测定。
其滴定反应式如下:C 6H 8O 6+I 2=C 6H 6O 6+2H I。
所以当滴定的溶液出现蓝色时即为终点。
2 实验仪器与试剂2.1 仪器50 m L 滴定管、滴定管、250 m L锥形瓶、250 m L 容量瓶、25 m L移液管、500 m L烧杯、研钵、玻璃棒、电子分析天平等。
2.2 试剂2.2.1 K 2C 2O 7标准溶液(约为1/3的1.42×10-2 mol/L)准确称取0.35~0.36 g的K 2C 2O 7基准物质于小烧杯中,加入适量蒸馏水,待其全部溶解后转移至250 m L 容量瓶中,定容、摇匀、备用。
2.2.2 I 2溶液(约为1.42×10-2 mol/L)称取1.8I 2和3.5 g K I,置于研钵中加少量水,充分研磨。
待I 2全部溶解后,将溶液转入棕色试剂瓶,加水稀释至500 m L,摇匀,放置暗处保存。
2.2.3 Na 2S 2O 3标准溶液(约为2.90×10-2 mol/L)称取3.5 gNa 2S 2O 3·5H 2O置于500 m L烧杯中,加入新煮沸冷却的蒸馏水,使其全部溶解,再加入少量的Na 2CO 3,DOI:10.16660/ k i.1674-098X.2016.16.041橙汁饮料中维生素C含量的测定周卓娜(海南省高级技工学校化工部 海南海口 571000)摘 要:维生素C是一种己醛糖,广泛存在于植物组织中,有抗坏血酸的作用,又称抗坏血酸,是水溶性维生素。

鲜橙汁中维生素C的检测浅探一、问题的提出伴随炎炎夏日的来临,各种新鲜水果、蔬菜纷纷上市。
其中富含的维生素C是人类营养中最重要的维生素之一,维生素C(简称V C)又名抗坏血酸,由于人体不能自身合成,必须由新鲜水果、蔬菜提供。
结合高中课程,我布置一项作业,希望同学们设计一套实验对鲜橙汁饮品中的V C进行检测,很快学生通过各种途径查到维生素C的基本情况如下:分子式C6H8O6、密度1.65,熔点192℃易溶于水,性质活泼,那么如何据其结构简式检测它的可能性质及测其含量呢?设计实验过程并用实验证明。
二、方案设计:学生表现兴趣很浓,很快用溴水,用新制Cu(OH)2、NaOH溶液水解……方法呼之即出,但对其如何测含量从课本上找不到方法,资料上查出其具有很强的还原性,能把单质碘溶液来滴定测量。
学生迅速拟定具体的实验方案。
方案如下:第一:用溴水验证其碳碳双键存在;第二:用新制Cu(OH)2验证其多羟基的性质;第三:观察其在NaOH溶液中情况;第四:用标准的碘溶液通过中和滴定测V C的含量。
三、师生互动:通过学生亲自动手实验,体会到下列问题:新制Cu(OH)2配制方法,酯的水解产物弱酸性证明,标准碘溶液的配制方法,滴定操作的关键要点,误差分析等。
其中水解产物的弱酸性证明,能否用石蕊、酚酞等,学生通过动手实验认识到先在NaOH 酚酞,再加入鲜橙汁,渐加热,发现其红色渐变浅,说明水解发生后有酸性物生成,这种方法可以用于其它弱酸的证明上。
再者标准碘溶液的配制,因为碘在水中溶解度较低(0.029g),所以配制标准碘溶液时,加较深的KI。
称取的1.9g碘与20gKI混合后溶于水配成1.75×10-3mol/L碘的标准溶液。
四、具体操作:维生素C浓度取平均值为C= 123=504.03mg/L3五、活动体会:让学生运用已有的化学知识和实验技能,通过实验研究解决与日常生活有密切关系的课题,不仅是活动课的内容,也应是课堂教学的延伸。

饮料中维生素C的测定实验设计方案【实验原理】1.维生素C又称抗坏血酸Vc,分子式C6H8O6。
Vc具有还原性,可被I2定量氧化,因而可用I2标准溶液直接测定。
其滴定反应式如下:C 6H8O6+I2= C6H6O6+2HI用淀粉溶液作指示剂,若溶液突变成蓝色,则滴定终点到达。
2.I2标准溶液的标定(间接碘量法)碘标准溶液可选用As2O3直接标定,由于As2O3是有毒性物质,本实验选用Na2S2O3标定碘。
而Na2S2O3不是基准物质,不能直接配制标准溶液,需用K2Cr2O7来标定。
故I 2标准溶液的标定方法为:先用K2Cr2O7标定Na2S2O3的浓度,再用Na2S2O3标定I2标准溶液的浓度。
①用K2Cr2O7做基准物质,间接碘量法标定Na2S2O3溶液的浓度。
其过程为:K2Cr2O7与KI先反应析出I2,析出的I2再用标准的Na2S2O3溶液滴定,从而求得Na2S2O3的浓度。
这个标定Na2S2O3的方法为间接碘量法。
标定Na2S2O3溶液时有:6I-+Cr2O72-+14H+ = 2Cr3++3I2+7H2O;2S2O32-+I2= S4O62-+2I-根据以上反应方程式可知Na2S2O3标定时的计量系数比为:K 2C2O7:Na2S2O3= 1:6。
②用标准的Na2S2O3溶液标定I2标准溶液的浓度,用淀粉溶液作指示剂,若溶液突变成蓝色,则滴定终点到达。
碘量法的基本反应式:2S2O32-+I2= S4O62-+2I-根据以上原理可知各物质的定量关系比为:Vc :I2:Na2S2O3:K2C2O7= 1 :1 :2 :1/3【实验内容】测定不同饮料(统一鲜橙多,汇源橙汁)中维生素C的含量。
【实验用品】1.实验试剂(1)市售“统一鲜橙多”“汇源橙汁”饮料溶液的配制依据:根据“统一鲜橙多”饮料包装上标明的维生素C的含量:25mg/100ml,换算成摩尔浓度约为1.42×10-3mol/L(汇源橙汁含量与其近似)。

橙汁中维生素C含量的测定第5组成员:甘汉麟,李子宜指导教师:汤又文一、实验概述:目前维生素C(Vc)的测定方法有荧光分析法、碘量法、2,4-二硝基苯肼法、高效液相色谱法、铁(Ⅱ)-邻菲罗啉-BPR体系分光光度法、电位滴定法。
荧光分析法与高效液相色谱法的仪器比较昂贵,通常采用碘量法和2,6-二氯酚靛酚法。
但是一般样品处理后的样液都有颜色,不同程度地影响测定结果的准确性,另外,对颜色的去除步骤也较为繁琐,不适合大批量样品的测定。
二、实验原理:维生素C分子中含有还原性的烯二醇基,能被I2定量氧化为二酮基。
反应式如下:C6H8O6+I2=C6H6O6+2HIE (C6H6O6/ C6H8O6)=0.18V E(I2/I-)=0.535V该反应在弱酸性环境下反应快速完全,同时弱酸环境降低了维生素C的还原性,有利于避免其他氧化性物质的干扰,弱酸环境也避免了I2的歧化反应。
由于反应速率较快,可以直接用I2标准溶液滴定。
通过消耗I2溶液的体积及其浓度可以计算试样中维生素C的含量。
由于维生素C具有较强的还原性,在空气极易被氧化而变成黄色,尤其在碱性介质中更甚,测定时加入HAc使溶液呈弱酸性,减少维生素C 副反应。
由于I2的挥发性及对天平的腐蚀性,不宜在分析天平上称重,故应先配制一个近似浓度的溶液,然后再进行标定。
配制I2溶液时加入过量KI(I2与KI形成I3-使溶解度增加,挥发性大大降低)。
溶液保存在棕色瓶中放在暗处,避免见光而使浓度发生改变,还应避免与橡皮等有机物接触。
I2可以用已标定好的Na2S2O3标准溶液来标定I2溶液浓度。
淀粉指示剂要在接近终点时加入。
淀粉吸附大量I3-后,过早的形成蓝色化合物,由于较多的I2被淀粉的胶粒包住,影响其与Na2S2O3的反应,使终点拖长,且吸附后颜色变为深灰色,终点不好观察。
所以用Na2S2O3溶液滴定I2时应该在大部分的I2已被还原,溶液呈现淡黄色时才加入淀粉溶液。
+I2反应式如下:2Na2S2O3 + I2 = Na2S4O6 + 2NaINa2S2O3中一般含有S、NaCl等杂质,Na2S2O3不稳定,易分解,不能直接配制为标准溶液。



紫外分光光度法测定橙汁中维生素C的含量陈玉锋;庄志萍【摘要】[目的]为市售饮料中维生素C(Vc)的科学测定提供参考.[方法]利用Cu2+催化溶解氧氧化Vc,建立紫外分光光度法测定橙汁中还原型Vc的方法,并对测定条件进行优化.[结果]采用磷酸和醋酸混酸溶液(3∶7,V∶V)作稳定剂,Cu2+为催化剂,70 ℃恒温水浴中,测定市售橙汁饮品中Vc的含量,标准曲线方程为y=0.0714x+0.135 0,线性相关系数为0.999 5.该方法精密度RSD(n=5)为0.35%,加标回收率为98.5%.[结论]建立了紫外分光光度法测定橙汁中Vc的方法,该方法简单、快速,结果令人满意.%[Objective] Tth aim was to provide refereneces for the scientific determination of Vitamin C (Vc) in sold beverage. [Method]With Cu2+ as catalyst to oxidize Vc, the method to determine reduced Vc in orange juice by UV spectrophotometry was constructed, and then the determination conditions were optimized. [ Result] With the mixed solution of phosphoric acid and acetic acid (3∶7, V∶ V) as the stabiliz er, Cu2+ as catalyst and in the 70 ℃ water-circulator bath, Vc content in the sold orange juice was determined, the standard curve equation was y = 0.071 4x + 0.135 0, the linear correlation coefficient was 0.999 5, the precision RSD( n = 5 ) was 0.35% and recovery rate was 98.5%.[ Conclusion] The method to determine Vc in orange juice by UV spectrophotometry was constructed, which was simple and fiast and whose results were very satisfying.【期刊名称】《安徽农业科学》【年(卷),期】2011(039)001【总页数】3页(P236-237,240)【关键词】维生素C;紫外分光光度法;橙汁【作者】陈玉锋;庄志萍【作者单位】牡丹江师范学院化学化工学院,黑龙江牡丹江,157012;牡丹江师范学院化学化工学院,黑龙江牡丹江,157012【正文语种】中文【中图分类】S123目前维生素C(Vc)的测定方法有荧光分析法、碘量法、2,4-二硝基苯肼法、高效液相色谱法、铁(Ⅱ)-邻菲罗啉-BPR体系分光光度法、电位滴定法[1-6]。
实验 橙汁饮料中维生素C 的测定一、目的与要求1、掌握2.6-二氯酚靛酚测定维生毒C 的原理和方法。
2、 进一步熟练掌握滴定操作。
二、原理还原型抗坏血酸能还原染料2.6-二氯酚靛酚,该染料在酸性中呈红色(在中性或碱性溶液中呈蓝色),被还原后红色消失。
还原型抗坏血酸还原(染料)2.6-二氯酚靛酚后,本身被氧化成脱氢抗坏血酸。
在没有杂质干扰时,一定量的样品提取液还原标准2.6-二氯酚靛酚的量与样品中所含抗坏血酸的量成正比。
反应式如下:三、仪器滴定管,锥形瓶。
四、试剂(1)2%草酸溶液:溶解20克草酸结晶于200毫升水中,然后稀释至1000mL 。
(2)1%草酸溶液:取上述2%草酸溶液500mL ,用水稀释至1000mL 。
(3)抗坏血酸标准溶液:准确称取20mg 抗坏血酸,溶于1%草酸溶液中,移入10mL 量瓶中,并用1%草酸溶液稀释至100毫升,混匀,置冰箱中保存。
使用时吸取上述抗坏血酸5mL ,置于50毫升容量瓶中,用1%草酸溶液定容之。
此标准使用液每毫升含0.02mg 维生素C 。
(0.02mg/mL )标定:吸取标准使用液5mL 于三角烧瓶中,加入6%碘化钾溶液0.5mL ,1%淀粉溶液3滴,再以0.001mol/L 碘酸钾标准溶液滴定,终点为淡蓝色。
计算如下:088.021⨯=V V cc :抗坏血酸标准溶液的浓度,mg/mL ;V 1:滴定时所耗0.001mol/L 碘酸钾标准溶液的量,mL ;V 2:滴定时所取抗坏血酸的量,mL 。
0.088:lml O.0001N 碘酸钾标准溶液相当于抗坏血酸的量(mg /m1)(4)2,6-二氯靛酚溶液:称取碳酸氢钠52mg ,溶于200mL 沸水中,然后称取2,6-二氯靛酚50mg ,溶解在上述碳酸氢钠的溶液中,待冷,置于冰箱中过夜,次日过滤置于250mL 容量瓶中,用水稀释至刻度,摇匀。
此液应贮于棕色瓶中并冷藏,每星期至少标定1次。
标定:取5mL 已知浓度的抗坏血酸标准溶液,加入1%草酸溶液5mL ,摇匀,用上述配制的染料溶液2,6-二氯靛酚溶液滴定至溶液呈粉红色于15秒不褪色为止。
测定橙汁饮料中维生素C 的含量 小海中学 冯泽楚 知识目标:能将所学的“中和滴定”原理和操作技能进行知识迁移来解决实际生活中的问题;了解饮料中维生素c 含量测定的方法。
能力目标:运用问题解决模式、实验探究式教学方法,突出学生的主体地位,培养学生设计方案能力、实验、思维、分析、归纳、推理等综合思维能力和发展性学力。
科学思想:应用辩证唯物主义的观点,抓住研究问题的本质,由师生共同参与讨论评价,发现问题,解决问题,完善方案,从而掌握科学的探究方法,形成科学态度,提高科学素养。
通过对误差的分析,培养学生辩证唯物主义思想和实事求是的科学态度。
情意目标:通过探究式的学习方式,激发学生的学习兴趣和探索动机,变学生的被动接受式学习为主动发现式学习;通过比较调查结果和实验结果,让学生意识到学习化学的重要性,从而提高学习化学的兴趣。
教学方法:实验探究法、问题解决模式 教学媒体:多媒体、实验、录像 重点:维生素c 含量的测定方案确定和指示剂的选择。
难点:维生素c 含量测定方案的原理及计算。
课前准备:让学生调查、收集、整理、比较松江市售橙汁饮料的品牌、种类及其中所含v.c 的情况。
查阅维生素c 在人体中的生理作用。
教学过程: [录像]镜头中出现:某超市货架上摆满了琳琅满目的饮料和各式水果。
(话外音:社会在发展,我们的生活水平、生活质量在不断提高,除了正常的饮食外,我们每天还会定量地吃一些水果或喝一些果汁,目的是补充人体所需的营养物质,特别是维生素c 。
)看完这段录像,想必大家很想知道 [问题]为什么我们要不断补充维生素c ?维生素c 对我们人体有什么作用呢? (下面我们就请孙蕾和寿佳洁来介绍一下她们进行的市场调查和查找的资料。
) [学生展示收集的资料] 1、到超市里对饮料中维生素c 含量的调查; 2、维生素c 在我们人体中的生理作用。
[说明] 既然维生素c 对我们的健康有这么重要的作用,我们的确应该多吃些富含v.c 的蔬菜、水果或果汁饮料。
橙汁饮料中Vc含量的测定
2010级环境科学1班
古娟(201008011138)黄俊杰(201008041141)实验原理:
1.维生素C又称抗坏血酸,分子式为C
6H
8
O
6
,Vc呈酸性,具有较强的还原
性,加热或在溶液中易氧化分解,在碱性条件下更易被氧化。
在弱酸性条件下,能与碘单质发生氧化还原反应,反应式为:
C 6H
8
O
6
+I
2
=C
6
H
6
O
6
+2HI
可利用此性质滴定,以淀粉(遇碘变蓝)为指示剂。
2.Na
2S
2
O
3
见光易分解可用棕色瓶储于暗处,经8-14天后用K
2
Cr
2
O
7
做基准物
间接碘量法标定Na
2S
2
O
3
溶液的浓度,即称取一定量的K
2
Cr
2
O
7
,在弱酸性溶液中
与过量的KI作用析出一定量的I
2用K
2
Cr
2
O
7
滴定。
Cr2O72-+6I-+14H+==2Cr3++3I2+7H2O 此时应考虑K2Cr2O7基准物的反应条件:
1)合适的酸度。
溶液酸度高反应快,酸度太大,I-易被空气,且Na
2S
2
O
3
易
分解,故酸度一般在0.2〜0.4 mol•L-1为宜。
2)K
2Cr
2
O
7
与KI的反应速率慢,所以应在带塞的锥形瓶中暗处放置一段时
间,使两者反应完全。
3)所用 KI溶液不得含有I
2或K
2
Cr
2
O
7。
4) 滴定前需将溶液稀释。
若滴定到终点后,溶液迅速变蓝表示Cr
2O
7
2-离子反应不完全,可能是放置的
时间不够或溶液稀释过早。
3. I
2可以用已标定好的Na
2
S
2
O
3
进行标定,考虑到I
2
在强酸性中也易被氧
化,故一般选在PH为3-4的弱酸性溶液中进行滴定。
Na
2S
2
O
3
在弱酸性及KI存在条件下定量滴定I
2
:
I2+2S2O32-==2I-+S4O62-
实验试剂:
硫代硫酸钠(s) KI(s) HCl溶液(6 mol•L-1) HAc溶液
(2 mol•L-1) K
2Cr
2
O
7
标准溶液淀粉指示剂(5g/L) I
2
标准溶液
(0.005mol•L-1)橙子饮料样品(Vc含量约为25mg/100ml)。
实验步骤:
一、溶液的配制
1、硫代硫酸钠(0.01 mol•L-1):
称取1.3g Na
2S
2
O
3
•5H
2
O溶于500ml新煮沸的蒸馏水中,加入0.1g,保存于
棕色试剂瓶中,放置一周后进行标定
2、K
2Cr
2
O
7
标准溶液:
称取重铬酸钾固体0.5-0.6g,加水溶解后移入250 ml容量瓶中,用水稀释至刻度线处,摇匀。
3、KI(20%水溶液)
称2.5g KI固体溶于50 ml蒸馏水中。
4、I 2溶液(0.005mol •L -1)配制
称取I 2固体0.6-0.7g ,溶于浓KI 溶液中,溶解后移入500ml 棕色试剂瓶中,加水摇匀。
5、醋酸(0.2 mol •L -1)
量取17.4 mol •L -1的 34.4 ml 的冰醋酸稀释到300 ml 二、Na 2S 2O 3溶液的标定
准确移取25.00 ml 标准K 2Cr 2O 7 溶液于250 ml 碘量瓶中,加3 ml 6mol •L -1
的HCl ,5 mlKI ,盖上瓶塞,液封,摇匀后置于暗处5min ,使反应完全,加50 ml 蒸馏水稀释,以Na 2S 2O 3 滴定至黄绿色,加入2 ml 淀粉溶液,继续滴定至溶液呈亮绿色为终点,记录Na 2S 2O 3 的体积。
再重复标定两次,计算Na 2S 2O 3 的浓度。
25025
)O S V(Na )O Cr M(K 10006)O Cr m(K )O S c(Na 322722722322⨯
⨯⨯⨯=
三、I 2溶液的标定
准确移取25.00 ml 待标定的I 2 溶液于250 ml 的锥形瓶中,加50 ml 蒸馏
水,用Na 2S 2O 3 标准溶液滴定至溶液呈浅黄色,加3 ml 淀粉溶液,继续用
Na 2S 2O 3 溶液滴定至蓝色恰好消失,记录Na 2S 2O 3 的体积。
平行测定3份,计算I 2 的浓度。
四、Vc 含量的测定
用移液管移取100ml 橙汁样品于250ml 锥形瓶中,迅速向其中加入10ml 2mol/L 的HAc 溶液和2ml 淀粉溶液,用标准I 2溶液进行滴定,至溶液刚刚出现蓝色,30秒内不褪色,即为终点。
平行测定3份。
计算Vc 含量。
V )()(Vc 样品)
()(I )(I 22V c Vc M ⨯⨯=
ρ
五、实验数据表格 1、Na 2S 2O 3溶液的标定
1 2 3 V(Na 2S 2O 3)初/ml V(Na 2S 2O 3)终/ml V(Na 2S 2O 3)/ml
2。