6晶体结构详解
- 格式:pptx
- 大小:4.53 MB
- 文档页数:126

常见的晶体结构晶体结构是材料科学中的基础概念之一,也是研究材料性质和应用的重要手段。
通过研究晶体结构,可以了解材料的晶格结构、晶体缺陷、晶体生长以及物理性质等信息。
在本文中,我们将主要介绍几种常见的晶体结构。
1.立方晶系。
立方晶系是最简单、最对称的晶体结构之一,其中所有三个晶轴都是等长且互相垂直。
立方晶系包括体心立方晶体(bcc)和面心立方晶体(fcc)。
在体心立方晶体中,每个原子位于一个正八面体的中心和另外八个顶点之一,而在面心立方晶体中,每个原子位于一个正方形面的中心和其四个相邻原子分别组成的正方形的四个角上。
2.六方晶系。
六方晶系包括一个长度为a和两个垂直于晶轴的长度为c的晶轴,其正交晶面呈六边形。
六方晶系中最常见的是六方密堆积结构,其中每个原子最近的邻居原子共有12个,六个在同一水平面上,另外六个分别位于上下两个平面上。
3.正交晶系。
正交晶系包括三个长度分别为a、b和c的互相垂直的晶轴,其六个面分别为长方形。
正交晶系中最常见的结构是析出相结构,例如钛钶合金中的钛纤维基板。
4.单斜晶系。
单斜晶系包括两个长度不等、互相成锐角的晶轴,以及垂直于这两个轴的垂轴。
单斜晶系中最常见的结构是某些金属、半导体和陶瓷材料中的基体结构。
5.斜方晶系。
斜方晶系包括两个长度不等但互相垂直的晶轴以及一个垂直于晶面的垂轴。
斜方晶系的晶体结构非常多样,但最常见的是钙钛矿结构,这是一种广泛存在于氧化物中的晶体结构。
总结。
以上介绍的几种晶体结构是最常见的晶体结构之一,它们共同构成了材料科学中的基础知识。
了解晶体结构对于研究材料性质和开发新型功能材料非常重要。
另外,随着实验技术和计算方法的不断优化,我们对于各种晶体结构的了解将会越来越深入。

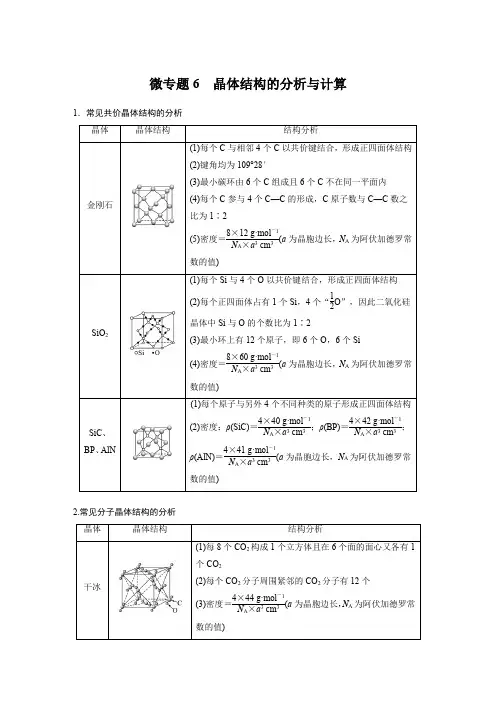
微专题6晶体结构的分析与计算1.常见共价晶体结构的分析晶体晶体结构结构分析金刚石(1)每个C与相邻4个C以共价键结合,形成正四面体结构(2)键角均为109°28′(3)最小碳环由6个C组成且6个C不在同一平面内(4)每个C参与4个C—C的形成,C原子数与C—C数之比为1∶2(5)密度=8×12 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)SiO2(1)每个Si与4个O以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,因此二氧化硅晶体中Si与O的个数比为1∶2(3)最小环上有12个原子,即6个O,6个Si(4)密度=8×60 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)SiC、BP、AlN (1)每个原子与另外4个不同种类的原子形成正四面体结构(2)密度:ρ(SiC)=4×40 g·mol-1N A×a3 cm3;ρ(BP)=4×42 g·mol-1N A×a3 cm3;ρ(AlN)=4×41 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)2.常见分子晶体结构的分析晶体晶体结构结构分析干冰(1)每8个CO2构成1个立方体且在6个面的面心又各有1个CO2(2)每个CO2分子周围紧邻的CO2分子有12个(3)密度=4×44 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)白磷密度=4×124 g·mol-1N A×a 3 cm 3(a为晶胞边长,N A为阿伏加德罗常数的值)3.常见离子晶体结构的分析NaCl型CsCl型ZnS型CaF2型晶胞配位数684F-:8;Ca2+:4密度的计算(a为晶胞边长,N A为阿伏加德罗常数的值)4×58.5 g·mol-1N A×a3 cm3168.5 g·mol-1N A×a3 cm34×97 g·mol-1N A×a3 cm34×78 g·mol-1N A×a3 cm31.AB型化合物形成的晶体结构多种多样。



七大晶体结构七大晶体结构是晶体学中最基本的晶体结构类型,它们分别是立方晶系、四方晶系、正交晶系、单斜晶系、菱形晶系、三斜晶系和六方晶系。
每个晶体结构都具有独特的空间排列方式和晶胞参数。
下面将对七大晶体结构进行详细介绍。
一、立方晶系立方晶系是指晶胞的三个边长相等,三个角度都为90度的晶体结构。
立方晶系包括立方晶体、体心立方晶体和面心立方晶体三种类型。
立方晶体的晶胞中原子或离子分布均匀,具有高度的对称性。
体心立方晶体在立方晶体的每个晶胞中心还有一个原子或离子,而面心立方晶体在立方晶体的每个面中心还有一个原子或离子。
二、四方晶系四方晶系是指晶胞的三个边长相等,其中两个角度为90度,另一个角度为120度的晶体结构。
四方晶系中最典型的晶体是正长石,它具有独特的双锥体晶胞。
三、正交晶系正交晶系是指晶胞的三个边长相等,三个角度都为90度的晶体结构。
正交晶系中的晶体结构较为复杂,包括石英、长石等多种类型。
四、单斜晶系单斜晶系是指晶胞的三个边长不相等,其中两个角度为90度,另一个角度不为90度的晶体结构。
单斜晶系中的晶体结构具有较低的对称性,例如单斜硫。
五、菱形晶系菱形晶系是指晶胞的三个边长相等,三个角度都不为90度的晶体结构。
菱形晶系中的晶体结构具有较低的对称性,例如菱英石。
六、三斜晶系三斜晶系是指晶胞的三个边长不相等,三个角度都不为90度的晶体结构。
三斜晶系中的晶体结构最为复杂,具有最低的对称性,例如石膏。
七、六方晶系六方晶系是指晶胞的三个边长相等,其中两个角度为90度,另一个角度为120度的晶体结构。
六方晶系中的晶体结构具有较高的对称性,例如石墨和冰。
七大晶体结构是晶体学中的基本分类,它们分别具有不同的对称性和晶胞参数,对于研究晶体的物理性质和化学性质具有重要意义。

ca6晶体结构
CA6晶体结构属于六方晶系。
CA6,即六铝酸钙(CaAl12O19或CaO·6Al2O3),是一种具有优异高温性能的材料,广泛应用于钢铁冶金等高温领域。
其晶体结构特点是:
-镜面层与尖晶石基块:CA6的结构由镜面层和尖晶石基块沿着c-轴堆叠而成。
每个晶胞通常包含两个镜面层和两个尖晶石基块。
-六方晶系:由于镜面层中的Ca2+半径大于O2-半径,Ca2+无法进入O2-构成的间隙中,因此CA6的晶体结构是六方晶系而非立方晶系。
此外,在制备过程中,CA6晶体的片状生长特性可能会影响其致密化,从而影响材料的性能。
研究人员正在探索通过结构改性方法来提高CA6的致密度。
综上所述,CA6的晶体结构对其性能有着重要影响,尤其是在高温应用中的稳定性和耐用性。
通过材料科学的研究和工艺改进,可以进一步优化CA6的性能,以满足工业应用的需求。
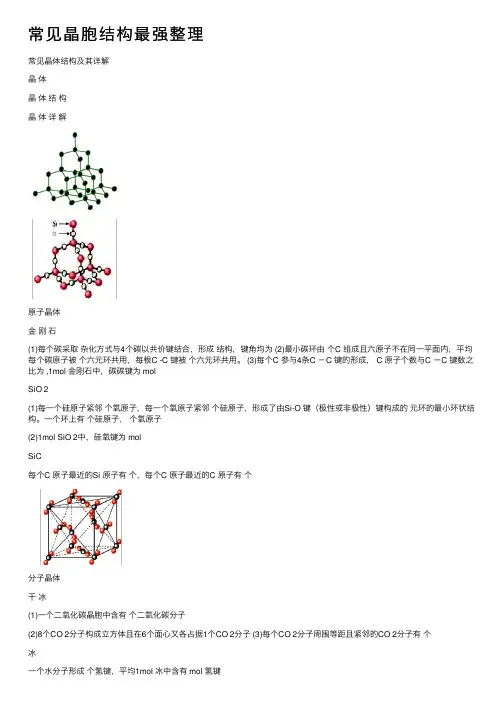
常见晶胞结构最强整理常见晶体结构及其详解晶体晶体结构晶体详解原⼦晶体⾦刚⽯(1)每个碳采取杂化⽅式与4个碳以共价键结合,形成结构,键⾓均为 (2)最⼩碳环由个C 组成且六原⼦不在同⼀平⾯内,平均每个碳原⼦被个六元环共⽤,每根C -C 键被个六元环共⽤。
(3)每个C 参与4条C -C 键的形成, C 原⼦个数与C -C 键数之⽐为 ,1mol ⾦刚⽯中,碳碳键为 molSiO 2(1)每⼀个硅原⼦紧邻个氧原⼦,每⼀个氧原⼦紧邻个硅原⼦,形成了由Si-O 键(极性或⾮极性)键构成的元环的最⼩环状结构。
⼀个环上有个硅原⼦,个氧原⼦(2)1mol SiO 2中,硅氧键为 molSiC每个C 原⼦最近的Si 原⼦有个,每个C 原⼦最近的C 原⼦有个分⼦晶体⼲冰(1)⼀个⼆氧化碳晶胞中含有个⼆氧化碳分⼦(2)8个CO 2分⼦构成⽴⽅体且在6个⾯⼼⼜各占据1个CO 2分⼦ (3)每个CO 2分⼦周围等距且紧邻的CO 2分⼦有个冰⼀个⽔分⼦形成个氢键,平均1mol 冰中含有 mol 氢键C 60(1)⾜球烯的分⼦是由60个碳原⼦构成的,空间构型有12个正五边形,20个正六边形(2)⼀个C 60分⼦中含有根单键,根双键 (3)C 60晶胞中与⼀个C 60最近的C 60分⼦有个(与⼲冰的晶胞相似)离⼦晶体NaCl (型)(1)每个Na +周围等距且紧邻的Cl -有个,每个Cl -周围等距且紧邻的Na +有个。
每个Na +周围等距且紧邻的Na +有个,同理Cl -也然。
(2)每个晶胞中含个Na +和4个Cl -。
CsCl (型)(1)每个Cs +周围等距且紧邻的Cl -有个,每个Cl -周围等距且紧邻的Cs +有个。
(2)左图为个晶胞;右图为⼀个晶胞,每个晶胞中含个Cs +,个Cl -。
CaF 21、1个晶胞中含有个Ca 2+,个F -,Ca 2+的配位数为个,F -配位数为个2、Ca 2+周围等距离最近的Ca 2+ 个,F —周围等距离最近的F — 个⾦属晶体简单⽴⽅堆积典型代表空间利⽤率配位数为体⼼⽴⽅堆积典型代表空间利⽤率配位数为⾯⼼⽴⽅堆积典型代表空间利⽤率配位数为六⽅最密堆积典型代表空间利⽤率配位数为混合晶体⽯墨1、碳原⼦的杂化⽅式为,键⾓为2、⽯墨晶体的⽚层结构中,每个六元碳环含有个碳原⼦数,每个六元碳环所含有的共价健数是个3、⽯墨同层C 原⼦间以连接,熔化需要破坏碳碳之间作⽤⼒,故熔沸点较⾼;层与层之间的作⽤⼒为,作⽤⼒⽐较弱,故⽯墨的硬度较低。

6种典型离子晶体结构一、正方晶系:NaCl型正方晶系是最简单的晶体结构之一,其代表性的离子晶体结构是NaCl型。
NaCl型晶体由阳离子和阴离子组成,阳离子居于晶格点的立方中心,阴离子则占据立方体的顶点。
这种排列方式使得阳离子和阴离子之间的距离相等且相邻离子的电荷相反。
NaCl型晶体具有高度的离子性,具有良好的热稳定性和电绝缘性能,常见的NaCl型晶体有氯化钠(NaCl)、氟化钠(NaF)等。
二、六方晶系:CsCl型六方晶系中的CsCl型晶体结构是由一个简单的离子晶体组成,其中一个离子位于晶格点的中心,而另一个离子则位于晶格点的顶点。
CsCl型晶体具有高度的离子性和坚硬性,常见的CsCl型晶体有氯化铯(CsCl)、溴化铯(CsBr)等。
三、正交晶系:CaF2型正交晶系中的CaF2型晶体结构由一个阳离子和两个阴离子构成,阳离子位于晶格点的中心,而两个阴离子则位于晶格点的顶点。
CaF2型晶体具有高度的离子性和硬度,常见的CaF2型晶体有氟化钙(CaF2)、氧化锶(SrO)等。
四、斜方晶系:RbBr型斜方晶系中的RbBr型晶体结构由一个阳离子和一个阴离子构成,阳离子位于晶格点的中心,而阴离子则位于晶格点的顶点。
RbBr型晶体具有较高的离子性和热稳定性,常见的RbBr型晶体有溴化铷(RbBr)、碘化铷(RbI)等。
五、菱方晶系:ZnS型菱方晶系中的ZnS型晶体结构由一个阳离子和一个阴离子构成,阳离子位于晶格点的中心,而阴离子则位于晶格点的顶点。
ZnS型晶体具有较高的离子性和硬度,常见的ZnS型晶体有硫化锌(ZnS)、硫化铜(Cu2S)等。
六、单斜晶系:CrCl2型单斜晶系中的CrCl2型晶体结构由一个阳离子和两个阴离子构成,阳离子位于晶格点的中心,而两个阴离子则位于晶格点的顶点。
CrCl2型晶体具有较高的离子性和热稳定性,常见的CrCl2型晶体有氯化铬(CrCl2)、溴化铬(CrBr2)等。
离子晶体的结构多种多样,其中典型的结构有正方晶系的NaCl型、六方晶系的CsCl型、正交晶系的CaF2型、斜方晶系的RbBr型、菱方晶系的ZnS型和单斜晶系的CrCl2型。

六方晶系晶格结构晶体是由原子、离子或分子按照一定的规则排列而成的固体物质。
晶体的结构可以分为不同的晶系,其中六方晶系是一种常见的晶体结构。
六方晶系是指具有六个对称轴的晶体结构。
在六方晶系中,晶格常数a和c是不相等的,而且夹角为90度。
晶格常数a是指晶格的基本长度单位,而c则是指晶格在z轴方向上的长度。
在六方晶系中,a和c的比值通常接近于1.633。
六方晶系的晶格可以用一个六边形的平面和一个垂直于平面的三角形来描述。
六方晶系中最常见的晶体结构是六方最密堆积结构。
在这种结构中,原子以六边形紧密堆积的方式排列在平面上,而每一层的原子则位于上一层的孔隙中。
这种结构的特点是具有高度的对称性和紧密的堆积度,因此具有良好的力学性能和导电性能。
六方最密堆积结构中,每个原子都有12个近邻原子。
由于六方晶系的对称性,每个原子周围的近邻原子都可以分为三个不同的位置,分别称为A、B和C位。
A位和C位的近邻原子位于同一平面上,而B位的近邻原子则位于上一层和下一层的孔隙中。
由于六方最密堆积结构的特殊性,A位和C位的近邻原子的数目相等,而B位的近邻原子的数目则为两倍。
六方晶系的晶格结构对材料的性能和应用有着重要影响。
在材料科学领域中,六方晶系的晶格结构被广泛应用于金属、陶瓷和半导体等材料的研究和开发中。
六方晶系的高度对称性和紧密的堆积度使得材料具有优异的力学性能和导电性能,在航空航天、汽车制造和电子器件等领域有着广泛的应用。
总结起来,六方晶系是一种具有六个对称轴的晶体结构。
其中最常见的晶体结构是六方最密堆积结构,它具有高度的对称性和紧密的堆积度。
六方晶系的晶格结构对材料的性能和应用有着重要影响,广泛应用于金属、陶瓷和半导体等材料的研究和开发中。
六方晶系的研究不仅对于深入理解晶体结构的原理和性质有着重要意义,也为材料科学的发展和应用提供了新的可能性。

六方晶系和立方晶系晶体学是研究晶体结构和性质的学科,它是化学、物理、材料科学、地质学等多学科交叉的领域。
晶体学中最基本的是晶体的结构类型,晶体的结构类型根据晶体中原子或离子的排列方式分为七种晶系,其中六方晶系和立方晶系是最常见的两种晶系。
一、晶体学基础晶体是由有序排列的原子或离子构成的固体,其具有三维周期性结构。
晶体中的原子或离子按照一定的规律排列,形成各种不同的晶体结构类型。
晶体结构是指晶体中原子或离子的空间排列方式,它是晶体学的基础。
晶体的结构类型可以根据晶体中原子或离子的排列方式分为七种晶系,分别是立方晶系、正交晶系、单斜晶系、三斜晶系、菱方晶系、六方晶系和五方晶系。
二、六方晶系六方晶系是指晶体中原子或离子的排列方式具有六方对称性的晶体结构类型。
六方晶系的晶体中原子或离子的排列方式是沿着六个等长的轴线排列的,其中三条轴线垂直于水平面,另外三条轴线呈120度夹角排列。
六方晶系的晶体结构具有高度的对称性,它的空间群为P6/mmc或P6/m。
六方晶系的晶体中原子或离子的密堆积方式是ABCABC…的方式,其中每个六角形的顶点处有一个原子或离子。
六方晶系的典型代表是金刚石和石墨。
三、立方晶系立方晶系是指晶体中原子或离子的排列方式具有立方对称性的晶体结构类型。
立方晶系的晶体中原子或离子的排列方式是沿着三个等长的轴线排列的,其中每条轴线之间呈90度夹角排列。
立方晶系的晶体结构具有高度的对称性,它的空间群为Fm-3m或Fd-3m。
立方晶系的晶体中原子或离子的密堆积方式是ABCABC…的方式,其中每个正方形的顶点处有一个原子或离子。
立方晶系的典型代表是钻石、铜、铝等。
四、六方晶系和立方晶系的区别六方晶系和立方晶系的最大区别在于它们的晶体结构具有不同的对称性和不同的晶体形态。
六方晶系的晶体结构具有六方对称性,而立方晶系的晶体结构具有立方对称性。
六方晶系的晶体形态是六边形的棱柱,而立方晶系的晶体形态是正方体。
另外,六方晶系和立方晶系的密堆积方式也有所不同。
安徽安徽高中化学竞赛无机化学第六章晶体结构基础6. 0. 01 晶体的四种差不多类型:依照晶体中微粒之间相互作用的性质,能够将晶体分成4种差不多类型:离子晶体、金属晶体、分子晶体和原子晶体。
6. 1. 01 分子晶体及其物理性质:分子之间以分子间作用力结合成的晶体称为分子晶体。
由于熔、沸点较低,因此分子晶体一样要在较低的温度下才能形成,而在常温时多以气体形式存在。
分子晶体的硬度较小,导电性能一样较差,因为电子从一个分子传导到另一个分子专门不容易。
6. 1. 02 极性分子:分子的正电荷重心和负电荷重心不重合,则为极性分子。
6. 1. 03 偶极矩:极性分子的极性能够用偶极矩m 来度量。
若正电荷(或负电荷)重心上的电荷量为q,正、负电荷重心之间距离即偶极长为d,则偶极矩m = q d6. 1. 04 偶极矩的单位:当d = 1.0 ´10-10 m,即d 为 1 ,q = 1.602 ´10-19 C,即q 为电子的电荷量时,偶极矩m = 4.8 D。
D 为偶极矩单位,称为德拜。
在国际单位制中,偶极矩m以C•m(库仑•米)为单位,当q = 1 C,d = 1 m时,m = 1 C•m。
C•m 与D 这两种偶极矩单位的换算关系为= 3.34 ´10-30 C•m6. 1. 05 永久偶极:极性分子的偶极矩称为永久偶极,偶极矩的矢量方向由正极指向负极。
多原子分子中的大p 键及孤电子对,有时也阻碍分子的偶极矩。
6. 1. 06 诱导偶极:非极性分子在外电场的作用下,能够变成具有一定偶极矩的极性分子,如下面左图所示。
而极性分子在外电场作用下,其偶极矩也能够增大,如下面右图所示。
在电场的阻碍下产生的偶极称为诱导偶极。
6. 1. 07 阻碍诱导偶极的因素:诱导偶极强度大小与电场强度成正比,也与分子的变形性成正比。
所谓分子的变形性,即分子的正、负电荷重心的可分程度。
分子体积越大,电子越多,变形性越大。
常见的晶体结构高中化学晶体是由原子、分子或离子等按照一定的规则排列组成的固体物质。
晶体结构是指晶体中原子、分子或离子的排列方式和空间位置的有序性。
以下是一些常见的晶体结构:1.立方晶系:立方晶系是最简单的晶体结构类型,具有最高的对称性。
立方晶系包括以下几种晶体结构:-简单立方结构:最简单的晶体结构,如钠金属。
-面心立方结构:每个立方格点上除了原子所在的角点外,还有一个原子位于正方形面的中心,如铝、铜等。
-体心立方结构:每个立方格点上除了原子所在的角点外,还有一个原子位于立方体的中心,如铁、锂等。
-体心立方密堆结构:在体心立方结构的基础上,每个体心立方顶点上还有各自的三个原子,如铬、铤等。
2.六方晶系:六方晶系的晶体结构相对复杂,具有六重轴对称性。
六方晶系包括以下几种晶体结构:-六方最密堆积结构:最密堆积的晶体结构,如铝合金、硬质合金等。
3.正交晶系:正交晶系的晶体结构具有三个相互垂直的轴和互相垂直的面,没有对称轴。
正交晶系包括以下几种晶体结构:-基心正交结构:每个顶点上有原子以外,还有一个原子位于底面的中点,如锌等。
-面心正交结构:每个顶点上原子以外,还有一个原子位于两个邻接底面的中点和两个对称角上的原子,如镍。
4.单斜晶系:单斜晶系的晶体结构具有一个二重轴和一组不对称的轴,没有对称轴。
单斜晶系包括以下几种晶体结构:-单斜底心结构:每个顶点上有原子以外,还有一个原子位于两个底面的中点,如铅、镀镍等。
5.斜方晶系:斜方晶系的晶体结构没有对称轴,具有两个相等且垂直的轴。
-斜方单斜结构:具有一个反射面,如黄铁矿、菱铁矿等。
6.三斜晶系:三斜晶系的晶体结构没有对称轴,也没有垂直的轴。
三斜晶系包括以下几种晶体结构:-无底心三斜结构:没有底心原子,如铜酸亚锌等。
这些晶体结构是根据晶体的对称性进行分类的,每一种晶体结构都有其独特的排列方式和空间位置。
通过研究晶体结构,可以揭示物质的物理和化学性质以及材料的制备和应用方面的特点。
六方晶系6mm点群晶体六方晶系是一种具有6mm点群晶体结构的晶体形态。
六方晶系晶体在自然界中十分常见,例如石英、石墨和蜂窝煤等。
它们具有独特的晶体结构和性质,对于我们理解晶体学和应用于材料科学方面具有重要意义。
首先,让我们来描绘一下六方晶系晶体的结构。
六方晶系晶体的晶胞形状类似于一个棱柱,顶端为一个六边形,底面为一个正六边形。
在这个六边形的顶点和中点分别铺设了平行于底面的晶面,从而形成了一个具有六个棱柱面的结构。
这样的晶体结构非常稳定,能够通过六个折射面将光线折射到相应的方向上。
六方晶系晶体的晶胞中所包含的原子或离子排列方式也具有一定特点。
以石英为例,它是由硅酸盐的四面体和若干层氧离子构成的。
这种特殊的结构使得石英拥有优良的透明性和耐高温性能,广泛应用于光学器件、材料科学和地质学等领域。
除了石英,六方晶系晶体还包括了石墨和蜂窝煤等材料。
石墨由碳原子通过特殊的层状排列方式构成,每个石墨层之间的结合力较弱,因此石墨具有很好的可柔性和导电性。
它广泛应用于铅笔芯、电池电极和涂料等领域。
而蜂窝煤则是一种由无定形的碳排列组成的材料,具有较低的密度和良好的吸附性能,被广泛应用于吸附材料、催化剂和石油加工等领域。
六方晶系晶体的性质也对应着其结构特点。
首先,由于其晶胞结构的稳定性,六方晶系晶体在物理上表现出极高的硬度和耐磨性。
这使得它们在工程材料和磨料方面得到广泛应用。
其次,六方晶系晶体的各向异性非常强,即在不同方向上具有不同的性质。
例如,石墨在垂直于石墨层的方向上具有导电性,而平行于石墨层的方向上则导电性较差。
这种各向异性使得六方晶系晶体在电子学和传感器领域非常有价值。
总之,六方晶系晶体作为一种典型的6mm点群晶体,其独特的结构和性质为我们理解晶体学和材料科学提供了重要的指导。
通过研究这些晶体,我们可以深入了解其形成机制、性质优劣以及应用领域。
六方晶系晶体在光学、电子学、材料科学等领域的广泛应用也为我们带来了更多可能性和未来发展方向。