第二节 乙醇 醇类
- 格式:ppt
- 大小:570.00 KB
- 文档页数:36





烃的衍生物第二节乙醇醇类根据你学过的知识,通过哪些反应可以生成乙醇,请大家讨论后写出方程式。
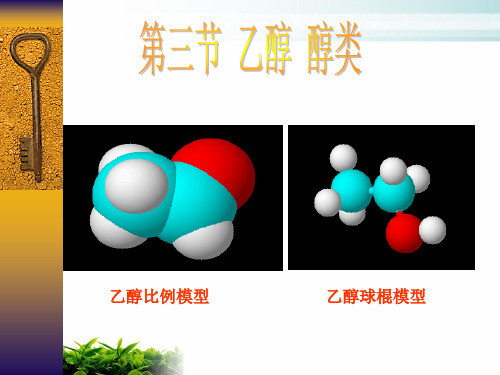
2.CH3CH2Br+NaOH—CH3CH2OH+NaBr一、乙醇1.乙醇的分子结构先展示乙烷的球棍模型,再在一个C—H键之间加一个氧原子球模型,变成乙醇分子的模型。
让学生观察后,写出乙醇的分子式、结构式、电子式、结构简式。
分子式:C2H6O结构式:电子式:结构简式:CH3CH2OH或C2H5OH官能团:羟基(—OH)2.物理性质:乙醇俗称酒精;乙醇是无色透明、具有特殊气味的液体;乙醇易挥发;能与水以任意比互溶,并能够溶解多种有机物。
3.化学性质【问题】1.乙醇是极性分子还是非极性分子?什么事实可以证明?2.乙醇溶于水是否导电?为什么?【参考答案】1.乙醇是极性分子。
它与水任何比互溶就是因为相似相溶。
2.乙醇溶于水不导电。
因为乙醇是非电解质。
(1)与Na反应【演示实验】向试管中投入一小块金属钠,将产生的气体用小试管收集,移近酒精灯火焰检验【实验现象】试管内钠粒沉于液态无水乙醇底部,后浮于水面上有无色气泡在钠粒表面生成后逸出液面,最终钠粒消失液体仍为无色透明;收集到的气体遇酒精灯火焰产生爆鸣现象【实验结论】乙醇与钠在常温下较缓慢地反应,生成氢气。
【说明】实验证明,H2中的H来自于羟基(一OH)上的氢。
【化学方程式】2CH3CH2OH+2Na→2CH3CH2ONa+H2↑【问题】 该反应属于有机反应中的什么反应类型? 【参考答案】 取代反应。
【问题】与Na 和水反应比较,说明了什么问题? 【参考答案】乙醇羟基上的H 不如水中的H 活泼。
【说明】 ①乙醇与钠的反应比水与钠反应要缓和得多,这说明乙醇羟基中的氢原子不如水分子中的氢原子活泼。
综合乙醇与Na 反应和金属活动性顺序便知,钾、钙等很活泼的金属也能与乙醇发生反应。
【练习】写出乙醇和Ca 反应的化学方程式。
【答案】2CH 3CH 2OH+Ca →(CH 3CH 2O)2Ca+H 2↑(2) 氧化反应A 、乙醇的催化氧化【演示实验】按下图装置设计实验:把一端弯成螺旋状的铜丝放在酒精灯外焰中加热,使铜丝表面生成一薄层黑色的CuO ,立即把它插入盛有乙醇的试管里,这样反复操作几次。
【本讲教育信息】一. 教学内容:第二节 乙醇 醇类二. 学习目标:1. 掌握乙醇主要化学性质2. 了解醇类的一般通性和几种典型醇的用途官能团是羟基,它决定了乙醇的化学性质,但乙基(—32CH CH )对羟基也有影响。
在H O C --结构中,O C -键和H O -键都有断裂的可能。
乙醇是非电解质,是极性分子。
(1)跟金属的反应:↑+→+22323222H ONa CH CH Na OH CH CH注:乙醇与金属钠的反应没有水与金属钠的反应剧烈,这是因为乙醇比水难电离。
↑+→+222323)(2H Mg O CH CH Mg OH CH CH注:活泼金属如K 、Ca 、Na 、Mg 、Al 等与乙醇均能反应,断裂H O -键。
(2)氧化反应① 燃烧:O H CO O OH CH CH 22223323+−−→−+点燃② 脱氢:∆+−−−→−+O H CHO CH O OH CH CH 23223222催化剂(工业制乙醛)O H Cu CHO CH CuO OH CH CH 2323++−→−∆+现象:氧化铜由黑色变为亮红色,并产生刺激性气味。
注:上述氧化过程中,乙醇分子断裂H O -键和H C -键。
(3)脱水反应① 分子内脱水(消去反应):CCH SOH ︒===−−−−→170242浓O H CH 22+↑注:与羟基相连的碳原子相邻的碳原子上的H 原子和—OH 才能发生分子内脱水反应。
② 分子间脱水(取代反应):CSOH O H H C O H C H OC H C ︒+--−−−−→−14025252425252浓乙醇在170℃和140℃都能脱水,这是由于乙醇分子中存在羟基的缘故。
在170℃发生的是分子内脱水,在140℃发生的是分子间脱水,说明外界条件不同时,脱水的方式不同,产物也不相同。
3. 乙醇的工业制法(1)发酵法:葡萄糖水解OH H C O H nC O H C n 5261265106)(→−−→−(2)乙烯水化法:===2CH 加热、加压催化剂OH CH CH OH H CH 232−−−−→−-+注:有机化学反应中除经常用催化剂外,有时用到的是加热、加压。
第二节 乙醇 醇类★第二课时[引言]我们知道,乙醇在日常生活中及工业生产中有非常广泛的用途,那么在工业上是如何制备的呢?请同学们阅读教材160页的有关内容后共同总结。
[板书]第二节 乙醇 醇类(二) 3.乙醇的工业制法 (1)乙烯水化法CH 2==CH 2+H 2O CH 3CH 2OH(2)发酵法[师]哪种方法更好?为什么?[生]乙烯水化法。
因为原料乙烯可大量取自石油裂解气,成本低,产量大,能节约大量粮食。
[过渡]前面我们学习的主要是乙醇,其实在有机物中还有很多结构、性质与乙醇很相似的物质,这就是醇类。
[板书]二、醇类[师]什么样的化合物叫做醇?[生]分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物,叫做醇。
[师]醇的官能团是什么? [生]羟基(—OH )。
[板书]1.概念:醇是分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物。
官能团都是—OH 。
[师]强调醇的概念中的“苯环侧链上的碳”这几个字。
[生]老师,在醇的概念中,为什么要强调羟基要连在苯环侧链上的碳上?[师]当烃基中有苯环时,羟基与苯环侧链上的碳相连的有机化合物才叫醇。
如果羟基与苯环上的碳直接相连,该有机化合物不属于醇类,而是属于以后我们将要学到的另一类烃的衍生物——酚。
[投影练习]下列有机化合物哪些属于醇类?答案:ACD[师]根据醇类的概念可知,醇中的烃基可以是饱和的,也可以是不饱和的;烃基中可以有苯环,也可以没有;羟基的数目可以是一个、两个或多个。
那么我们该如何给醇分类呢?[板书]2.分类[生]根据不同的分类方法,可分为不同的类别。
(1)根据醇分子中的羟基数目可分为:一元醇、二元醇和多元醇。
催化剂加热、加压(2)根据醇分子中的烃基是否饱和可分为:饱和醇和不饱和醇。
(3)根据醇分子中是否含有苯环,可分为:脂肪醇和芳香醇。
[板书](1)据含羟基数目 (2)据含烃基是否饱和(3)据烃基中是否含苯环[设问]醇的种类也如此繁多,我们又该如何给它命名呢? [板书]3.命名 [师]醇的命名和卤代烃的命名相似,只是羟基的位次是用阿拉伯数字标在取代基名称之后,主链名称之前,且主链应称某醇。
第二节乙醇醇类[课型]新课[目的要求]1、使学生掌握乙醇的主要化学性质。
2、使学生了解醇类的一般通性和几种典型醇的用途。
3、培养学生认识问题、分析问题、解决问题的能力。
[重点]乙醇的化学性质[难点]乙醇发生催化氧化及消去反应的机理。
[难点突破]通过对乙醇中存在化学键的分析,让学生理解乙醇发生催化氧化及消去反应时断键情况,举一反三,从而让学生掌握相关知识。
[课时安排]三课时[教学过程]第一课时[引入]利用前面所学知识,哪些方法可以制得乙醇?CH2=CH2+H2O CH3CH2OHCH3CH2Br+NaOH→CH3CH2OH+NaBr一、乙醇(展示样品后归纳物理性质)官能团:—OH1、物理性质:无色透明,具有特殊气味的液体,易挥发,能与水以任意比互溶,并能够溶解多种有机物。
用途:做燃料、饮料、香精、染料等,医疗上用75%的酒精作消毒剂。
[设问]酒的度数是如何衡量的?啤酒中含酒精3%~5%,葡萄酒含酒精6%~20%,黄酒含酒精8%~15%,白酒含酒精50%~70%(体积分数)[课堂练习]①若要检验酒精中是否含有少量水,可选用的试剂是:A、生石灰B、金属钠C、浓硫酸D、无水硫酸铜②制取无水酒精时,通常需向工业酒精中加入下列物质,并加热蒸馏,该物质是:A、无水硫酸铜B、浓硫酸C、新制的生石灰D、碳化钙2、乙醇的分子结构:可以看作乙烷分子中的一个氢原子被羟基(—OH)取代后的产物。
H H分子式:C2H6O 结构式:H—C—C—OH 结构简式:CH3CH2OH 或C2H5OH H H H H电子式:H∶C∶C∶O∶HH H[讨论]乙醇是极性分子还是非极性分子?乙醇溶于水后所得溶液是否导电?为什么?极性分子,溶于水是因为相似相溶;不导电,因乙醇是非电解质。
3、化学性质:①与钠的反应(实验6-2)注:只能用无水乙醇,否则是水与钠反应,而非乙醇。
现象:试管内钠粒沉于液态无水乙醇底部,有无色气泡在钠粒表面产生后逸出,液体仍为无色;反应放出的气体可在空气中安静地燃烧,火焰呈淡蓝色;烧杯壁上有水滴生成,而且加入烧杯中的澄清的石灰水不变浑浊,说明反应生成的气体是氢气。