手性化合物
- 格式:ppt
- 大小:289.00 KB
- 文档页数:11



手性物质提取分离手性药物的结晶拆分方法:手性化合物的拆分是给外消旋混合物制造一个不对称的环境,使两个对映异构体能够分离开来。
从方法学上来讲,可以分为结晶拆分法(物理拆分方法、化学拆分方法)、动力学拆分方法、生物拆分方法(相当部分是生物催化的动力学拆分)及色谱拆分方法。
--手性药物的拆分方法—1、结晶拆分法--直接结晶法---在光学活性溶剂中的结晶拆分--直接结晶法---外消旋体的不对称转化和结晶拆分--直接结晶法---逆向结晶法逆向结晶法则是在外消旋体的饱和溶液中加入可溶性某一种构型的异构体[如(R)—异构体],添加的(R)—异构体就会吸附到外消旋体溶液中的同种构型异构体结晶体的表面,从而抑制了这种异构体结晶的继续生长,而外消旋体溶液中相反构型的(S)—异构体结晶速度就会加快,从而形成结晶析出。
--直接结晶法---优先结晶法优先结晶方法(preferential crystallization)是在饱和或过饱和的外消旋体溶液中加入一个对映异构体的晶种,使该对映异构体稍稍过量因而造成不对称环境,结晶就会按非稍的过程进行,这样旋光性与该晶种相同的异构体就会从溶液中结晶出来。
--直接结晶法---自发结晶拆分法自发结晶拆分(spontaneous resolution)是指当外消旋体在结晶的过程中,自发的形成聚集体。
--通过形成非对映异构体的结晶法--非对映异构体的形成和拆分原理--通过形成非对映异构体的结晶法--用于碱拆分的拆分试剂(酸性拆分剂)2、动力学拆分化反应,分离方法直接。
的衍生化试剂具有良好的对热及水的稳定性。
局限性色谱柱价格昂贵,部分固定相还存在稳定性差,柱容量低,柱强度差等缺点,且根据不同手性药物的性质不同,选用的分析方法也不同。
系统平衡时间较长,添加剂消耗大,对于一些难分离的对映体效果差。
手性试剂需要有高的光学纯度,各对映体的衍生化速率及平衡常数应一致,要求衍生化反应迅速、彻底,否则影响定量结果。
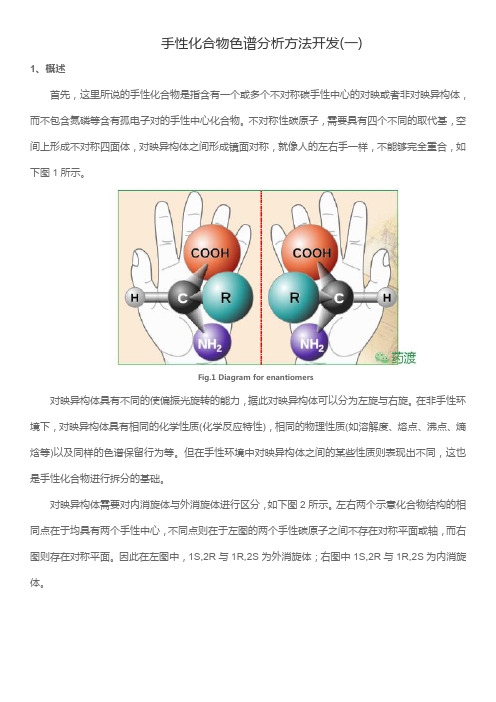
手性化合物色谱分析方法开发(一)1、概述首先,这里所说的手性化合物是指含有一个或多个不对称碳手性中心的对映或者非对映异构体,而不包含氮磷等含有孤电子对的手性中心化合物。
不对称性碳原子,需要具有四个不同的取代基,空间上形成不对称四面体,对映异构体之间形成镜面对称,就像人的左右手一样,不能够完全重合,如下图1所示。
Fig.1Diagram for enantiomers对映异构体具有不同的使偏振光旋转的能力,据此对映异构体可以分为左旋与右旋。
在非手性环境下,对映异构体具有相同的化学性质(化学反应特性),相同的物理性质(如溶解度、熔点、沸点、熵焓等)以及同样的色谱保留行为等。
但在手性环境中对映异构体之间的某些性质则表现出不同,这也是手性化合物进行拆分的基础。
对映异构体需要对内消旋体与外消旋体进行区分,如下图2所示。
左右两个示意化合物结构的相同点在于均具有两个手性中心,不同点则在于左图的两个手性碳原子之间不存在对称平面或轴,而右图则存在对称平面。
因此在左图中,1S,2R与1R,2S为外消旋体;右图中1S,2R与1R,2S为内消旋体。
Fig.2Name and distinguish between mesomer and racemate对于手性化合物的拆分,规模比较大的时候,可使用其他手性试剂(如酒石酸钠)与待拆分的化合物形成非对映异构体,然后根据非对映异构体之间具有不同的物理化学性质,进行相应的分离单元操作。
而在分析实验室中,一般是采用色谱法进行拆分,其中包括使用手性固定相法以及在流动相中添加手性流动相形成手性拆分环境的方式。
其中手性固定相拆分法包括气相色谱以及液相色谱。
对于气相色谱拆分手性化合物,其拆分选择性主要取决于所使用的手性固定相的种类以及色谱分离的温度。
一般气相用于低沸点的手性化合物的拆分,对于有机酸碱等极性手性化合物的拆分,一般需要先进行柱前衍生化处理,使之形成相应的酯或者酰胺。
用于气相手性拆分的手性固定相均为环糊精衍生物类,包括β以及γ环糊精,α环糊精比较少;其最高耐受温度不会超过220℃,而且分离温度超过120℃的时候,固定相的手性选择性开始降低;超过200℃的时候,固定相的手性选择性几近与无。


有机化学中的手性分离技术有机化学是研究有机物质的性质、结构和反应规律的学科,而手性分离技术是有机化学中的重要分支之一。
手性分离技术主要用于分离和纯化手性化合物,手性化合物是指分子或离子不具有镜像对称性的化合物。
手性化合物在自然界中广泛存在,例如生物体内的氨基酸、糖类、核酸等,它们的手性结构对于生物活性和药理活性具有重要影响。
因此,手性分离技术在医药、农药、食品、香料等领域具有广泛的应用前景。
手性分离技术的发展经历了多个阶段。
最早的手性分离方法是通过晶体生长实现的,例如拉斯克结晶法和对映体结晶法。
这些方法通过调节晶体生长条件,使得晶体中只含有一种手性的分子,从而实现手性分离。
然而,这些方法的操作复杂且效率低下,限制了其在工业生产中的应用。
随着科学技术的不断进步,许多新的手性分离技术被开发出来。
其中最常用的是手性色谱技术。
手性色谱是利用手性固定相与手性化合物之间的相互作用进行分离的方法。
手性固定相通常是通过在固定相上修饰手性配体或手性聚合物来实现的。
手性色谱技术具有分离效果好、选择性高、操作简便等优点,已成为手性分离的主要方法之一。
此外,手性电泳也是一种常用的手性分离技术。
手性电泳是利用手性电泳介质和电场作用下的分子迁移速度差异进行分离的方法。
手性电泳技术具有分离速度快、灵敏度高、分离效果好等特点,广泛应用于药物研发、食品分析等领域。
除了手性色谱和手性电泳,还有一些其他的手性分离技术被广泛研究和应用。
例如手性萃取、手性膜分离、手性固相萃取等。
这些技术在手性分离领域发挥着重要作用,为研究人员提供了多种选择。
手性分离技术的发展不仅推动了有机化学领域的进步,也为药物研发、食品安全等领域提供了有力支持。
然而,目前仍然存在一些挑战和问题。
例如,手性分离技术的选择性和效率有待进一步提高,某些手性化合物的分离仍然困难。
此外,一些手性分离技术的操作复杂、设备昂贵,限制了其在工业生产中的应用。
因此,未来的研究方向之一是开发更高效、更具选择性的手性分离技术。
有机化学基础知识点整理立体异构与手性化合物有机化学基础知识点整理立体异构与手性化合物介绍:有机化学是研究有机物的结构、性质和反应的学科。
其中,立体异构与手性化合物是有机化学中的重要概念。
本文将为您整理基础的有机化学知识点,重点探讨立体异构和手性化合物。
一、立体异构1.1 定义立体异构是指分子的空间结构相同,但是在立体构型方面存在不同的化学物质。
即同一分子式的化合物,其空间结构不同,化学性质和物理性质也会相应变化。
1.2 分类1.2.1 构型异构构型异构是指分子内部原子的排列方式不同,导致空间结构也不同。
主要有以下几种形式:1.2.1.1 同分异构同分异构是指同种原子通过共价键连接,在排列或转动时可形成不同的构型。
如顺反异构、轴官能团异构等。
1.2.1.2 二面角异构二面角异构是指由于碳链之间存在着特定的旋转角度,分子在空间中不同部位产生不同构型的异构体。
如转平面异构。
1.2.2 空间异构空间异构是指构成分子的原子的连接方式不同,导致分子空间结构不同,无法通过旋转或转动使其重合。
主要有以下几种形式:1.2.2.1 键位置异构键位置异构是指在分子中,原子的连接方式或位置不同,导致分子的空间结构也会不同。
如环异构。
1.2.2.2 空间位阻异构空间位阻异构是指分子内部的原子或官能团由于空间位阻的影响,影响了分子的空间构型,从而导致异构体的产生。
二、手性化合物2.1 定义手性化合物是指分子或物体不重合与其镜像体的物质。
手性化合物包括手性立体异构体和不对称分子。
2.2 手性中心手性中心是指分子中一个碳原子与四个不同基团连接。
手性中心是产生手性的必要条件。
根据手性中心的性质,分子可以分为两种类型:2.2.1 单手性中心单手性中心的分子有两个镜像异构体,即L体和D体。
2.2.2 多手性中心多手性中心的分子有2的n次方个立体异构体,其中n为手性中心的个数。
2.3 光学异构体光学异构体是指由于手性中心的存在而产生的非重合的光学异构体。
手性化合物的拆分方法
手性化合物的拆分方法主要有对映体分离法和酶催化法两种。
对映体分离法是指通过物理或化学方法将手性化合物中的对映体分离开来。
常用的物理方法有晶体分离法和对映体选择性结晶法。
晶体分离法是指利用手性化合物结晶时的差异,通过适当的选择溶剂和结晶条件,使其中一个对映体结晶出来,而另一个对映体仍保持在溶液中。
对映体选择性结晶法则是利用对映体结晶时晶体生长速度的差异,通过选择合适的溶液浓度和温度,使其中一个对映体的晶体生长速度比另一个对映体快,从而实现对映体的分离。
酶催化法是利用手性化合物和酶之间的反应性差异进行对映体分离的方法。
酶催化法主要通过酶的手性选择性来实现对映体的分离,其中最常用的是立体选择性催化酶。
这种酶具有对手性底物具有高选择性催化作用的特点,通过调节反应条件和酶底物比例,可以将手性化合物中的对映体分离开来。
除了以上的方法,还有一些其他的手性化合物拆分方法,如手性色谱法、手性电泳法、手性转换法等。
这些方法则是通过物理、化学或生物学手段对手性化合物进行选择性的分离和转化,以实现对映体的分离。
有机化学的手性分析方法
在有机化学领域中,手性分析是一项十分重要的工作。
手性化合物是指分子的结构镜像不能完全重合的分子。
因此,手性分析的目的就是确定有机化合物中手性中心的配置。
在本文中,将介绍几种常用的手性分析方法。
一、圆二色谱分析法
圆二色谱分析法是一种利用圆二色现象测定有机物的手性的方法。
圆二色现象是指左旋光和右旋光通过具有手性的物质后,光传播方向不变,但相位差发生变化的现象。
通过观察物质在不同波长下的圆二色光谱,可以确定其手性。
二、红外吸收光谱分析法
红外吸收光谱分析法是一种常用的手性分析方法。
在红外光谱中,手性物质通常表现出特定的旋光效应,通过比较旋光贡献可以判断有机物的手性。
三、核磁共振分析法
核磁共振分析法是一种非常重要的手性分析方法。
通过核磁共振技术,可以观察到手性物质中的不对称中心周围原子核的信号差异,从而确定有机物的手性。
四、质谱分析法
质谱分析法是一种高灵敏度的手性分析方法。
通过质谱仪对有机物进行分析,可以观察到手性分子离子的不同质量谱峰,从而确定有机物的手性。
五、氨基酸序列分析法
氨基酸序列分析法主要用于蛋白质的手性分析。
通过氨基酸序列分析仪,可以确定蛋白质中的手性氨基酸的排列顺序,从而确定蛋白质的整体手性。
综上所述,有机化学的手性分析方法主要包括圆二色谱分析法、红外吸收光谱分析法、核磁共振分析法、质谱分析法以及氨基酸序列分析法。
这些方法各自有其优点和适用范围,科学家们可以根据具体情况选择合适的手性分析方法来进行研究。
在有机合成中产生手性化合物的方法有4种:1.使用手性的底物2.使用手性助剂3.采用手性试剂4.使用不对称催化剂常常需要使用天然产物,如:氨基酸、生物碱、羟基酸、萜、碳水化合物、蛋白质等。
1.使用手性的底物这种方法局限于比较有限的天然底物如图,该化合物的硼氢化反应中,由于羟基的作用产生另外新的立体中心(反应从分子的背后发生)以下两个反应,第一个是由于羧基的控制得到相应的手性产物..另一个则是由于反应中间体烯醇阴离子的构象决定了构型2.使用手性助剂如图,在第一步使用LDA去质子化时,为了使得上边的醇锂和下边的烯醇锂相距最远,Z-异构体占优势,在下一步与EtI的反应中得以产生了立体中心。
类似地,用烯醇锆替代烯醇锂(使用LDA,ZrCp2Cl2)确保烯醇的构型,再和醛反应产生不对称中心。
这些反应多数通过手性助剂的金属原子和底物中已有手性的O、N等原子络合,之后再加入其他试剂实现不对称中心的形成。
这其中手性唑啉环是一个非常不错的手性助剂,它水解后可以生成一个羧基(潜在官能团)另外一个试剂是手性的3-烷基哌嗪-2,5-二酮(一个环状二肽,可由两个氨基酸环合生成),如图在羰基的α位进行不对称烷基化使用的是以下两种试剂A和B(B称为SAMP),如图,对环己酮的反应中采用A得到S异构体而采用B得到R异构体.在氨基的α位进行不对称烷基化使用的试剂如下二图,用胺和它们作用后再用LDA、MeI甲基化,最后用N2H4脱去助剂得到产物.还有一些有趣的反应如脯氨酸的α烷基化,涉及到一个立体化学的"存储"问题,经历了一个消失和再产生的过程::手性亚砜的作用:分离得到手性亚砜试剂和卤代烷作用后在下一步反应中诱导手性基团的产生,Al/Hg可以方便地除去亚砜基团。
3.采用手性试剂通过铝锂氢化物与手性二胺或氨基醇作用可以得到一个用于不对称还原的试剂。
如图。
利用α-蒎烯和9-BBN作用得到的试剂是一个很好的不对称还原试剂.如图不对称硼氢化反应也是一个很好的构造立体化学中心的反应。