最新有机化学(手性碳原子化合物)
- 格式:ppt
- 大小:338.50 KB
- 文档页数:14

有机化学的手性合成方法研究手性合成是有机化学中令人着迷的领域之一。
手性化合物是指具有非对称碳原子的化合物,其与镜像异构体非重合且不可重叠。
由于手性化合物在生物学、医药学和材料科学等领域具有重要的应用价值,研究人员一直致力于寻找高效可行的手性合成方法。
本文将就目前常用的手性合成方法进行介绍。
一、非手性催化剂手性诱导合成法非手性催化剂手性诱导合成法是通过添加手性诱导剂来使反应过程中形成手性产物。
手性诱导剂可以是手性分子或手性配体,通过与反应物形成稳定的间接或直接化学键,使手性诱导剂的手性信息转移到合成物中。
这种方法相对简单易行,广泛应用于大量手性化合物的合成。
例如,通过采用金属催化剂和手性配体的催化剂手性诱导合成法,可以高选择性地合成手性化合物。
二、手性催化剂直接合成法手性催化剂直接合成法是指手性催化剂直接参与反应并介导反应进行。
手性催化剂可为有机分子、金属配合物或生物分子等,其结构对合成产物的手性选择性起着决定性作用。
这种方法具有高立体选择性和环境友好性等优点。
例如,通过采用手性膦化合物、手性有机胺、手性酸碱等作为手性催化剂,可以高效合成手性化合物。
三、手性晶体催化合成法手性晶体催化合成法是利用具有手性结构的晶体催化剂来促进手性化合物的合成。
手性晶体催化剂具有非常特殊的手性识别性能,可以在催化反应过程中引导产物形成特定的手性结构。
这种方法广泛应用于手性酮、手性醇等手性分子的合成。
例如,利用手性有机盐晶体或金属有机配合物晶体作为催化剂,可以实现多种手性化合物的合成。
四、手性固定相合成法手性固定相合成法是通过在固体表面修饰手性吸附剂,使反应物在固定相上发生手性选择性的反应。
手性固定相合成法具有高效、无需手性诱导剂和催化剂等优点。
例如,通过在固体表面修饰手性金属有机框架或手性多孔材料,可以实现手性分子的高选择性合成。
综上所述,有机化学的手性合成涉及多种方法,包括非手性催化剂手性诱导合成法、手性催化剂直接合成法、手性晶体催化合成法和手性固定相合成法等。

手性碳原子判断方法手性碳原子是有机化合物中非常重要的一种结构单元,它的存在使得有机分子具有了立体异构体。
在有机化学中,手性碳原子的判断方法是非常重要的,因为它关系到有机分子的立体结构和化学性质。
本文将介绍几种常用的手性碳原子判断方法,并对它们进行比较和分析。
一、手性碳原子的定义。
手性碳原子是指一个碳原子周围连接着四个不同的官能团或原子团,从而使得这个碳原子成为一个手性中心。
手性碳原子的存在使得有机分子具有了立体异构体,也就是说,它们的空间结构是不对称的,因此具有光学活性。
在有机化学中,手性碳原子的判断是非常重要的,因为它关系到有机分子的立体结构和化学性质。
二、手性碳原子的判断方法。
1. 观察分子结构。
最直接的方法就是观察分子的结构,如果一个碳原子周围连接着四个不同的官能团或原子团,那么这个碳原子就是手性碳原子。
这种方法简单直观,但是对于复杂的有机分子来说并不是很方便。
2. 使用手性试剂。
手性试剂是一种能够区分手性分子的试剂,它们通常是手性化合物,可以与手性分子形成不对称的反应产物。
通过使用手性试剂,可以判断一个分子中是否存在手性碳原子,以及手性碳原子的立体构型。
这种方法需要一定的实验条件和手性试剂,但是对于复杂的有机分子来说是非常有效的。
3. 使用X射线衍射。
X射线衍射是一种常用的结构分析方法,可以用来确定有机分子的空间结构。
通过X射线衍射,可以确定一个分子中各个原子的位置和空间构型,从而判断其中是否存在手性碳原子。
这种方法需要专门的仪器和条件,对于一般的有机化合物来说并不是很方便。
4. 使用核磁共振。
核磁共振是一种常用的谱学方法,可以用来确定有机分子的结构和构型。
通过核磁共振,可以确定一个分子中各个原子的位置和空间构型,从而判断其中是否存在手性碳原子。
这种方法需要专门的仪器和条件,对于一般的有机化合物来说比较方便。
三、手性碳原子判断方法的比较和分析。
从上面的介绍可以看出,手性碳原子的判断方法有多种,它们各有优缺点。


有机化学智慧树知到课后章节答案2023年下山东建筑大学第一章测试1.以下卤代烃中,碳卤键键长最长的是()。
A:R-Cl B:R-Br C:R-F D:R-I 答案:R-I2.碳原子有sp、sp2、sp3杂化轨道,s成分多的轨道,核对轨道中电子束缚得牢,则电负性大的轨道应该是()。
A:sp B:sp3 C:sp2 D:sp4答案:sp3.不同杂化类型碳的电负性不同,据此推断以下物质中C-H键键长最长的是()。
A:CH2=CH3 B:CH3CH3 C:C6H6D:CH≡CH 答案:CH3CH34.单纯考虑诱导效应,推断以下羧酸酸性最弱的为()。
A:乙酸 B:苯甲酸 C:硝基乙酸 D:氯乙酸答案:乙酸5.以下物质属于有机化合物的是()。
A:CO2 B:CH4 C:C D:NaCN 答案:CH46.预测下列化合物中水溶性最好的是()。
A:CH3CH2OH B:CH3CH2CH2CH2OHC:CH3CH2CH2CH2CH3 D:CH3CH2OCH2CH3答案:CH3CH2OH7.属于亲核试剂的是()。
A:AlCl3 B:CH3O- C:H+ D:+NO2答案:CH3O-8.以下关于共价键的说法不正确的是()。
A:根据重叠方式的不同,共价键可分为σ键和π键 B:共价键有饱和性 C:非极性分子中的共价键为非极性键D:共价键有方向性答案:非极性分子中的共价键为非极性键9.下列分子属于极性分子的是()。
A:C6H6 B:CH3OH C:CH3Cl D:Cl2E:CH3CH2OCH2CH3答案:CH3OH;CH3Cl;CH3CH2OCH2CH310.常见有机化合物的共性如()。
A:参加反应时,速率普遍很快 B:一般易溶于水 C:常具有挥发性 D:一般易燃烧答案:常具有挥发性;一般易燃烧第二章测试1.中,3号碳属于()。
A:3°碳 B:4°碳 C:仲碳 D:伯碳答案:3°碳2.属于()。

有机化学基础知识点整理立体异构与手性化合物有机化学基础知识点整理立体异构与手性化合物介绍:有机化学是研究有机物的结构、性质和反应的学科。
其中,立体异构与手性化合物是有机化学中的重要概念。
本文将为您整理基础的有机化学知识点,重点探讨立体异构和手性化合物。
一、立体异构1.1 定义立体异构是指分子的空间结构相同,但是在立体构型方面存在不同的化学物质。
即同一分子式的化合物,其空间结构不同,化学性质和物理性质也会相应变化。
1.2 分类1.2.1 构型异构构型异构是指分子内部原子的排列方式不同,导致空间结构也不同。
主要有以下几种形式:1.2.1.1 同分异构同分异构是指同种原子通过共价键连接,在排列或转动时可形成不同的构型。
如顺反异构、轴官能团异构等。
1.2.1.2 二面角异构二面角异构是指由于碳链之间存在着特定的旋转角度,分子在空间中不同部位产生不同构型的异构体。
如转平面异构。
1.2.2 空间异构空间异构是指构成分子的原子的连接方式不同,导致分子空间结构不同,无法通过旋转或转动使其重合。
主要有以下几种形式:1.2.2.1 键位置异构键位置异构是指在分子中,原子的连接方式或位置不同,导致分子的空间结构也会不同。
如环异构。
1.2.2.2 空间位阻异构空间位阻异构是指分子内部的原子或官能团由于空间位阻的影响,影响了分子的空间构型,从而导致异构体的产生。
二、手性化合物2.1 定义手性化合物是指分子或物体不重合与其镜像体的物质。
手性化合物包括手性立体异构体和不对称分子。
2.2 手性中心手性中心是指分子中一个碳原子与四个不同基团连接。
手性中心是产生手性的必要条件。
根据手性中心的性质,分子可以分为两种类型:2.2.1 单手性中心单手性中心的分子有两个镜像异构体,即L体和D体。
2.2.2 多手性中心多手性中心的分子有2的n次方个立体异构体,其中n为手性中心的个数。
2.3 光学异构体光学异构体是指由于手性中心的存在而产生的非重合的光学异构体。

有机化学(上)_天津大学中国大学mooc课后章节答案期末考试题库2023年1.有对称面和/或对称中心的分子无手性,没有对映异构现象。
答案:正确2.碳氧双键(C=O)伸缩振动在红外波谱中的特征频率出现在1600-1800【图片】答案:正确3.以下说法不符合【图片】反应机理的是()。
答案:有重排产物生成4.下列卤代烷在中性条件下水解时(【图片】机理),反应速度最快的是()答案:5.下列化合物中,具有手性的是[ ]。
答案:6.sp碳-氢(C-H)伸缩振动在红外波谱中的特征频率出现在3310-3320【图片】答案:正确7.与烯烃中【图片】碳相连的质子(R2C=CHR) 在【图片】中的化学位移是4.5-5.7。
答案:正确8.甲基自由基中碳原子外层共有7个电子,甲基自由基最可能的形状是[ ]。
答案:介于四面体和平面三角形之间9.下列化合物中,没有芳香性的是[]。
答案:10.含有5个碳原子的脂肪族烯烃的构造异构体共有几个?答案:611.下面哪个写法是不正确的?答案:12.下列述化合物在乙醇水溶液中放置,能形成酸性溶液?【图片】答案:正确13.在氯乙烷(【图片】)的【图片】波谱中,甲基的偶合裂分峰的数目为[ ]。
答案:314.下列化合物或离子中,有芳香性的是[]。
答案:15.下列化合物中,具有手性的是[]。
答案:16.在对有机化合物命名时,以下几种官能团较优先的是[]。
答案:17.下列化合物中芳环α-位质子酸性最强的是[]。
答案:18.下列化合物在进行一元溴化反应时,哪一个反应速度最慢?答案:19.下列几种试剂中,不能用于Friedel-Crafts烷基化反应的是[]。
答案:20.丙二烯分子是线形非平面分子。
答案:正确21.对于碳原子数相同的烯烃顺反异构体,顺式异构体的熔点比反式异构体略高。
答案:错误22.对于烯烃顺反异构体的两种标记法,顺即对应Z构型,反即对应E构型。
答案:错误23.下列化合物哪个不能使溴的四氯化碳溶液褪色?答案:24.下述反应的产物,哪一个是正确的?【图片】答案:25.关于下面化合物的系统名称,哪一个是正确的?【图片】答案:顺-4-甲基-2-戊烯26.下列丙烯醛的几种极限结构,哪个对共振杂化体的贡献最大?答案:27.下述反应属于哪一种类型的反应?【图片】答案:自由基加成反应28.下列烯烃用过氧酸氧化时,反应最容易进行的是哪一个?答案:29.下列哪个化合物酸性最强?答案:30.下列哪个化合物可作为双烯体进行Diels-Alder反应?答案:31.下列哪个自由基最稳定?答案:32.下列哪个碳正离子最稳定?答案:33.按次序规则,下列基团哪一个最优先?答案:34.下列分子中,分子不具有极性的是[ ].答案:35.正辛烷中碳原子的个数为[ ]答案:836.下述化合物中,自身分子间可以形成氢键的是[ ]答案:37.下列指定的碳氢键中,解离能最小的是[ ].答案:38.不查阅物理常数表,判定下列化合物中沸点最高的是[ ].答案:正癸烷39.下列取代基中,异丁基是[ ].答案:40.下列氟代芳烃与乙醇钠作用时,反应最容易的是()答案:41.甲基环丙烷与碘化氢发生反应时,最可能的产物是[ ].【图片】答案:42.卤素【图片】,【图片】 ,【图片】在与烷烃进行自由基卤化反应时,反应活性最高的是[ ].答案:43.氯苯用混酸在其邻位进行硝化反应时,其活性中间体(σ-络合物)可用以下几种极限结构的共振杂化体表示。

第九章有机化学基础第28讲有机化合物的结构特点与研究方法1.(2022·河北卷·2)茯苓新酸DM是从中药茯苓中提取的一种化学物质,具有一定生理活性,其结构简式如图。
关于该化合物,下列说法不正确的是( )。
A.可使酸性KMnO4溶液褪色B.可发生取代反应和加成反应C.可与金属钠反应放出H2D.分子中含有3种官能团答案:D解析:茯苓新酸DM分子中含有碳碳双键、羟基、羧基、酯基4种官能团,D错误;碳碳双键和其中一个羟基均可以与酸性KMnO4溶液发生氧化反应而使其褪色,A正确;碳碳双键可发生加成反应,羟基和羧基均可发生取代反应,B正确;羟基和羧基均可与金属钠反应放出H2,C正确。
2.(2021·浙江1月选考·5)下列表示正确的是( )。
A.甲醛的电子式B.乙烯的球棍模型C.2-甲基戊烷的键线式D.甲酸乙酯的结构简式CH3COOCH3答案:B解析: A项中氧原子周围没有满足8电子结构,A错误;C项中键线式表示的有机物的名称是3-甲基戊烷,C错误;D项中有机物的名称是乙酸甲酯,D错误。
3.(2023·辽宁沈阳质检)常温常压下,某金属有机多孔材料(MOFA)对CO2具有超高的吸附能力,并能催化CO2与环氧丙烷的反应,其工作原理如图所示。
下列说法错误的是( )。
A.物质a、b分子均只有一种官能团B.a生成b过程中C原子和O原子的杂化类型均未改变C.b 的一氯代物有 3种D.该材料的吸附作用具有选择性,利用此法有利于“碳达峰”目标的实现答案:B解析:a含有醚键,b含有酯基,均只有一种官能团,A正确;a分子中C、O原子价层电子对数都是4,C、O原子杂化类型为sp3,b分子中成单键的C原子和两个成单键的O原子价层电子对数都是4,杂化类型为sp3,成C O键的C、O原子杂化类型为sp2,B错误;b中含有3种等效氢,有几种等效氢,其一氯代物就有几种,所以b的一氯代物有3种,C正确;MOFA对CO2具有超高的吸附能力,能选择性地吸附 CO2,并能催化CO2与环氧丙烷反应生成b,所以利用此法可减少CO2的排放,有利于“碳达峰”目标的实现,D正确。


有机化学中的手性化合物合成手性化合物是指具有非对称碳原子的有机分子,它们的镜像异构体无法通过旋转或平移相互重叠。
手性化合物在生物学、医药学和材料科学等领域具有重要的应用价值。
因此,手性化合物的合成研究一直是有机化学的热点之一。
手性化合物的合成方法多种多样,其中最常用的方法是手性诱导合成。
手性诱导合成是通过引入手性辅助剂或手性催化剂来实现手性化合物的合成。
这种方法的优点是反应条件温和,产率高,选择性好。
手性辅助剂可以通过与底物形成手性中间体,然后再通过去除手性辅助剂来得到手性产物。
手性催化剂则是通过催化剂与底物之间的手性识别来实现手性化合物的合成。
另一种常用的手性化合物合成方法是不对称合成。
不对称合成是通过选择性反应、不对称催化剂或不对称试剂等手段来实现手性化合物的合成。
选择性反应是指在合成过程中,通过调节反应条件和反应物的比例,使得反应只在特定的位置或特定的立体异构体上发生。
不对称催化剂则是指通过选择性催化剂来实现手性化合物的合成。
不对称试剂则是指通过选择性试剂来实现手性化合物的合成。
此外,手性化合物的合成还可以通过手性分离来实现。
手性分离是指将手性化合物中的两个对映异构体分离开来。
常用的手性分离方法包括晶体分离、色谱法和电泳法等。
晶体分离是指通过晶体生长的方法将手性化合物中的两个对映异构体分离开来。
色谱法是指通过在手性色谱柱上进行分离来实现手性化合物的分离。
电泳法是指通过在手性电泳胶上进行分离来实现手性化合物的分离。
在有机化学中,手性化合物的合成是一个复杂而有挑战性的过程。
合成手性化合物需要克服立体障碍,控制反应条件和选择合适的合成方法。
同时,手性化合物的合成也需要考虑到环境友好性和经济性等因素。
因此,有机化学家们在手性化合物的合成研究中不断探索新的方法和策略。
总之,有机化学中的手性化合物合成是一个重要的研究领域。
通过手性诱导合成、不对称合成和手性分离等方法,有机化学家们可以合成出各种各样的手性化合物。
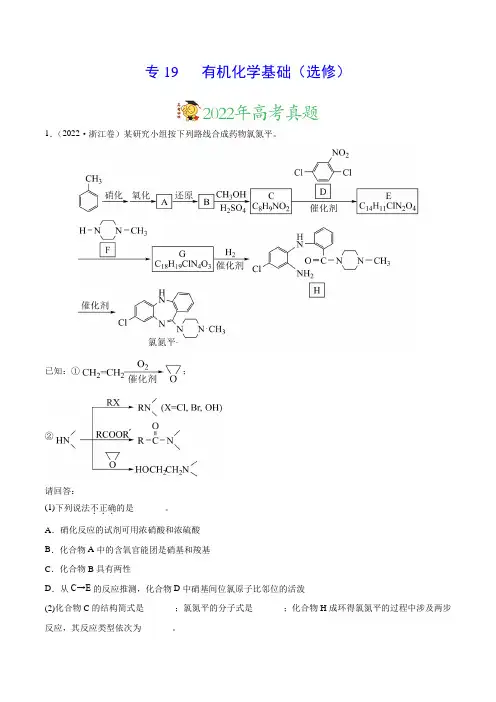
专19 有机化学基础(选修)1.(2022·浙江卷)某研究小组按下列路线合成药物氯氮平。
已知:①;②请回答:(1)下列说法不正确...的是_______。
A.硝化反应的试剂可用浓硝酸和浓硫酸B.化合物A中的含氧官能团是硝基和羧基C.化合物B具有两性D.从C→E的反应推测,化合物D中硝基间位氯原子比邻位的活泼(2)化合物C的结构简式是_______;氯氮平的分子式是_______;化合物H成环得氯氮平的过程中涉及两步反应,其反应类型依次为_______。
(3)写出E→G 的化学方程式_______。
(4)设计以22CH =CH 和32CH NH 为原料合成的路线(用流程图表示,无机试剂任选)_______。
(5)写出同时符合下列条件的化合物F 的同分异构体的结构简式_______。
①1H-NMR 谱和IR 谱检测表明:分子中共有3种不同化学环境的氢原子,有N-H 键。
②分子中含一个环,其成环原子数4≥。
2.(2022·广东卷)基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。
以化合物I 为原料,可合成丙烯酸V 、丙醇VII 等化工产品,进而可制备聚丙烯酸丙酯类高分子材料。
(1)化合物I 的分子式为_______,其环上的取代基是_______(写名称)。
(2)已知化合物II 也能以II′的形式存在。
根据II′的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。
序号 结构特征 可反应的试剂 反应形成的新结构 反应类型 ① CH CH -=-2H 22CH CH ---加成反应 ② _______ _______ _______ 氧化反应 ③____________________________(3)化合物IV 能溶于水,其原因是_______。
(4)化合物IV 到化合物V 的反应是原子利用率100%的反应,且1mol IV 与1mol 化合物a 反应得到2mol V ,则化合物a 为_______。

手性有机化合物的合成及应用研究手性有机化合物是一类在有机化学中具有重要地位的化合物。
手性分子是指具有非对称碳原子的有机分子,它们的镜像异构体之间无法通过旋转或平移互相重叠。
手性有机化合物的合成及应用研究在现代有机合成领域具有广泛的研究价值和应用前景。
手性有机化合物的合成方法主要有两种:对映选择性合成方法和手性分离方法。
对映选择性合成方法是通过特定的反应条件和手性催化剂控制对映体生成的方法。
其中最常用的方法之一是外消旋合成法,即使用具有手性诱导剂的反应物与不对称的试剂进行反应。
通过这种方法,可以有效地控制手性产物的对映选择性,实现对目标手性分子的合成。
手性分离方法是一种通过物理或化学手段将对映体分离的方法。
手性分离方法让科学家能够研究单个手性体的性质和特性。
其中,手性产物结晶法是最常用的手性分离方法之一。
通过适当选择溶剂和结晶条件,可以使得不同对映体的产物结晶速率和溶解度产生差异,从而实现对手性产物的分离。
手性有机化合物在药物合成、农药合成以及化妆品等领域具有重要的应用价值。
手性药物是利用手性有机化合物的对映选择性合成而成的药物。
研究表明,手性药物的对映体之间常常具有不同的药理和毒理效应,其中一种对映体可能具有疗效,而另一种可能具有毒副作用。
因此,对于手性药物的合成及研究具有重要的意义。
手性有机化合物还在不对称催化反应中得到广泛应用。
不对称催化反应是一种能够高选择性合成手性有机化合物的合成方法。
通过选择合适的手性催化剂,可以实现对手性碳原子进行高度选择性的转化。
这种合成方法能够使得手性有机化合物的产率和对映选择性得到很好地控制。
此外,手性有机化合物还在材料科学、光电子学、有机合成催化剂等领域得到广泛的应用。
例如,手性有机化合物可以作为荧光探针用于生物成像和细胞测量,也可用于制备手性识别片进行高选择性和灵敏的分离等。
总而言之,手性有机化合物的合成及应用研究在化学领域具有重要地位和应用前景。
通过对手性化合物的合成和研究,我们能够更好地理解其性质和特性,并且开发出更多具有应用价值的手性化合物。
《有机化学》(第五版,李景宁主编)习题答案 第五章2、写出顺-1-甲基-4-异丙基环己烷的稳定构象式。
CH 3HCH(CH 3)23)2H HH 3C稳定构象4、写出下列的构造式(用键线式表示)。
(1)1,3,5,7-四甲基环辛四烯 (3) 螺[5,5]十一烷5、命名下列化合物(1)反-1-甲基-3乙基环戊烷 (2)反-1,3-二甲基-环己烷 (3)2,6-二甲基二环[2,2,2]辛烷 01(4)1,5-二甲基-螺[4,3]辛烷 6、完成下列反应式。
(2)C=CH 2CH 3KMnO 4COCH3+ CO 2(3)Cl 300CCl(4)(6)(7)+ClCl(10)(11)Br2/CCl4CH2CH2CHCH38、化合物物A分子式为C4H8,它能是溴溶液褪色,但不能使烯的高锰酸钾溶液褪色。
1mol (A)与1molHBr作用生成(B),(B)也可以从(A)的同分异构体(C)与HBr作用得到。
化合物物(C)能使溴溶液褪色,也能使烯的高锰酸钾溶液褪色。
试推论化合物(A)、(B)、(C)的构造式,并写出各步的反应式。
答:根据化合物的分子式,判定A是烯烃或单环烷烃9、写出下列化合物最稳定的构象式。
(1)反-1-甲基-3-异丙基环己烷HH 3)2|CH 3(2) 顺-1-氯-2-溴环己烷第六章 对映异构2、判断下列化合物哪些具有手性碳原子(用 * 表示手性碳原子)。
哪些没有手性碳原子但有手性。
(1)BrCH 2-C *HDCH 2Cl 有手性碳原子(3)**Br OH有手性碳原子(8)CH=CH-CH=CH 2无手性碳原子,无手性(10没有手性碳原子,但有手性5、指出下列构型式是R 或S 。
6、画出下列化合物所有可能的光学异构体的构型式,标明成对的对映体和内消旋体,以R 、S 标定它们的构型。
(2)CH 3CHBrCHOHCH 3Br Cl(5)H2C CHCl H27、写出下列各化合物的费歇尔投影式。
有机化学中的手性化合物和不对称合成有机化合物是由碳和氢元素组成的化合物,其中的碳原子具有四个价电子,可以形成四个共价键。
由于碳原子的特殊性质,它可以与其他原子或基团形成多样的化学键,从而形成各种不同类型的化合物。
在有机化学中,手性化合物和不对称合成是一类重要的研究领域。
手性化合物是指化学结构中具有非对称碳原子的化合物,具有镜像对称性,但不能通过旋转使两者完全重合。
在自然界中,存在大量的手性化合物,例如氨基酸、糖类和天然药物等。
由于手性化合物的特殊性质,它们在生物学、药学和农学等领域具有广泛的应用价值。
手性化合物的不对称合成是指通过有机合成方法制备手性化合物的过程。
在有机合成中,控制手性的来源通常是由手性试剂或催化剂引入。
其中,手性试剂是指具有手性结构的化合物,可以通过与底物反应形成手性产物。
而手性催化剂是指具有手性结构的催化剂,在化学反应中可以选择性地引入手性。
不对称合成方法有很多种,其中一种常用的方法是手性诱导反应。
手性诱导反应是指通过手性试剂或手性催化剂引发的反应,使底物得到手性产物。
在手性诱导反应中,手性诱导剂通过与底物发生相互作用,改变反应的立体选择性,从而得到手性产物。
另一种常用的方法是手性配体催化反应。
手性配体催化反应是指利用手性配体催化剂引导的反应。
手性配体催化剂具有特殊的结构,可以与底物形成稳定的配位键,从而在反应中引入手性。
通过合理设计手性配体催化剂,可以实现对底物的高度立体选择性控制。
除了手性诱导反应和手性配体催化反应,还有一些其他方法用于不对称合成,如酶催化反应、金属有机化学反应和催化剂设计等。
这些方法在不对称合成领域发挥着重要的作用,为合成手性化合物提供了多样化的策略。
手性化合物和不对称合成在药学领域具有重要意义。
根据研究表明,手性化合物和非手性化合物在生物活性和药理活性方面具有显著差异。
同一化学结构的手性异构体往往具有不同的生物活性,这也是为什么同一化学结构的手性药物和非手性药物在临床上表现出不同疗效的原因之一。
手性碳手性碳原子定义:人们将连有四个不同基团的碳原子形象地称为手性碳原子(常以*标记手性碳原子)。
举例:手性碳原子存在于许多有机化合物中特别是和生命现象有关的有机化合物中。
例如:葡萄糖、果糖、乳酸等。
判断方法:1、手性碳原子一定是饱和碳原子;2、手性碳原子所连接的四个基团要是不同的。
手性碳原子的化学性质:旋光性:分子的化学结构决定其是否有手性。
在有机化合物中,手性分子大多数都含有手性碳原子,所以,一般来说,可以通过判断分子是否有手性碳原子来断定分子是否有手性。
含有一个手性碳原子的分子一定是个手性分子。
一个手性碳原子可以有两种构型,所以,含有一个手性碳原子的化合物有两种构型不同的分子,它们组成一对对映异构体,一个使偏振光右旋,另一个使偏振光左旋。
因有手性碳原子的存在而存在光学异构体。
手性碳的旋光性:为什么有*C原子就可能具有旋光性这是因为:(1)一个*C就有两种不同的构型:(2)二者的关系:互为镜象(实物与镜象关系,或者说左,右手关系).二者无论如何也不能完全重叠.与镜象不能重叠的分子,称为手性分子.分子的构造相同,但构型不同,形成实物与镜象的两种分子,称为对映异构体(简称:对映体).对映体:成对存在,旋光能力相同,但旋光方向相反.二者能量相同(分子中任何两原子的距离相同).判断一个化合物是不是手性分子,一般可考查它是否有对称面或对称中心等对称因素.而判断一个化合物是否有旋光性,则要看该化合物是否是手性分子.如果是手性分子,则该化合物一定有旋光性.如果是非手性分子,则没有旋光性.所以化合物分子的手性是产生旋光性的充分和必要的条件.2,对称因素:(1). 对称面把分子分成互为实物和镜像关系两半的假想平面,称为对称面.(2). 对称中心分子中任意原子或原子团与P点连线的延长线上等距离处,仍是相同的原子或原子团时,P点就称为对称中心.(3). 对称轴以设想直线为轴旋转360./ n,得到与原分子相同的分子,该直线称为n 重对称轴(又称n阶对称轴).(4). 交替对称轴(旋转反映轴)结论:A.有对称面,对称中心,交替对称轴的分子均可与其镜象重叠,是非手性分子;反之,为手性分子至于对称轴并不能作为分子是否具有手性的判据.B.大多数非手性分子都有对称轴或对称中心,只有交替对称轴而无对称面或对称中心的化合物是少数.∴既无对称面也没有对称中心的,一般可判定为是手性分子.旋光性19世纪后半叶,化学家们发现了一种特别奇妙的同分异构现象,后来证明,这种现象在生命化学中是极其重要的。
有机化学基础知识点整理立体化学中的手性合成方法有机化学基础知识点整理——立体化学中的手性合成方法在有机化学中,手性合成是一项重要的研究领域。
手性分子是具有不对称碳原子的化合物,由于其立体异构体之间在化学性质和生物活性方面的差异,手性合成成为了现代有机合成的关键领域之一。
本文将介绍几种常见的立体化学中的手性合成方法。
一、外消旋剂法外消旋剂法是一种通过添加外消旋剂来进行手性合成的方法。
该方法的基本原理是将外消旋剂与反应物发生反应,形成二级中心的消旋产物,然后通过对消旋产物进行选择性还原或者氧化等操作,制备出手性化合物。
例如,我们常用的外消旋剂-氨莎(dl-苯丙酮),可以通过与胺反应、还原、选择性氧化等步骤实现手性合成。
二、手性诱导法手性诱导法是利用手性诱导剂在反应中引入手性,使得反应生成手性产物的方法。
常用的手性诱导剂包括手性草酸、手性配体等。
手性诱导剂与反应物之间通过配位或者其他相互作用形成手性复合物,然后该复合物在反应中发挥作用,使得所得产物也具有手性。
例如,采用手性草酸作为手性诱导剂,可以通过与酮类或醛类反应,形成具有手性的醇类产物。
三、手性催化剂法手性催化剂法是利用手性催化剂在反应中引入手性,实现手性合成的方法。
手性催化剂主要包括手性草酸酯、手性金属配合物等。
催化剂与反应物形成手性复合物,然后该复合物通过催化剂的作用,促使反应进行,并最后生成手性产物。
例如,采用手性铯盐催化剂进行不对称酮的还原,可以得到具有手性的醇产物。
四、手性模板法手性模板法是将手性化合物作为模板,在一定条件下进行反应,从而合成具有手性的产物的方法。
手性模板在反应中起到模板作用,能够选择性地促使特定的反应发生,从而得到手性产物。
例如,通过选择性地使用具有手性模板的化合物,可以实现补体选择性环化反应,得到手性环化产物。
总结:手性合成是有机化学中重要的研究领域,通过外消旋剂法、手性诱导法、手性催化剂法和手性模板法等多种手性合成方法,可以制备出具有不对称碳原子的手性化合物。
《有机化学》(第五版,李景宁主编)习题答案 第一章3、指出下列各化合物所含官能团的名称。
(1) CH 3CH=CHCH 3 答:碳碳双键 (2) CH 3CH 2Cl 答:卤素(氯) (3) CH 3CHCH 3OH 答:羟基(4) CH 3CH 2 C=O 答:羰基 (醛基)H(5)CH 3CCH 3O答:羰基 (酮基)(6) CH 3CH 2COOH 答:羧基 (7)NH 2答:氨基(8) CH 3-C ≡C-CH 3 答:碳碳叁键4、根据电负性数据,用和标明下列键或分子中带部分正电荷和负电荷的原子。
答:6、下列各化合物哪个有偶极矩?画出其方向(1)Br 2 (2) CH 2Cl 2 (3)HI (4) CHCl 3 (5)CH 3OH (6)CH 3OCH 3 答:以上化合物中(2)、(3)、(4)、(5)、(6)均有偶极矩(2)H 2C Cl (3)I (4) Cl 3 (5)H 3COH(6)H3CCH 37、一种化合物,在燃烧分析中发现含有84%的碳[Ar (C )=12.0]和16的氢[Ar (H )=1.0],这个化合物的分子式可能是(1)CH 4O (2)C 6H 14O 2 (3)C 7H 16 (4)C 6H 10 (5)C 14H 22 答:根据分析结果,化合物中没有氧元素,因而不可能是化合物(1)和(2); 在化合物(3)、(4)、(5)中根据碳、氢的比例计算(计算略)可判断这个化合物的分子式可能是(3)。
第二章习题解答1、用系统命名法命名下列化合物 (1)2,5-二甲基-3-乙基己烷 (3)3,4,4,6-四甲基辛烷 (5)3,3,6,7-四甲基癸烷(6)4-甲基-3,3-二乙基-5-异丙基辛烷2、写出下列化合物的构造式和键线式,并用系统命名法命名之。
(3)仅含有伯氢和仲氢的C 5H 12答:符合条件的构造式为CH 3CH 2CH 2CH 2CH 3;键线式为; 命名:戊烷。