第三章 化学平衡(答案)
- 格式:pdf
- 大小:264.79 KB
- 文档页数:8

程兰征版物理化学习题解答3第三章 化学平衡1、气相反应:2SO 3(g)=2SO 2(g)+O 2(g)在1000K 时的平衡常数θc K =3.54×103,求该反应的θK (1000K)和θx K (1000K)。
解:第一问能做,第二问不能做(不知道系统总压)。
解答略。
2、氧化钴(CoO)能被氢或CO 还原为Co ,在721℃、101325Pa 时,以H 2还原,测得平衡气相中H 2的体积分数2H φ=0.025;以CO 还原,测得平衡气相中CO 的体积分数2H φ=0.0192。
求此温度下反应CO(g)+H 2O(g)=CO 2(g)+H 2(g) 的平衡常数θK 。
解:CoO(s) + H 2(g) = Co(s) + H 2O (1)0.025θp (1-0.025) θp390.025025.0-11==θK CoO(s) + CO(g) = Co(s) + CO 2 (2)0.0192θp (1-0.0192) θp510.01920192.0-12==θK (2)-(1)= CO(g)+H 2O(g)=CO 2(g)+H 2(g) ,所以θθθ123/K K K ==51/39=1.313、计算加热纯Ag 2O 开始分解的温度和分解温度。
(1)在101325Pa 的纯氧中;(2)在101325Pa 且2O φ=0.21的空气中。
已知反应2Ag 2O(s)=4Ag(s)+O 2(g)的)(T G m r θ∆=(58576-122T/K)J ·mol -1。
解:分解温度即标态下分解的温度。
令)(T G m r θ∆=(58576-122T/K)<0,得T >480K 开始分解温度即非标态下分解的温度。
令)(T G m r ∆=(58576-122T/K)+8.314×Tln0.21<0,得T >434K4、已知Ag 2O 及ZnO 在温度1000K 时的分解压分别为240及15.7kPa 。

第三章 化学平衡 练习参考答案1. 已知298.15K 时,反应H 2 (g)+21O 2 (g) ==== H 2O (g)的Δr G m o 为-228.57 kJ •mol -1。
298.15K 时水的饱和蒸气压为3.1663 kPa ,水和密度为997 kg •m -3。
求298.15K 反应H 2 (g)+ 21O 2 (g) ==== H 2O (l)的Δr G m o 。
解: 设计下列过程计算Δr G m o 。
ΔG 1 = -228.57 (kJ •mol -1)ΔG 2 =⎰21pp V d p = nRT ln12p p = 1×8.314×298.15×ln(3.1663/101.325) = -8591 ( J ) ΔG 3 = 0Δr G m o= ΔG 1 +ΔG 2 +ΔG 3=(-228.57) +(-8591×10-3) +0 = -237.17 (kJ •mol -1)2. 1000K 时,反应C (s)+ 2H 2 (g) ==== CH 4 (g)的Δr G m o 为19397 J •mol -1。
现有与碳反应的气体,其中含有CH 4 (g) 10%,H 2 (g) 80%,N 2 (g)10% (体积%)。
试问:(1) T =1000K ,p =101.325kPa 时,甲烷能否形成?(2) 在(1)的条件下,压力需加到若干,上述合成甲烷的反应才可能进行? 解: 体积分数等于物质的量分数,p B =x B p ,p = p o(1) Δr G m = Δr G m o + RT ln Q p = Δr G m o + RT ln2)/()/(24o H o CH p p p p=19397+ 8.314×1000×ln28.01.0=3963.7 (J •mol -1) Δr G m >0,甲烷不能形成。




第三章 化学反应速率和化学平衡习题3-1 什么是反应的速率常数?它的大小与浓度、温度、催化剂等因素有什么关系? 答:反应的速率大都可以表示为与反应物浓度方次的乘积成正比:υ=k·c α(A)·c β(B),式中比例常数k 就是速率常数。
速率常数在数值上等于反应物浓度均为1 mol·L -1时的反应速率。
k 的大小与反应物浓度无关,改变温度或使用催化剂会使速率常数k 的数值发生变化。
习题 3-2 什么是活化能?答:Arrhenius 总结了大量实验事实,提出一个经验公式:速率常数k 的对数与1/T 有线形关系:C TRE k a +⋅-=1ln 式中E a 就是活化能,它表示活化分子具有的最低能量与反应分子平均能量之差。
习题3-3 什么是催化剂?其特点有哪些?答:某些物质可以改变化学反应的速率,它们就是催化剂。
催化剂参与反应,改变反应历程,降低反应活化能。
催化剂不改变反应体系的热力学状态,使用催化剂同样影响正、逆反应的速率。
不影响化学平衡,只能缩短达到平衡的时间。
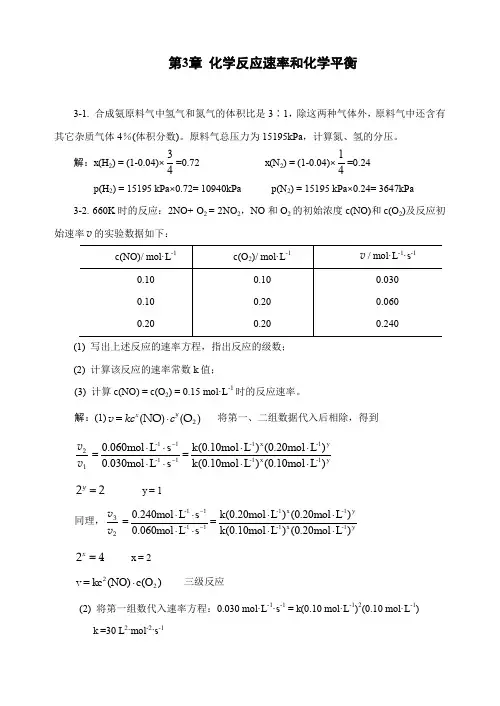
习题3-4 NOCl 分解反应为2NOCl→2NO+Cl 2实验测得NOCl 的浓度与时间的关系如下:t/s0 10 20 30 40 50 c (NOCl )/mol·L -12.001.420.990.710.560.48求各时间段内反应的平均速率;用作图法求t =25s 时的瞬时速率。
解:t=0-10s 时,1042.100.2-=∆∆=t c υ= 0.058mol·L -1·s -1 t=10-20s 时,102099.042.1--=∆∆=t c υ= 0.043mol·L -1·s -1 t=20-30s 时,203071.099.0--=∆∆=t c υ= 0.028mol·L -1·s -1 t=30-40s 时,304056.071.0--=∆∆=t c υ= 0.015mol·L -1·s -1 t=40-50s 时,405048.056.0--=∆∆=t c υ= 0.008mol·L -1·s -1 作图法略。

1物理化学第三章课后思考题一、选择题1. 在刚性密闭容器中,有下列理想气体的反应达到平衡 A(g) + B(g) =C(g) 若在恒温下加入一定量的惰性气体,则平衡将 ( )(A) 向右移动(B) 向左移动(C) 不移动(D) 无法确定2. 在 298 K 时,气相反应H 2+I 2=2HI 的Δr G m $=-16 778 J ⋅mol -1,则反应的平衡常数 K p $为: ( )(A) 2.0×1012 (B) 5.91×106 (C) 873 (D) 18.94. 已知反应 2NH 3= N 2+ 3H 2在等温条件下,标准平衡常数为 0.25,那么,在此条件下,氨的合成反应 (1/2) N 2+(3/2) H 2= NH 3 的标准平衡常数为: ( )(A) 4(B) 0.5(C) 2(D) 15. Ag 2O 分解可用下面两个计量方程之一表示,其相应的平衡常数也一并列出:Ag O s Ag s O g 22212()()()→+ K P ()1 2422Ag O s Ag s O g ()()()→+ K p()2 设气相为理想气体,且已知反应是吸热的,试判断下列结论哪个是正确的: ( )(A )K K P ()()2112= (B )K K p p ()()21= (C )K p ()2随温度的升高而增大 (D )O 2气的平衡压力与计量方程的写法无关6. Ag 2O 分解可用下列两个反应方程之一表示,其相应的平衡常数也一并列出 I. Ag 2O (s) 2Ag (s) + (1/2) O 2 (g) K p (Ⅰ) II. 2Ag 2O (s) 4Ag (s) + O 2 (g) K p (Ⅱ)设气相为理想气体,而且已知反应是吸热的,试问下列哪个结论是正确的:(A) K p (Ⅱ) = K p (Ⅱ)(B) K p (Ⅰ) = K p 2(Ⅱ)(C) O 2 气的平衡压力与计量方程的写法无关(D) K p (Ⅰ) 随温度降低而减小7. 某低压下的气相反应,在 T =200 K 时K p =8.314×102 Pa ,则K c /mol·cm -3是:( )(A) 5×102 (B) 14×106 (C) 14×103 (D) 0.58.理想气体反应CO g H g CH OH g ()()()+=223的r m ΔG $与温度T 的关系为:-1r m /J mol 2166052.92G ∆⋅=-+$(T /K),若使在标准状态下的反应向右进行,则应控制反应的温度: ( )(A )必须高于409.3 K (B )必须低于409.3 K(C )必须等于409.3 K (D )必须低于409.3 °C二、填空题9 在温度为2000 K 时,理想气体反应CO g O g CO g ()()()+=1222的-1r m 45817J mol G ∆=⋅$,则该反应的平衡常数K p = ()kPa -12。

第三章 化学平衡 思考题试答 2011.10.06.1.试述化学平衡的特征。
答:化学平衡的特征:① 正逆反应速率相等;② 宏观上反应物和产物浓度不再随时间变化;③ 化学平衡是有条件的动态平衡。
2.如何利用反应熵和标准平衡常数的相对大小预测反应的方向?答:当K >J 时正向,K <J 时逆向,K =J 时平衡。
3.何谓化学平衡移动?能使化学平衡发生移动的因素有哪些?其影响原因是否相同?答:化学平衡移动:当外界条件改变时,原来的化学平衡被破坏,直至在新的条件下又建立起新的平衡。
能使化学平衡发生移动的因素有:浓度、压力和温度。
它们的影响原因不尽相同:浓度、压力是通过改变J ,使K ≠ J ,导致移动;温度改变则是K 发生变化,导致K ≠ J 而移动。
4.标准平衡常数改变时,化学平衡是否发生移动?化学平衡发生移动时,标准平衡常数是否发生移动?答:标准平衡常数K 改变时,由于K 不再等于J ,所以平衡要发生移动。
化学平衡发生移动时,K 则不一定改变(温度不变则K 不变),而只是J 改变而已。
5.气固两相平衡系统的标准平衡常数与固相存在的量是否有关?答:否。
因为固相的“浓度”为1,不论量多量少。
6.下列叙述是否正确?试说明之。
(1) 反应的标准平衡常数大,反应速率一定也大;(2) 当气相可逆反应达到化学平衡时,反应物的分压等于产物的分压;(3) 在等温条件下,某反应系统中,反应物开始时的浓度或分压力不同,则平衡时系统的组成不同,标准平衡常数也不同;(4) 某气相反应达到化学平衡后,在温度不变条件下压缩反应系统的体积,反应系统的总压力增大,反应物和产物的分压也增大同样的倍数,平衡必定发生移动。
答:(1) 错。
K 与v 无必然联系。
K 是“热力学”因素,而v 是“动力学”因素。
(2) 错。
只要J =K 即称“平衡”,并不要求“反应物的分压等于产物的分压”。
当然,平衡时反应物的分压恰好与产物的分压相等也是可能的。

第三章化学平衡1、气相反应:2SO3(g)=2SO2(g)+O2(g)在1000K 时的平衡常数K F=3.54 X 103,求该反应的K’(IOOOK) 和K/(1000K)。
解:第一问能做,第二问不能做(不知道系统总压) 。
解答略。
2、氧化钴(CoO)能被氢或CO还原为Co,在721 C、101325Pa时,以H2还原,测得平衡气相中出的体积分数H2=0.025 ;以CO还原,测得平衡气相中CO的体积分数H2 =0.0192。
求此温度下反应CO(g)+H 2O(g)=CO2(g)+H2(g)的平衡常数K 匕解:CoO(s) + H2(g) = Co(s) + H2O (1)0.025 ph (1-0.025) p71a1-0.025Q 390.025CoO(s) + CO(g) = Co(s) + CO2 (2)0.0192 (1-0.0192) p711 -0.0192510.0192(2)-(1)= CO(g)+H 2O(g)=CO2(g)+H2(g),所以K/ - K// K/=51/39=1.313、计算加热纯Ag2O开始分解的温度和分解温度。
(1)在101325Pa的纯氧中;(2)在101325Pa且的空气中。
已知反应2Ag2O(s)=4Ag(s)+O 2(g)的.:r G m(T ) =(58576-122T/K)J • mol-1。
解:分解温度O2=0.21即标态下分解的温度。
令.l r G:(T ) =(58576-122T/K)<0,得T>480K开始分解温度即非标态下分解的温度。
令.「G m(T) =(58576-122T/K)+8.314 X Tin0.21<0,得T>434K4、已知Ag2O及ZnO在温度1000K时的分解压分别为240及15.7kPa。
问在此温度下(1)哪一种氧化物容易分解? (2)若把纯Zn及纯Ag置于大气中是否都易被氧化?( 3)若把纯Zn、Ag、ZnO、Ag2O 放在一起,反应如何进行?(4)反应ZnO(s)+2Ag(s)=Zn(s)+Ag 2O(s)的• : r H m=242.09kJ - mol -,问增加温度时,有利于那种氧化物的分解?解:(1)氧化银易分解;(2)银不易被氧化;(3) Zn + Ag2O = Ag + ZnO ; (4) ZnO5、已知下列反应的冷G;-T关系为:A 5 1Si(s)+O2(g)=SiO2(s); :r G m(T) =(-8.715 X 10 +181.09T/K)J • mol-A 5 12C(s)+O2(g)=2CO(g); :r G m(T) =(-2.234 X 10 -175.41T/K)J • mol-试通过计算判断在1300K时,100kPa下,硅能否使CO还原为C?硅使CO还原的反应为:Si(s)+2CO(g)=SiO 2(s)+2C(s)解:(1) - (2) = (3),贝Ua 5 1:Qm(T) =(-6.481 X 10 +356.5T/K)J • mol-1300K 时,r G m(T) =(-6.481 X 105+356.5 X 1300)=-1.847 X 105J - mol-1<0,可以6、将含水蒸气和氢气的体积分数分别为0.97和0.03的气体混合物加热到1000K,这个平衡气体混合物能否与镍反应生成氧化物?已知Ni(s)+0.5O2=NiO(s); • :^1(1000 K ) =-146.11 kJ • mol-1解:查表得CO(g) +H2O(g) =CO 2(g) + H 2(g):f H F(298K )-110.54 -241.84 -393.5 0 S m (298K )197.9188.74213.64130.58-1K -1 • molH 2(g)+0.5O 2(g)=H 2O(g); .-:r G ^(1000 K) =-191.08 kJ • mol -1解: (1) - (2) 得 Ni(s)+ H 2O(g)= NiO(s)+ H 2(g).■■■:r Gm(1000 K ) =-146.11 + 191.08 =44.97kJ • mol -1 .■■■:rGm (1000 K ) = . :rGm (1000 K ) +RTInQ-1=44970+8.314 X 1000 X ln (0.03/0.97) =16.07 kJ • mol 反应不能正向进行。

第三章 化学平衡测试练习题选择题:1、化学反应若严格遵循体系的“摩尔吉布斯函数—反应进度”曲线进行,则该反应在( A )[A].曲线的最低点[B].最低点与起点或终点之间的某一侧[C].曲线上的每一点[D].曲线以外某点进行着热力学可逆过程.2、有一理想气体反应A+B=2C ,在某一定温度下进行,按下列条件之一可以用θm r G ∆直接判断反应方向和限度:( C )[A].任意压力和组成[B].总压101.325kPa ,物质的量分数31===C B A x x x [C].总压303.975kPa ,31===C B A x x x [D].总压405.300kPa ,41==B A x x ,21=C x 3、298K 的理想气体化学反应AB=A+B ,当温度不变,降低总压时,反应的转化率( A )[A].增大 [B].减小 [C].不变 [D].不能确定4、已知气相反应)()(3)(126266g H C g H g H C =+在373K 时的143.192-⋅-=∆mol kJ H mr θ,当反应达平衡时,可采用下列哪组条件,使平衡向右移动( C )[A].升温与加压 [B].升温与减压[C].降温与加压 [D].降温与减压5、化学反应的平衡状态随下列因素当中的哪一个面改变? ( A )[A].体系组成 [B].标准态 [C].浓度标度[D].化学反应式中的计量系数νB6、在相同条件下有反应式(1)C B A 2=+,(θ1,m r G ∆);(2) C B A =+2121,(θ2,m r G ∆)则对应于(1),(2)两式的标准摩尔吉不斯函数变化以及平衡常数之间的关系为:( B )[A].θθ2,1,2m r m r G G ∆=∆,θθ21K K =[B].θθ2,1,2m r m r G G ∆=∆,221)(θθK K =[C].θθ2,1,m r m r G G ∆=∆,221)(θθK K =[D].θθ2,1,m r m r G G ∆=∆,θθ21K K = 7、反应)()()()(222g H g CO g O H g CO +=+,在600℃、100 kPa 下达到平衡后,将压力增大到5000kPa ,这时各气体的逸度系数为09.12=CO γ,10.12=H γ,23.1=CO γ,77.02=O H γ。
高二年级化学选修四同步小题狂练第三章第三节 化学平衡一、单选题1. 在一定温度下,某容积不变的密闭容器中,建立下列化学平衡: C(s)+H 2O(g)⇌CO(g)+H 2(g)下列叙述中可以认定上述可逆反应已达到化学平衡状态的是( )A. 容器内压强不再发生变化B. v 正(CO)=v 正(H 2O)C. 生成n mol CO 的同时,消耗n mol H 2OD. 1 mol H −H 键断裂的同时,形成2 mol H −O 键2. 下列实验事实不能用平衡移动原理解释的是( )A.B. C.D.3. 加热N 2O 5时,发生以下两个反应:N 2O 5⇌N 2O 3+O 2,N 2O 3⇌N 2O +O 2.在1L 密闭容器中加热4molN 2O 5,达到平衡时,c(O 2)为4.5mol/L ,c(N 2O 3) 为1.62mol/L ,则c(N 2O 5) 为( )A. 1.44mol/LB. 3.48mol/LC. 0.94mol/LD. 1.98mol/L4. 下列变化不能用勒夏特列原理解释的是( )A. 向H 2S 水溶液中加入NaOH 有利于S 2−增多B. H 2、I 2、HI 混合气体加压后颜色变深温度t/℃2550 100 水的离子积常数Kw/10−14 1.015.4755.0c(氨水)/(mol ⋅L −1) 0.1 0.01 pH11.110.6C. 合成氨时将氨液化分离,可提高原料的利用率D. 新制氯水久置后颜色变浅5.一定条件下进行反应A(g)⇌B(g)+xC(g),反应开始时容器中只含有A,其相对分子质量为32,平衡时混合气体的平均相对分子质量为20,此时A的转化率为30%,则x的值为()A. 1B. 2C. 3D. 46.某温度下,将0.2molC(S)和0.3mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g)⇌CO+H25min达到平衡后,密度增加了0.3g/L.有关下列说法正确的是()A. 从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005mol⋅L−1⋅min−1B. 达平衡时压强变为原来的76C. 此温度下该反应的平衡常数为0.0125D. 若保持温度和体积不变,向平衡体系中再加入0.2molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%7.在一定条件下,在密闭容器中发生合成氨反应,N2、H2、NH3的起始浓度分别为c1、c2、c3(均不为0).当反应达到平衡时,它们的浓度分别为0.1mol⋅L−1、0.3mol⋅L−1、0.08mol⋅L−1.下列判断错误的是( )A. 当H2与NH3生成速率为3:2时,反应一定达到平衡状态B. H2与N2的转化率一定相等C. c1一定等于0.14mol⋅L−1D. c3的取值范围为:0<c3<0.28mol⋅L−18.恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆H2(g)+I2(g)⇌2HI(g)△H=−14.9kJ/mol,实验时有关数据如表:下列判断正确的()A. 平衡时,乙中颜色更深,a>0.008Q2=0.149kJB. 平衡时,放出的热量:Q1=12第2页,共13页C. 该温度下,该反应的平衡常数K=4D. 平衡后,向甲中再充入0.004mol HI气体,再次达到平衡时HI的百分含量不变9.室温下,将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应:2A(气)+B(气)⇌XC(气),经2s(秒)后反应达平衡,测得 C 的浓度为0.6mol⋅L−1,B的物质的量为1.4mol,现有下列几种说法:①用物质 A 表示的反应的平均速率为0.3mol⋅L−1⋅s−1②反应前容器内的压强与平衡后容器内的压强之比为1:1③2s时物质A的转化率为30%④X=2⑤室温下该反应的化学反应平衡常数是0.5其中正确的是()A. ①④⑤B. ①③④C. ②③⑤D. ③④⑤10.已知某化学反应的平衡常数表达式为K=c(CO2).c(H2)c(CO).c(H2O),在不同的温度下该反应的平衡常数如下表:下列有关叙述不正确的是()A. 该反应的化学方程式是CO(g)+H2O(g)⇌CO2(g)+H2(g)B. 上述反应的正反应是放热反应C. 增加CO,CO的平衡转化率增大D. 若平衡浓度符合关系c(CO2)3c(CO)=c(H2O)5c(H2),则此时的温度为1000℃二、填空题(本大题共3小题,共3.0分)11.可逆反应:FeCl3+3KSCN⇌Fe(SCN)3+3KCl[离子方程式为:Fe3++3SCN−⇌Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?(1)加入少量FeCl3固体:平衡向____________移动;(2)加入少量KSCN固体:平衡向____________移动;(3)加入少量KCl固体:平衡____________移动,其理由是____________.12.亚硝酰氯是有机合成中的重要试剂,工业上与NO与Cl2反应合成亚硝酰氯的原理是2NO(g)+Cl2⇌2NOCl(g).25℃时,向2L带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生上述反应,测得其压强(p)随时间(t)的变化如图Ⅰ实线所示(反应达到平衡时的温度与起始温度相同).请回答下列问题:(1)该反应的△H______ (填“>”“<”或“=”)0.(2)反应开始至达到平衡时,v(NO)=______ .(3)若其他条件相同时,只改变某一个条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是______ .(4)如图Ⅱ是甲、乙两位同学描绘的上述反应的平衡常数的对数值(lgK)与温度的变化关系图.①a值为______ .②能正确表示该反应的lgK与T的关系的是曲线______ (填“甲”或“乙”).13.(1)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0.甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol.则T1______ T2(填“>”“<”),甲容器中反应的平衡常数K=______ .(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将1mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g)⇌2NH3(g),起始时A、B的体积相同均为1L.①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______ .②容器A中反应到达平衡时所需时间t s ,达到平衡后容器的压强变为原来的5,则平均反应速率6v(H2)=______ .(3)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为______ (用c1、c2、c3和>、<、=表示).第4页,共13页答案和解析【答案】1. A2. C3. C4. B5. B6. B7. C8. D 9. B 10. C11. 正反应;正反应;不;K+和Cl−不参加反应,溶液中Fe3+、SCN−浓度不变12. <;0.002mol/(L⋅min);催化剂;2;乙mol⋅L−1⋅S−1;c1=c2<c313. >;108L⋅mol−1;d;1at【解析】1. 解:A.碳为固态,该反应前后气体体积不相等,则反应过程中容器内压强为变量,当压强不变时,表明正逆反应速率相等,达到了平衡状态,故A正确;B.v正(CO)=v正(H2O),没有指出正逆反应速率,无法判断是否达到平衡状态,故B错误;C.生成n mol CO的同时,消耗n mol H2O,表示的都是正反应速率,无法判断是否达到平衡状态,故C错误;D.1molH−H键断裂的同时,形成2 mol H−O键,表示的都是逆反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故D错误;故选A.可逆反应C (s)+H2O(g)⇌CO(g)+H2(g)是一个反应前后气体体积增大的可逆反应,当该反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,注意该反应中反应前后气体质量改变,为易错点.2. 解答:解:A.存在平衡2NO2⇌N2O4,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故A不选;B.水是弱电解质,存在电离平衡H2O⇌H++OH−,电离过程是吸热过程,升高温度,促进水的电离,氢离子与氢氧根离子的浓度增大,水的离子积中增大,可以用平衡移动原理解释,故B不选;C.过氧化氢分解,加入的二氧化锰起催化剂的作用,加快过氧化氢分解,不能用平衡移动原理解释,故C 选;D.氨水中存在平衡NH3⋅H2O⇌NH4++OH−,浓度越稀,电离程度越大,故0.1mol/L的氨水稀释10倍,pH 变化小于1个单位,可以用平衡移动原理解释,故D不选;故选C.分析:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.本题考查了勒夏特列原理的使用条件,平衡移动原理对所有的动态平衡都适用,难度不大,注意使用勒夏特列原理的前提必须存在可逆过程.3. 解:加热N2O5时,发生以下两个分解反应:N2O5⇌N2O3+O2,N2O3⇌N2O+O2,则N2O5⇌N2O3+O2,开始 4 0 0转化x x x平衡4−xN2O3⇌N2O+O2,转化y y y平衡x−y y x+y化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,解得x=3.06,y=1.44,c(N2O5)=4−3.06=0.94mol/L;故选C.本题考查化学平衡的计算,注意发生的化学平衡中N2O3既生成又分解为解答的难点,明确化学平衡三段法计算格式即可解答,题目难度中等.4. 解:A.存在溶解平衡H2S⇌H++HS−,HS−⇌H++S2−,加入NaOH,氢氧根离子与氢离子反应,氢离子浓度减小,平衡正向移动,有利于S2−增多,故能用勒夏特列原理解释,故A不选;B.H2+I2⇌2HI,加压后,体积变小,颜色加深,平衡不移动,故故不能用勒夏特列原理解释,故B选;C.N2+3H2⇌2NH3,将氨液化分离,减小生成物浓度,平衡正向移动,氮气和氢气的转化率变大,故能用勒夏特列原理解释,故C不选;D.Cl2+H2O=HCl+HClO,次氯酸见光分解,平衡正向移动,氯气的浓度变小,颜色变浅,故能用勒夏特列原理解释,故D不选;故选B.勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关,则不能用勒夏特利原理解释.本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.第6页,共13页5. 解:反应开始时容器中只含有A,其相对分子质量为32,设A起始量为1mol,平衡时A的转化率为30%,A(g)⇌B(g)+xC(g)起始量(mol) 1 0 0变化量(mol)0.30.30.3x平衡量(mol)0.70.30.3x反应前后气体质量不变,混合气体的质量为32g,依据平均相对分子质量数值上等于平均摩尔质量的数值,M=mn =32g0.7+0.3+0.3x=20计算得到x=2故选B.依据反应的化学方程式可知,A(g)⇌B(g)+xC(g),反应开始时容器中只含有A,其相对分子质量为32,设A起始量为1mol,依据化学反应三段式列式计算平衡物质的量,结合平均相对分子质量概念计算得到.本题考查了化学平衡的计算应用,主要是气体平均摩尔质量的分析计算,注意反应前后气体质量守恒的计算应用,掌握基础是关键,题目难度中等.6. 解:设转化的水蒸气为xmol,列三段式C(S)+H2O(g)⇌CO+H2开始(mol)0.20.30 0转化(mol)x x x x平衡(mol)0.2−x0.3−x x x密度增加了0.3g/L则(0.3−x)×18+28x+2x2−0.3×182=0.3解得x=0.05molA、C为固体,不可以用来表示反应速率,故A错误;B、根据压强之比等于物质的量之比,达平衡时压强变为原来的0.3−0.05+0.05+0.050.3=76,故B正确;C、根据平衡常数等于生成物浓度的幂次方之积比反应物浓度的幂次方之积,则K=0.05mol2L×0.05mol2L(0.3−0.05)mol2L=0.005,故C错误;D、根据以上数据得,平衡时H2O的转化率等于0.050.3×100%=16×100%=16.7%;若保持温度和体积不变,向平衡体系中再加入0.2molC(S)和0.3 mol H2O(g),相当于增大一倍反应物,因该反应是气体体积发生变化的反应,故重新达到平衡时与原平衡不等效,所以H2O的转化率不等于16.7%,故D错误;故选:B;设转化的水蒸气为xmol,列三段式C(S)+H2O(g)⇌CO+H2开始(mol)0.20.30 0转化(mol)x x x x平衡(mol)0.2−x0.3−x x x密度增加了0.3g/L则(0.3−x)×18+28x+2x2−0.3×182=0.3解得x=0.05molA、根据不能用纯固体来计算反应速率来判断;B、根据压强之比等于物质的量之比计算;C、根据平衡常数等于生成物浓度的幂次方之积比反应物浓度的幂次方之积计算;D、根据等效平衡判断是否等效,再计算判断;考查了利用三段式进行化学平衡的计算,难度不大,只要抓住基本知识就能解题,关键D要注意等效平衡条件的判断;7. 解:当反应达到平衡时,它们的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,采取极值转化分析判断N2(g)+3H2(g)=2NH3(g)平衡浓度0.10.30.08逆向极值转化0.140.420正向极值转化0 0 0.28A.当H2与NH3生成速率为3:2时,说明对氢气或氨气正逆反应速率相同,反应一定达到平衡状态,故A 正确;B.氮气和氢气平衡浓度之比为1;3,所以起始浓度一定按照1:3,所以H2与N2的转化率一定相等,故B 正确;C.如果c1一定等于0.14mol/L,那么反应应该是正向进行,而题中已知反应不一定是正方向进行,答案给的0.14是按照如果NH3的起始量为零的情况下正方向进行才会是0.14,因为转化量之比等于系数比,又由题知起始量不为零,故C错误;D.按照极限法来算,如果正反应方向进行的,生成0.08mol,那么极限值NH3的起始量为零,如果逆反应方向进行那么生成0.1mol的N2和0.3mol的H2那么极限值的NH3起始量为0.28,又由题中条件告诉起始量不为零所以氨气的起始量应该介于0−0.28之间,c3的取值范围为0<c3<0.28mol/L,故D正确;故选:C;A、反应速率之比等于化学方程式计量数之比,氢气生成速率和消耗速率相同,反应达到平衡;B、反应物的转化率和反应物的初始浓度以及变化浓度有关系;C、c1一定等于0.14mol/L,是极值转化后氮气的浓度,实质是加入的氮气、氢气和氨气,氮气浓度不是0.14mol/L;第8页,共13页D、依据极值法计算分析;本题考查了化学平衡影响因素、平衡常数计算、平衡标志判断的理解应用,注意平衡中极值方法的计算应用是解题关键,题目难度中等.8. 解:A、该反应前后气体的体积不变,乙中的浓度为甲中的2倍,乙中压强为甲中2倍,压强不影响平衡移动,所以a=0.008,故A错误;B、二者为等效平衡,平衡时Q1=12Q2,但可逆反应不能完全进行,所以放出热量要根据反应进行的程度计算,0.01molH2完全反应后才放出0.149kJ的热,所以Q1=12Q2≠0.149kJ,故B错误;C、平衡时HI的浓度为0.004mol/L,则:H2(g)+I2(g)⇌2HI(g)△H=−14.9kJ/mol开始(mol/L):0.010.010变化(mol/L):0.0020.0020.004平衡(mol/L):0.0080.0080.004故该温度下该反应的平衡常数k=0.00420.008×0.008=0.25,故C错误;D、可以将0.004mol HI气体放在另外一个容器中建立一个平衡,与原平衡成等效平衡,再将这一平衡体系压入原容器中,由于压强对该平衡没有影响,所以次达到平衡时HI的百分含量不变,故D正确,故选D.A、该反应前后气体的体积不变,乙中的浓度为甲中的2倍,乙中压强为甲中2倍,压强不影响平衡移动,所以a=0.008;B、二者为等效平衡,平衡时Q1=12Q2,但可逆反应不能完全进行,所以放出热量要根据反应进行的程度计算;C、根据平衡时HI的浓度,利用三段式计算平衡时其它组分的平衡浓度,代入平衡常数表达式计算;D、可以将0.004mol HI气体放在另外一个容器中建立一个平衡,与原平衡成等效平衡,再将这一平衡体系压入原容器中,由于压强对该平衡没有影响,所以次达到平衡时HI的百分含量不变.本题考查等效平衡、化学平衡常数的计算、影响化学平衡的因素等,难度中等,注意理解等效平衡规律.9. 解:①达到平衡时B的物质的量为1.4mol,则参加反应的B的物质的量=(2−1.4)mol=0.6mol,2s内v(B)=0.6mol2L2s=0.15mol/(L.s),根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,则v(A)=2v(B)=2×0.15mol/(L.s)=0.30mol/(L.s),故正确;②平衡时剩余n(A)=4mol−2n(B)=4mol−2×0.6mol=2.8mol,n(C)=0.6mol/L×2L=1.2mol,则平衡时气体总物质的量=(2.8+1.4+1.2)mol=5.4mol;反应前后压强之比等于其物质的量之比,反应前混合气体物质的量=6mol,则反应前后压强之比=6mol:5.4mol=10:9,故错误;③2s时物质A的转化率=1.2mol4mol×100%=30%,故正确;④C的平均反应速率=0.6mol/L2s=0.3mol/(L.s),根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,v(A)=0.30mol/(L.s),则X=2,故正确;⑤平衡时c(C)=1.2mol2L =0.6mol/L、c(A)=2.8mol2L=1.4mol/L、c(B)=1.4mol2L=0.7mol/L,化学平衡常数K=0.6×0.61.4×1.4×0.7=0.26,故错误;故选B.①达到平衡时B的物质的量为1.4mol,则参加反应的B的物质的量=(2−1.4)mol=0.6mol,2s内v(B)=0.6mol2L2s=0.15mol/(L.s),根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,据此计算A的平均反应速率;②平衡时剩余n(A)=4mol−2n(B)=4mol−2×0.6mol=2.8mol,n(C)=0.6mol/L×2L=1.2mol,则平衡时气体总物质的量=(1.2+1.4+1.2)mol;反应前后压强之比等于其物质的量之比;③2s时物质A的转化率=1.2mol4mol×100%;④C的平均反应速率=0.6mol/L2s=0.3mol/(L.s),根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,据此计算X;⑤平衡时c(C)=1.2mol2L =0.6mol/L、c(A)=2.8mol2L=1.4mol/L、c(B)=1.4mol2L=0.7mol/L,根据化学平衡常数公式计算平衡常数.本题考查化学平衡有关计算,为高频考点,侧重考查学生分析计算能力,明确反应速率之比与计量数之比关系是解本题关键,注意:化学平衡常数的计算中要用浓度幂之积,为易错点.10. 解:A、平衡常数表达式为K=c(CO2).c(H2)c(CO).c(H2O),化学方程式为CO+H2O=CO2+H2,故A正确;B、平衡常数随温度升高减小,说明平衡逆向进行,逆向为吸热反应,正反应为放热反应,故B正确;C、两种反应物增大一种的量会提高一种物质的转化率,本身转化率减小,增加CO,CO的平衡转化率减小,故C错误;D、若平衡浓度符合关系c(CO2)3c(CO)=c(H2O)5c(H2),c(CO2).c(H2)c(CO).c(H2O)=0.6,则此时的温度为1000℃,故D正确;故选C.A、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,幂次方为化学方程式计量数,据此书写化学方程式;B、平衡常数随温度升高减小,说明平衡逆向进行,逆向为吸热反应;第10页,共13页C、两种反应物增大一种的量会提高一种物质的转化率,本身转化率减小;D、计算此时平衡常数结合图表数据判断.本题考查了平衡常数书写方法,计算应用,平衡常数影响因素的分析判断,掌握基础是关键,题目较简单.11. 解:(1)加入少量FeCl3固体,溶液中Fe3+浓度增大,平衡向正反应移动,故答案为:正反应;(2)加入少量KSCN固体,反应中SCN−浓度增大,平衡向正反应移动,故答案为:正反应;(3)加入少量KCl固体,溶液中Fe3+、SCN−浓度不变,K+和Cl−不参加反应,平衡不移动,故答案为:不;K+和Cl−不参加反应,溶液中Fe3+、SCN−浓度不变.12. 解:(1)由图1分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随反应进行温度升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变为:△H<0;故答案为:<;(2) 2NO(g)+Cl2(g)⇌2NOCl(g)起始(mol):0.080.040变化(mol):2x x 2x平衡(mol):0.08−2x0.04−x 2x据:压强之比等于物质的量之比.得到:65=0.08+0.040.08+0.04−x解得:x=0.02molv(NO)=0,.02mol2L5min=0.002mol/(L⋅min);故答案为:0.002mol/(L⋅min);(3)由图知:化学反应速率加快,平衡不动.改变的条件:加入催化剂;故答案为:催化剂;(4)①依据(2)的计算得到平衡时:物质的浓度代入x求得:c(NO)=(0.08−2×0.02)2=0.02mol/L;c(Cl2)=0.01mol/L;c(NOCl)=0.02mol/L;结合平衡常数概念计算:K=c 2(NOCl)c2(NO)c(Cl2)=0.0220.022×0.01=100;lgK=lg100=2,a=2;故答案为:2;第12页,共13页②T 升高,平衡左移,K 减小,lgK 减小,曲线选乙,故答案为:乙.(1)由图1分析可知,随反应的进行压强先增大后减小,5min 达到平衡状态,推知开始因反应是放热的,随反应进行温度升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态;(2)依据化学平衡三段式列式计算,气体压强之比等于气体物质的量之比;计算消耗量,反应速率=△c △t 计算;(3)化学反应速率加快,平衡不动.改变的条件是加入催化剂;(4)①依据(2)的计算得到平衡时物质的浓度,结合平衡常数概念计算得到平衡常数,来计算; ②T 升高,平衡左移,K 减小,lgK 减小,曲线选乙.本题考查了化学平衡的计算分析,图象的理解应用,影响化学平衡因素的判断,掌握基本计算方法和平衡原理是解题关键,题目难度中等. 13. 解:(2)该反应为放热反应,温度越高,生成的SO 3越少,达到平衡时甲容器中生成的三氧化硫的物质的量少,则甲容器的温度高,即T 1>T 2;2SO 2(g)+O 2(g)⇌2SO 3(g)起始(mol/L): 5 3 0转化(mol/L): x 0.5x x平衡(mol/L): 5−x 3−0.5x x达到平衡时SO 3的物质的量为4.5mol ,则x =4.5mol/L ,所以K =c 2(SO 3)c 2(SO 2)×c(O 2)=4.520.52×0.75=108L ⋅mol −1; 故答案为:>;108L ⋅mol −1;(3)①a.密度=总质量体积,总质量一定,A 中体积不变,故密度不变,所以不能说明反应达到平衡状态,故a 错误;b.恒温条件下,平衡常数保持不变,则不能说明反应达到平衡状态,故b 错误;c.都是正反应速率,不能说明反应达到平衡状态,故c 错误;d.N 2的转化率先增大,后保持不变,说明反应达到平衡状态,与图象相符,故d 正确;故答案为:d ;② N 2(g)+3H 2(g)⇌2NH 3(g)起始(mol):1 3 0转化(mol):x 3x 2x平衡(mol):1−x 3−3x 2x达到平衡后容器的压强变为原来的56,则4−2x 4=56,解得x =13,v(H2)=1molaLts=1atmol⋅L−1⋅S−1;故答案为:1atmol⋅L−1⋅S−1;(3)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,铵根离子浓度较大,氨气与硫酸和盐酸恰好反应,所以溶液中铵根离子浓度:c1=c2<c3;故答案为:c1=c2<c3.(1)该反应为放热反应,温度越高,生成的SO3越少;先利用三段式求出平衡时各物质的浓度,再根据K=c2(SO3)c2(SO2)×c(O2)计算;(2)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;②已知反应为N2(g)+3H2(g)⇌2NH3(g),通入1molN2和3molH2,达到平衡后容器的压强变为原来的5/6,根据压强之比等于物质的量比结合三段式计算;(3)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,氨气与硫酸和盐酸恰好反应.本题考查较综合,涉及平衡常数计算、反应速率计算、平衡状态判断、弱电解质的电离等知识点,这些都是高考高频点,侧重考查学生分析、计算及知识运用能力,注意只有反应前后改变的物理量才能作为平衡状态的判断依据,注意化学平衡常数计算中用物质浓度而不是物质的量计算,这些都是易错点.。
第三章 化学反应速率和化学平衡习题3-1 什么是反应的速率常数?它的大小与浓度、温度、催化剂等因素有什么关系? 答:反应的速率大都可以表示为与反应物浓度方次的乘积成正比:υ=k·c α(A)·c β(B),式中比例常数k 就是速率常数。
速率常数在数值上等于反应物浓度均为1 mol·L -1时的反应速率。
k 的大小与反应物浓度无关,改变温度或使用催化剂会使速率常数k 的数值发生变化。
习题 3-2 什么是活化能?答:Arrhenius 总结了大量实验事实,提出一个经验公式:速率常数k 的对数与1/T 有线形关系:C TRE k a +⋅-=1ln 式中E a 就是活化能,它表示活化分子具有的最低能量与反应分子平均能量之差。
习题3-3 什么是催化剂?其特点有哪些?答:某些物质可以改变化学反应的速率,它们就是催化剂。
催化剂参与反应,改变反应历程,降低反应活化能。
催化剂不改变反应体系的热力学状态,使用催化剂同样影响正、逆反应的速率。
不影响化学平衡,只能缩短达到平衡的时间。
习题3-4 NOCl 分解反应为2NOCl→2NO+Cl 2实验测得NOCl 的浓度与时间的关系如下:t/s0 10 20 30 40 50 c (NOCl )/mol·L -12.001.420.990.710.560.48求各时间段内反应的平均速率;用作图法求t =25s 时的瞬时速率。
解:t=0-10s 时,1042.100.2-=∆∆=t c υ= 0.058mol·L -1·s -1 t=10-20s 时,102099.042.1--=∆∆=t c = 0.043mol·L -1·s -1t=20-30s 时,203071.099.0--=∆∆=t c υ= 0.028mol·L -1·s -1t=30-40s 时,304056.071.0--=∆∆=t c υ= 0.015mol·L -1·s -1t=40-50s 时,405048.056.0--=∆∆=t c = 0.008mol·L -1·s -1 作图法略。
1物理化学第三章课后思考题一、选择题1. 在刚性密闭容器中,有下列理想气体的反应达到平衡 A(g) + B(g) =C(g) 若在恒温下加入一定量的惰性气体,则平衡将 ( )(A) 向右移动(B) 向左移动(C) 不移动(D) 无法确定2. 在 298 K 时,气相反应H 2+I 2=2HI 的Δr G m $=-16 778 J ⋅mol -1,则反应的平衡常数 K p $为: ( )(A) 2.0×1012 (B) 5.91×106 (C) 873 (D) 18.94. 已知反应 2NH 3= N 2+ 3H 2在等温条件下,标准平衡常数为 0.25,那么,在此条件下,氨的合成反应 (1/2) N 2+(3/2) H 2= NH 3 的标准平衡常数为: ( )(A) 4(B) 0.5(C) 2(D) 15. Ag 2O 分解可用下面两个计量方程之一表示,其相应的平衡常数也一并列出:Ag O s Ag s O g 22212()()()→+ K P ()1 2422Ag O s Ag s O g ()()()→+ K p()2 设气相为理想气体,且已知反应是吸热的,试判断下列结论哪个是正确的: ( )(A )K K P ()()2112= (B )K K p p ()()21= (C )K p ()2随温度的升高而增大 (D )O 2气的平衡压力与计量方程的写法无关6. Ag 2O 分解可用下列两个反应方程之一表示,其相应的平衡常数也一并列出 I. Ag 2O (s) 2Ag (s) + (1/2) O 2 (g) K p (Ⅰ) II. 2Ag 2O (s) 4Ag (s) + O 2 (g) K p (Ⅱ)设气相为理想气体,而且已知反应是吸热的,试问下列哪个结论是正确的:(A) K p (Ⅱ) = K p (Ⅱ)(B) K p (Ⅰ) = K p 2(Ⅱ)(C) O 2 气的平衡压力与计量方程的写法无关(D) K p (Ⅰ) 随温度降低而减小7. 某低压下的气相反应,在 T =200 K 时K p =8.314×102 Pa ,则K c /mol·cm -3是:( )(A) 5×102 (B) 14×106 (C) 14×103 (D) 0.58.理想气体反应CO g H g CH OH g ()()()+=223的r m ΔG $与温度T 的关系为:-1r m /J mol 2166052.92G ∆⋅=-+$(T /K),若使在标准状态下的反应向右进行,则应控制反应的温度: ( )(A )必须高于409.3 K (B )必须低于409.3 K(C )必须等于409.3 K (D )必须低于409.3 °C二、填空题9 在温度为2000 K 时,理想气体反应CO g O g CO g ()()()+=1222的-1r m 45817J mol G ∆=⋅$,则该反应的平衡常数K p = ()kPa -12。
第二章热力学第二定律1、2.0mol理想气体在27℃、20.0dm3下等温膨胀到50.0dm3,试计算下述各过程的Q、W、ΔU、ΔH、ΔS。
(1)可逆膨胀;(2)自由膨胀;(3)对抗恒外压101kPa膨胀。
解:(1)ΔU=ΔH=0;Q=-W==2.0×8.314×300×=4571(J);ΔS===15.24(J·K-1)(2)Q=0;W=0;ΔU=0;ΔH=0;ΔS===15.24(J·K-1)(3)ΔU=ΔH=0;Q=-W=101×(50-20) =3030(J);ΔS===15.24(J·K-1)2、1.0molα-Fe由25℃加热到850℃,求ΔS。
已知C p,m=30.30J·mol-1·K-1解:ΔS==30.30×=40.20(J·K-1)3、2.0mol理想气体由5.00MPa、50℃加热至10.00MPa、100℃,试计算该过程的ΔS。
已知C p,m=29.10 J·mol-1·K-1。
解:属于pTV都改变的过程。
ΔS==8.38-11.53=-3.15(J·K-1)4、N2从20.0dm3、2.00MPa、474K恒外压1.00MPa绝热膨胀到平衡,试计算过程的ΔS。
已知N2可看成理想气体。
解:Q=0; ΔU=W,即nC p,m(T2-T1)=-p e(V2-V1)将n==10.15(mol); C p,m=3.5R; V2==84.39×10-6T2代入上式得:10.15×3.5R×(T2-474)=-1.0×106×(84.39×10-6T2-20×10-3)解得T2=421.3K该过程属于pTV都改变的过程,所以错错ΔS==-34.81+58.49=23.68(J·K-1)5、计算下列各物质在不同状态时熵的差值。