气固相催化反应本征动力学
- 格式:ppt
- 大小:235.00 KB
- 文档页数:37



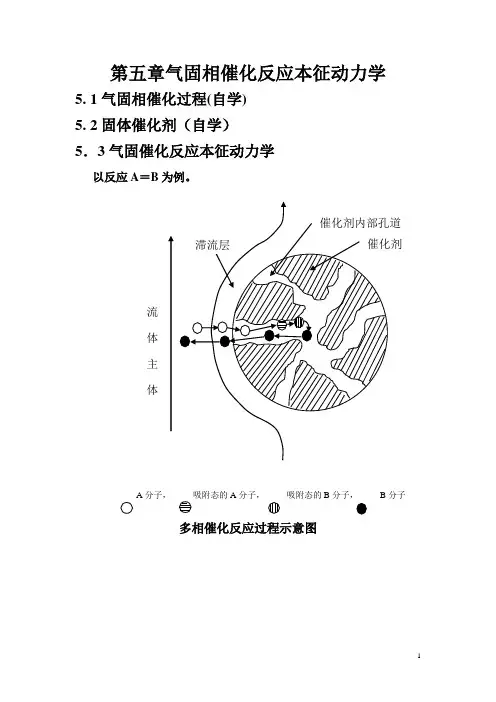
第五章气固相催化反应本征动力学5. 1气固相催化过程(自学) 5. 2固体催化剂(自学) 5.3气固催化反应本征动力学以反应A =B 为例。
A分子,A 分子, 吸附态的B 分子, B 分子多相催化反应过程示意图整个多相催化反应过程可概括为下列七个步骤组成:1、反应组分从流体主体扩散到固体催化剂的外表面(外扩散过程);2、反应物自催化剂外表面扩散到催化剂内部(内扩散过程);3、反应物在催化剂的表面上被吸附(吸附过程);4、吸附的反应物转换为吸附态的生成物(表面反应过程);5、生成物从催化剂的表面上脱附下来(脱附过程);6、脱附的产物分子由催化剂的孔道向外扩散到催化剂的外表面(内扩散过程);7、产物自催化剂的外表面扩散到流体主体(外扩散过程)。
什么是气固相催化反应本征动力学?气固相催化反应本征动力学由如下三步构成(不包括扩散的影响):1)吸附—气相分子在催化剂表面上化学吸附形成吸附络合物。
2)反应—吸附络合物之间相互反应生成产物络合物。
3)脱附—产物络合物由固体表面脱附出来。
5.3.1化学吸附与脱附目的—由吸附、脱附速率方程求出:1.θ~P的关系;2.如果其为控制步骤时就认为是本正动力学速率。
一、化学吸附速率的一般表达式A+Aσσ→θ①组分A的吸附率(活性中心覆盖率)A总的活性中心数覆盖的活性中心数被组分A A =θ 5.3—1②空位率V θ总的活性中心数心数气相分子覆盖的活性中未被 V =θ 5.3—2设i θ为i 组分的覆盖率,则有下式:1V i =θ+θ∑理论基础—表面质量作用定律:对如下的多相基元反应dD cC bB aA +=+吸吸反应速率r 与反应物的吸附量或覆盖度(吸附率)θ成正比,其覆盖度的指数等于相应的化学计量系数:bB a A k r θθ= 5.3—3表面质量作用定律是理想吸附催化反应动力学的基础,它在多相催化反应动力学中的地位相当于质量作用定律在均相反应动力学中的地位。
化学吸附为何可用表面质量作用定律?—化学吸附作用为化学键力,相当于基元化学反应过程,因此可用表面质量作用定律。







第四章
气固相催化反应本征动力学
本章主要内容•催化剂
•催化反应机理
•本征的反应速率
第一节气固相催化过程⎪⎪⎩⎪⎪⎨⎧⎯⎯⎯⎯⎯→⎯⎯⎯⎯⎯⎯⎯→
⎯⎯⎯⎯⎯→
⎯⎯⎯⎯⎯⎯→
⎯+×××固体石蜡烃类
混合物CH OH CH H CO Pa 10150423K Ru Pa 1020473K Fe,Co 4Ni,523K,3Pa 100Cu,573K,302555
,,,,常压
第二节固体催化剂
固体催化剂由三部分组成:
•活性组分
•载体
•助剂
•一个成功的催化剂往往是主催化剂和助催化剂及载体的完美结合。
活性组分
•以金属为主,根据不同的用途,有金属氧化物及硫化物等等。
•活性组分的选择,根据目前的知识水平只能有一个大致的方向,尚不能预先选择。
通常对活性组分的要求:
•具有尽可能高的催化活性,选择性和抗毒性。
载体
•以多孔物质为主,如硅藻土、三氧化二铝等。
•根据不同的需要,有不同的孔径和比表面。
•强度高,是对所有载体的要求。
助催化剂
加入的量小,增加催化活性,增加选择性,延长催化剂寿命
一般有结构型助催化剂和调变型助催化剂。
乙苯脱氢,Fe 2O 3加入少量
Cr 2O 3提高催化剂的热稳定性。
催化剂的设计
催化剂的制备
z沉淀法
z浸渍法
z混合法
z离子交换法
不同的制备方法,成份、用量相同,但催化剂性能不同。
第四章 气固相催化反应本征动力学1. 催化剂要求——活性好、选择性高、寿命及稳定性好。
2. 孔容V g ——每克催化剂内部孔道所占体积,采用氦-汞置换法测定,氦-汞置换体积之差除以催化剂质量为孔容。
由被置换的氦体积可求得真密度ρt ,由汞体积可求得表观密度或假密度ρp ,单位堆积体积的颗粒质量为堆密度或床层密度ρb 。
颗粒催化剂的孔隙率θ为颗粒的孔容积与总容积之比。
催化剂床层空隙率为ε,ρb =ρp (1-ε)=ρt ((1-θ)(1-ε)。
θ=ρp V g 3. 气固相催化反应由反应物在催化剂内表面的活性位上的化学吸附、吸附态组分进行化学反应和吸附态产物脱附三个串联步骤组成。
按上述步骤获得的催化反应的化学反应动力学为本征动力学。
4. 分子间的引力产生物理吸附,无明显选择性,即可是单分子层吸附,也可是多分子层吸附,吸附量随温度升高而迅速减少。
化学吸附是固体表面与吸附分子间的化学键造成的,有显著的选择性,吸附速率随温度升高而增加,吸附层是单分子层。
5. 化学吸附速率与气相中组分A 的分压p A 、吸附活化能以及表面覆盖度θA 有关。
6. 理想吸附层等温方程或均匀表面吸附模型表面覆盖度:∑=∗∗+=n 1i ii ii i p b 1p b θ;真实吸附等温方程式或不均匀表面吸附模型表面覆盖度:)p ln(b f1A 0A ∗=θ。
7. 单组分理想吸附速率方程:()∗∗+−=AA A A a p b 1p p k r 8. 单组分理想脱附速率方程:()∗∗+−=AA A A a p b 1p p k r 9. 表面反应控制速率方程:∑+−=2i i D C 2B A 1)p b (1p p k p p k r 10. 非理想吸附速率方程:())p b (p p k r A A A A a ∗∗−= 11. 不可逆单反应速率常数随温度升高而增大,采用较高的操作温度可以提高反应速率,获得较高反应产率。
第五章 气-固相催化反应动力学本章核心内容:介绍了气-固相催化反应的特点、固体催化剂的特征参数和均匀及不均匀吸附等温方程的要点,在此基础上,阐述了不同控制步骤的气-固相催化反应本征动力学方程。
本章的重点在于讨论有关固体催化剂的反应-传质-传热耦合的宏观过程、宏观动力学方程的建立及求解方法。
前已述及,化学反应可分为均相反应和非均相反应两大类。
均相反应动力学因无相间传质传热阻力属于本征动力学范畴,而气固两相催化反应存在相间传递阻力,使可测的主体气流温度和浓度与实际反应值不同,为了描述真实的反应速率,进行有效的气固催化反应器设计,从第五章开始,将学习和讨论气固非均相反应动力学及其反应器设计内容。
本章从它的机理方程入手,详细讨论气固相催化反应宏观动力学规律。
5-1 气-固相催化反应 5-1-1 气-固相催化反应概述所谓气固相催化反应是指在反应条件下,在固体催化剂表面上进行的、反应物和产物均呈气态的一类化学反应。
例如,氮气和氢气在固体铁催化剂表面上进行的合成反应,二氧化硫在固体钒催化剂表面上转化为三氧化硫的反应,合成气在铜基催化剂表面上进行合成甲醇的反应等等,都属于气固相催化反应。
这一类型的催化反应在化工生产中所占的份额相当大,因此气固相催化反应动力学研究及其反应器设计等相关内容成为化学反应工程学的核心内容之一。
气固相催化反应的最大特点莫过于固体催化剂表面这个反应平台,它不仅可以改变反应路径、降低反应活化能,加快反应速率。
因此,在定义气固相催化反应速率时,离不开固体催化剂表面积S 这个参变量的引入,即dtdn S r ii 1±= (5-1) 固体催化剂表面积是固体催化剂的重要性能参数之一,对于特定的催化剂而言,单位质量催化剂所具有的表面积几乎是一个常量,两者之间具有高度的对应关系,所以在定义气固相催化反应速率时,也常常用固体催化剂质量W 替代式(5-1)中的S 。
气-固相催化反应动力学研究的目的就是要建立气固相催化反应动力学方程,为气固相催化反应器的开发设计、选型、优化操作与控制提供理论依据。