高三化学弱电解质的电离1
- 格式:ppt
- 大小:1.31 MB
- 文档页数:35

高三总复习专题八 ----- 水溶液中的离子平衡课时1 弱电解质的电离考点一 弱电解质的电离1.强、弱电解质(1)概念(2)与化合物类型的关系 强电解质主要是大部分离子化合物及某些共价化合物。
弱电解质主要是某些共价化合物。
2.弱电解质的电离平衡 (1)电离平衡的建立 在一定条件下(如温度、压强等),当弱电解质电离成离子的速率和离子结合成分子的速率相等时,就达到了电离平衡状态。
(2)电离平衡的特征(3)外界条件对电离平衡的影响①内因:弱电解质本身的性质。
②外因:a .温度:升高温度,电离平衡向电离方向移动,电离程度增大,原因是电离过程吸热。
b .浓度:加水稀释,使弱电解质的浓度减小,电离平衡向电离的方向移动,电离程度增大。
c .同离子效应:例如向CH 3COOH 溶液中加入CH 3COONa 固体,溶液中c (CH 3COO -)增大,CH 3COOH 的电离平衡向左(填“左”或“右”)移动,电离程度减小,c (H +)减小,pH 增大。
一元强酸与一元弱酸的比较 比较项目酸 c (H +) pH 中和碱的能力 与足量活泼金属反应产生H 2的量 与金属反应的起始速率 一元强酸大 小 相同 大一元弱酸 小 大 相同 小探究思考1.判断下列电离方程式的书写是否正确,如有错误请改正。
(1)熔融状态下NaHSO 4的电离:NaHSO 4 === Na ++ H ++ SO 42- ( )(2)H 2CO 3的电离: H 2CO 3 ⇋ 2H ++ CO 32- ( )(3)Fe(OH)3的电离:Fe(OH)3 ⇋ Fe 3++ 3OH - ( )(4)水溶液中NaHSO 4的电离: NaHSO 4=== Na ++ HSO 4- ( ) 2.以0.1 mol·L -1CH 3COOH 溶液为例:探究外界条件对电离平衡的影响,请完成表格:实例(稀溶液) CH 3COOH H ++CH 3COO - ΔH >0改变条件 平衡移动方向 n (H +) c (H +) 导电能力 K a 加水稀释 加入少量冰醋酸 通HCl(g) 加NaOH(s) 加入镁粉 升高温度【示例1】 (2013·福建,8)室温下,对于0.10 mol·L -1的氨水,下列判断正确的是( )。

第26讲弱电解质的电离平衡[高考评价要求]1.从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应,如酸碱性、导电性等。
2.认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。
3.能用化学用语正确表示水溶液中的离子反应与平衡,能通过实验证明水溶液中存在的离子平衡,能举例说明离子反应与平衡在生产、生活中的应用。
考点一弱电解质的电离平衡1.电离平衡的概念在一定条件(如温度、压强等)下,当弱电解质分子电离成离子的速率和离子结合成分子的速率相等时,电离过程达到平衡状态。
2.电离平衡的建立与特征(1)开始时,v(电离)最大,而v(结合)为0。
(2)平衡的建立过程中,v(电离)>v(结合)。
(3)当v(电离)=v(结合)时,电离过程达到平衡状态。
3.外界条件对电离平衡的影响(1)浓度:在一定温度下,同一弱电解质溶液,浓度越小,电离程度越大。
(2)温度:温度越高,电离程度越大。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。
(4)化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离的方向移动。
例如:以0.1 mol·L-1CH3COOH溶液为例,填写外界条件对CH3COOH CH3COO-+H+ΔH>0的影响。
改变条件平衡移动方向n(H+)c(H+)c(CH3COO-)电离程度加水稀释正向增大减小减小增大加冰醋酸正向增大增大增大减小通入HCl(g)逆向增大增大减小减小加醋酸钠固体逆向减小减小增大减小升高温度正向增大增大增大增大①稀醋酸加水稀释时,溶液中的各离子浓度并不是都减小,如c(OH-)是增大的。
②电离平衡右移,电解质分子的浓度不一定减小,如向稀醋酸中加入冰醋酸。
③电离平衡右移,离子的浓度不一定增大,电离程度也不一定增大。
题组一外界条件对电离平衡移动的影响1.25 ℃时不断将水滴入0.1 mol·L-1的氨水中,下列图像变化合理的是()答案:C2.已知人体体液中存在如下平衡:CO2+H2O H2CO3H++HCO-3,以维持体液pH的相对稳定。

第一节弱电解质的电离1.了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。
3.了解弱电解质在水溶液中的电离平衡。
(中频)弱电解质的电离平衡1.电离平衡的建立在一定条件(如温度、浓度)下,当弱电解质分子离解成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到了平衡。
2.电离平衡的特征3.外界条件对电离平衡的影响电离是一个吸热过程,主要受温度、浓度的影响。
以弱电解质CH 3COOH 的电离为例: CH 3COOHCH 3COO -+H +⎩⎪⎪⎨⎪⎪⎧平衡右移⎨升高温度加水稀释增大c (CH 3COOH )平衡左移降低温度增大c (H +)或c (CH 3COO -)电离平衡常数 1.表达式(1)对于一元弱酸HA :HA H++A-,平衡常数K=c(H+)·c(A-)c(HA);(2)对于一元弱碱BOH:BOH B++OH-,平衡常数K=c(B+)·c(OH-)c(BOH)。
2.意义相同条件下,K值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
3.特点(1)多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第一步电离。
1.易误诊断(正确的打“√”,错误的打“×”)。
(1)溶液导电能力弱的电解质一定是弱电解质( )(2)弱电解质浓度越大,电离程度越大( )(3)温度升高,弱电解质的电离平衡右移( )(4)0.1 mol/L某一元酸HA溶液的pH=3,HA溶液中存在:HA===H++A-( )(5)温度不变,向CH3COOH溶液中加入CH3COONa,平衡左移( )(6)电离平衡常数(K)越小,表示弱电解质电离能力越弱( )(7)不同浓度的同一弱电解质,其电离平衡常数(K)不同( )(8)电离平衡右移,电离平衡常数一定增大( )【答案】(1)×(2)×(3)√(4)×(5)√(6)√(7)×(8)×2.NH3·H2O在水溶液中的电离方程式为:__________________________,其电离常数表达式为:_____________________________________________。


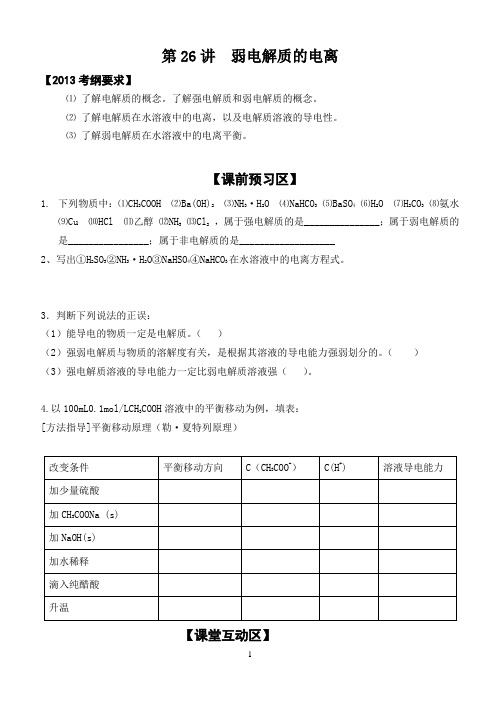
第26讲弱电解质的电离【2013考纲要求】⑴了解电解质的概念。
了解强电解质和弱电解质的概念。
⑵了解电解质在水溶液中的电离,以及电解质溶液的导电性。
⑶了解弱电解质在水溶液中的电离平衡。
【课前预习区】1.下列物质中:⑴CH3COOH ⑵Ba(OH)2⑶NH3·H2O ⑷NaHCO3 ⑸BaSO4 ⑹H2O ⑺H2CO3 ⑻氨水⑼Cu ⑽HCl ⑾乙醇⑿NH3⒀Cl2,属于强电解质的是_______________;属于弱电解质的是________________;属于非电解质的是___________________2、写出①H2SO3②NH3·H2O③NaHSO4④NaHCO3在水溶液中的电离方程式。
3.判断下列说法的正误:(1)能导电的物质一定是电解质。
()(2)强弱电解质与物质的溶解度有关,是根据其溶液的导电能力强弱划分的。
()(3)强电解质溶液的导电能力一定比弱电解质溶液强()。
4.以100mL0.1mol/LCH3COOH溶液中的平衡移动为例,填表:[方法指导]平衡移动原理(勒·夏特列原理)【课堂互动区】一、电离平衡常数常温下,有甲乙两份等体积的浓度均为0.1mol/L的氨水,pH=11。
该求该氨水的电离平衡常数及电离度_________________________________【归纳总结】(1)K a、K b反映了弱电解质的相对强弱。
(2)K a、K b、K w、K sp、K只与有关。
二、影响电离平衡的因素(见预习案中表格)【归纳总结】外界条件对弱电解质电离平衡的影响(见预习区表格)①浓度:同一弱电解质溶液,浓度越小,电离,电离度②温度:升温,电离,k ③同离子效应:电离④化学反应:电离(填“促进”or“抑制”)【例1】向冰醋酸中逐滴加水,导电能力随加水体积的变化曲线如下。
研究图中 a b c三点,探究如下问题:(1) 电离度最大的点是。
(2) n(H+)最大。
证对市爱幕阳光实验学校高三化学一轮复习:弱电解质的电离平衡学习目标:1.了解强、弱电解质与结构的关系,能正确书写常见物质的电离方程式。
2..理解弱电解质的电离平衡,以及温度、浓度条件对电离平衡的影响。
3.了解电离平衡常数及其用【旧知回忆】电解质和非电解质练习:1以下物质中Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、蔗糖、NaCl溶液、H2O、酒精。
_______ ___是电解质,___________是非电解质,___________既不是电解质,也不是非电解质。
2写出以下物质的电离方程式: NaOH ____________________ H2SO4:____________________ NaHCO3___________________NaHSO4:___________________注意:离子型的电解质在水溶液中或熔融状态下都可以导电,而共价型的电解质只有在水溶液中才能导电【知讲解】一、电解质的强弱1:强电解质与弱电解质的区别说明:1:电解质的强弱与溶解性无关。
2:电解质的强弱与日夜的导电性无关。
3: 电解质的强弱与化学键没有必然的联系。
练习:以下电解质中:NaCl、NaOH,NH3·H2O、CH3COOH,BaSO4,AgCl,Na2O,K2O,Na2O2_____________________________是强电解质____________________________是弱电解质⒉电离方程式的书写⑴强电解质用号:弱电解质用⑵多元弱酸分步电离,且第一步电离远远大于第二步电离,如碳酸:、⑶多元弱碱分步电离一步写完,如氢氧化铁:。
二、弱电解质的电离1.电离平衡:。
2.电离平衡的特征:①弱:只有才会存在电离平衡;②动:电离平衡是平衡;③:V电离 V结合〔填﹥,=或﹤〕④:条件一与的浓度一;⑤变:条件改变,破坏,发生移动。
3.弱电解质电离平衡的移动(1)弱电解质的电离平衡符合原理(2)影响弱电解质电离平衡的因素有:①温度:;②浓度:;③同离子反:参加与弱电解质具有相同离子的强电解质,将电离;④参加能反的物质,将电离。