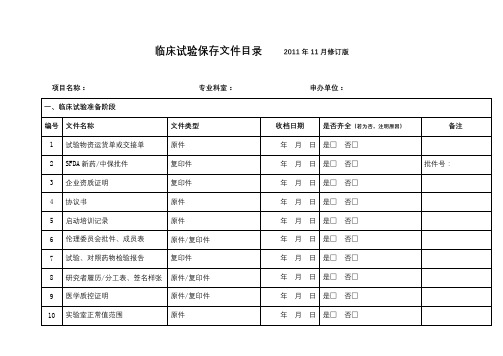
药物临床试验常用表11 试验项目主档案目录样版
- 格式:pdf
- 大小:147.30 KB
- 文档页数:16


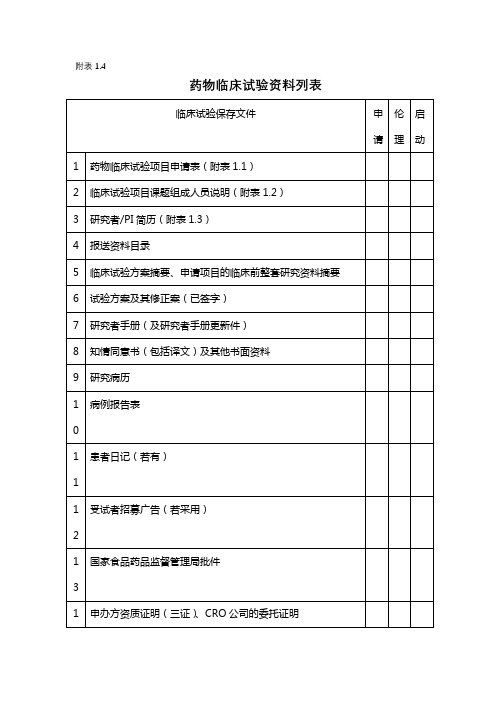
药物临床试验提交文件目录
1.研究者手册
2.试验方案及其修正案(已签名)(原件)
3.病例报告表(样表)/原始病历
4.知情同意书
5.受试者招募广告、患者日记卡及其它提供给受试者的书面文件
6.多方协议(已签名)及保险和赔偿措施或相关文件
7.伦理委员会批件/伦理委员会成员表
8.组长单位伦理委员会批件/伦理委员会成员表
9.国家食品药品监督管理局批件/申办方资质文件(营业执照/组织机构代码
/GMP证书等)
10.研究者履历及相关文件(签字)
11.临床试验有关的实验室检测正常值范围(实验室负责人或主要研究者签字)
12.医学或实验室操作的质控证明
13.试验用药品与试验相关物资的运货单
14.试验药物的药检证明
备注:1. 纸版文件均双面打印
2. 英文版资料刻光盘
3. 黑色两孔文件夹。

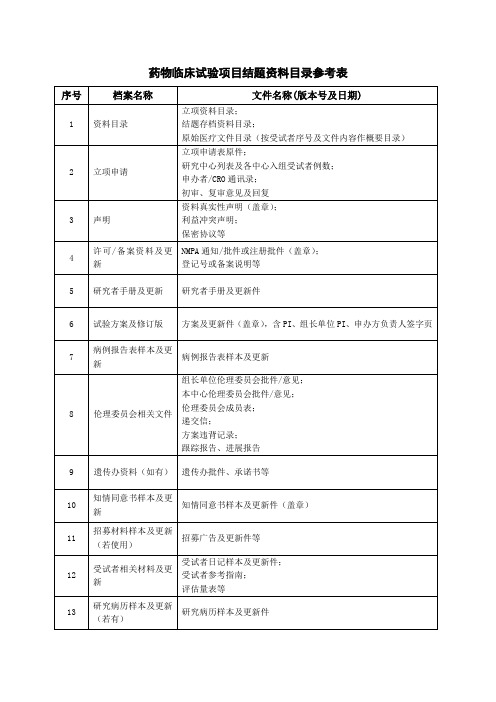
药物临床试验提供资料目录
1.临床试验申请表(需相关人员签名)
2.国家药品监督管理局批件/临床试验通知书
3.试验方案及修正案(申办方盖章+主要研究者签名)
4.知情同意书(样表)
5.其他提供给受试者的书面资料
6.病例报告表(样表)
7.研究者手册
8.招募受试者和向其宣传的程序性文件
9.受试者保险的相关文件(若有)
10.试验用药品的检验报告(试验药物和对照药品,按批次加
盖申办者红章)
11.试验用药品的包装盒标签样本
12.试验用药品管理相关表单(关注机构网页:试验用药物SOP)
13.申办者资质证明(三证、CRO公司营业执照,复印件加盖红
章)
14.委托书(如临床试验委托书、申办者对CRO的委托书)
15.研究者履历及相关文件(包括:简历、资质证书、GCP证书)
16.样表:受试者鉴认代码表、受试者筛选入选表等
17.遵守《中华人民共和国人类遗传资源管理条例》的承诺书
(P1签名)
18.其他相关文件。