法舒地尔杂质列表
- 格式:docx
- 大小:194.38 KB
- 文档页数:6


盐酸法舒地尔注射液说明书之答禄夫天创作盐酸法舒地尔注射液,适应症为改善和预防蛛网膜下腔出血术后的脑血管痉挛及引起的脑缺血症状.警示语本品只可静脉点滴使用,不成采纳其它途径给药.成分化学名称:六氢1(5磺酰基异喹啉)1(H)1,4二氮杂䓬盐酸盐化学结构式:分子式:C14H17N3O2S·HCl分子量:327.83性状本品为无色或微黄色的澄明液体.适应症改善和预防蛛网膜下腔出血术后的脑血管痉挛及引起的脑缺血症状.规格2ml:30mg用法用量成人一日2—3次,每次30mg,以50100ml的生理盐水或葡萄糖注射液稀释后静脉点滴,每次静滴时间为30分钟.本品给药应在蛛网膜下腔出血术后早期开始,连用2周.不良反应l. 有时会呈现颅内出血(1.63%).2. 有时会呈现消化道出血、肺出血、鼻出血、皮下出血(0.29%)等出血,注意观察,若呈现异常,应停药并予以适当处理.3. 循环系统:偶见低血压、颜面潮红.4. 血液系统:偶见贫血、白细胞减少、血小板减少.5. 有时会呈现肝功能异常.AST(GOT)、ALT(GPT)、ALP、LDH升高等.6. 泌尿系统:偶见肾功能异常(BUN、肌酐升高等)、多尿.7. 消化系统:腹胀、恶心、呕吐等较少见.8. 过敏症:偶见皮疹等过敏症状.9. 其他:发热(偶见)、头痛、意识水平低、呼吸抑制(少见).禁忌下述患者禁用本品:1.出血患者:颅内出血.2. 可能发生颅内出血的患者:术中对出血的动脉瘤未能进行充沛止血处理的患者.3. 低血压患者.注意事项1. 本品只可静脉点滴使用,不成采纳其它途径给药(下述患者应慎重用药);(1)术前合并糖尿病的患者、术中在主干动脉有动脉硬化的患者,使用本剂时,应充沛观察临床症状及计算机断层摄影,若发现颅内出血,应速停药并予以适当处理;(2)肾功能障碍的患者(例如,1次10 mg);(3)肝功能障碍的患者(有可能延迟代谢,使血药浓度升高而增强作用);(4)严重意识障碍的患者(使用经验少,尚未确立有效性);(5)70岁以上的高龄患者(对预后功能的改善可能无效,尚未确立有效性);(6)蛛网膜下腔出血合偏重症脑血管障碍(烟雾病、巨年夜脑动脉瘤等)的患者(无使用经验,尚未确立有效性及平安性).2. 本品使用时,应密切注意临床症状及CT改变、若发现颅内出血,应立即停药并进行适当处理.3. 本品可引起低血压,因此在用药过程中应注意血压变动及给药速度.4. 本品的用药时间为2周,不生长期使用.孕妇及哺乳期妇女用药妊娠或可能妊娠妇女及哺乳期妇女应防止使用.儿童用药尚未确立儿童用药的平安性.老年用药70岁以上的高龄患者应慎用.药物相互作用无与本项相关的陈说.药物过量目前尚未过量的报道.药理毒理药理作用盐酸法舒地尔抑制平滑肌收缩最终阶段的肌球卵白轻链磷酸化,使血管扩张.1. 脑血管痉挛的缓解及预防作用向犬颅内两次注入自身血引起迟发性脑血管痉挛,静脉注射给予盐酸法舒地尔可缓解脑血管痉挛.早期连续给药可预防脑血管痉挛的发生.2. 脑血流改善作用(1)改善犬迟发性脑血管痉挛模型的年夜脑皮质血流.(2)对两侧颈总动脉闭塞引起的年夜鼠脑缺血模型,可增加缺血部位的脑局部血流量.(3)对脑血流量减少的患者,用正电子发射CT(PAT)定量测定脑缺血部位的血流量,结果脑血流量增加.3. 脑葡萄糖利用率的改善作用对两侧颈总动脉闭塞引起的年夜鼠脑缺血模型,可部份增加脑局部葡萄糖利用率.4.脑神经细胞损伤的抑制作用可抑制一过性两侧颈总动脉闭塞引起的沙鼠脑缺血模型的迟发性神经细胞损伤.5.作用机理(体外实验)(1)使离体脑血管松弛.(2)抑制因钙离子引起的离体血管的收缩.(3)抑制多种脑血管收缩药物引起的收缩作用.(4)抑制细胞内钙离子招致的血管收缩.此时,不会降低细胞内钙浓度.(5)抑制血管收缩时肌球卵白轻链磷酸化物的生成.在试管内构成与体内相似条件时,同样呈现抑制肌球卵白轻链磷酸化酶的效果.毒理研究重复给药毒性:年夜鼠、猴分别静脉内给药6个月,主要毒性暗示为自主活动减少、腹卧位.本品的毒性靶器官为肾脏,可见肾脏重量增加、肾小管变性、间质水肿等.无毒剂量年夜鼠为9 mg/㎏,猴为3.125 mg/㎏(以mg/㎡计分别相当于人临床最年夜推荐剂量的1和0.69倍).遗传毒性:细菌回复突变试验、啮齿类植物微核试验结果均为阴性,哺乳植物细胞染色体畸变试验未发现致突变作用.生殖毒性:年夜鼠1段生殖毒性实验显示,静脉给予本品1.56、6.25和 25 mg/㎏,25 mg/㎏组亲代植物体重增加受抑制、黄体数及着床数减少.交配率、受孕率及胚胎发生未见异常.对亲代植物的无毒剂量为 6.25 mg/㎏;年夜鼠Ⅱ段生殖毒性试验,静脉给予本品1.6、8和 40 mg/㎏,40 mg/㎏组母体植物体重增加受抑制、胎仔体重偏低、新生仔体重增加受抑制,未发现对胎仔的致死作用及致畸作用,对子代无毒剂量为8 mg/㎏.家兔Ⅱ段生殖毒性试验显示,静脉给予本品0.7、2和 6 mg/㎏(分别相当于人临床最年夜推荐剂量的0.16、0.44和 1.33倍),未见对胚胎发育有显著影响.年夜鼠Ⅲ段生殖毒性试验,静脉给予本品 1.6、8和40 mg/㎏,40 mg/㎏组母体植物一般状态不良,新生仔体重增加受抑制.无毒剂量为8 mg/㎏.药代动力学据国外文献资料报道1.健康成人单次30分钟内静脉继续给予盐酸法舒地尔0.4 mg/㎏时,血浆中原形药物浓度在给药结束时达峰值,其后迅速衰减,消除半衰期约为16分钟.盐酸法舒地尔主要在肝脏代谢为羟基异喹啉及其络合体.给药后24小时内从尿中累积排泄的原形药物及其代谢产物为给药剂量的67%.2.在蛛网膜下腔出血术后的患者,反复静脉滴注盐酸法舒地尔30mg,1日3次,共14日的血浆中浓度变动,与健康成人类似.贮藏遮光,密闭保管.包装低硼硅玻璃安瓿,每盒3支、6支、10支有效期24个月.执行标准。


高效液相色谱法测定盐酸法舒地尔原料药及注射液的含量周建玉;王卫【期刊名称】《中国药业》【年(卷),期】2014(000)012【摘要】目的:采用高效液相色谱(HPLC)法测定盐酸法舒地尔原料药及注射液的含量。
方法采用 Phenomenex Prodigy ODS C18(2)100A (150 mm ×4.6 mm,5μm)色谱柱,以1.0%三乙胺水溶液(用磷酸调 pH 至7.0)-甲醇(50:50)为流动相,流速为0.8 mL / min,柱温为40℃,检测波长为275 nm,进样量为20μL。
结果盐酸法舒地尔质量浓度在3~60μg / mL 范围内与其峰面积呈良好线性关系,线性方程为 A =1.93×104 C -1.73×103,r =0.9999( n =7);平均回收率为99.50%,RSD 为0.87%( n =9)。
结论该方法简便、精密、回收率高,重现性好,可用于盐酸法舒地尔原料药及注射液的含量测定。
%Objective To establish a HPLC method to determine the content of fasudil hydrochloride raw material drug and Fasudil Hy-drochloride Injection. Methods The Phenomenex Prodigy ODS C18(2) 100A column (150 × 4. 6mm,5μm) was adopted,the mobile phase was 1. 0% - triethylamine aqueous solution(adjusting to pH 7. 0 with phosphoric acid)- methanol(50 : 50),the flow rate was 0. 8 mL / min,the column temperature was 40℃ and detecting wave length was 275 nm. Results The mass concentration of fasudil hy-drochloride in the range of 3 - 60 μg / mL( r = 0. 999 9,n = 7)had good linear correlation with the area of the test peak,the linear e-quation was A = 1. 93 × 104 C - 1. 73 × 103,r = 0. 9999( n = 7);the average recovery rate was 99. 49%( n = 9,RSD = 0. 8% ). Conclusion The method is simple and precise with high recovery rate and good reproducibility,which can be used for the determination of the con-tent of fasudil hydrochloride raw material drug and Fasudil Hydrochloride Injection.【总页数】3页(P64-66)【作者】周建玉;王卫【作者单位】天津市药品检验所,天津 300070;天津市药品检验所,天津 300070【正文语种】中文【中图分类】R927.2;R971【相关文献】1.紫外-可见分光光度法测定盐酸法舒地尔注射液中盐酸法舒地尔的含量 [J], 吕洁;孟祥军;邹春阳2.高效液相色谱法检测盐酸法舒地尔注射液的含量 [J], 高亚春;张东明3.高效液相色谱法测定盐酸法舒地尔中间体的含量 [J], 张亚梅;王国伟;刘璐4.高效液相色谱法测定盐酸法舒地尔中间体的含量 [J], 张亚梅;王国伟;刘璐5.用HPLC法测定盐酸法舒地尔注射液中盐酸法舒地尔的含量 [J], 乐健;石宽;闻俊;洪战英因版权原因,仅展示原文概要,查看原文内容请购买。
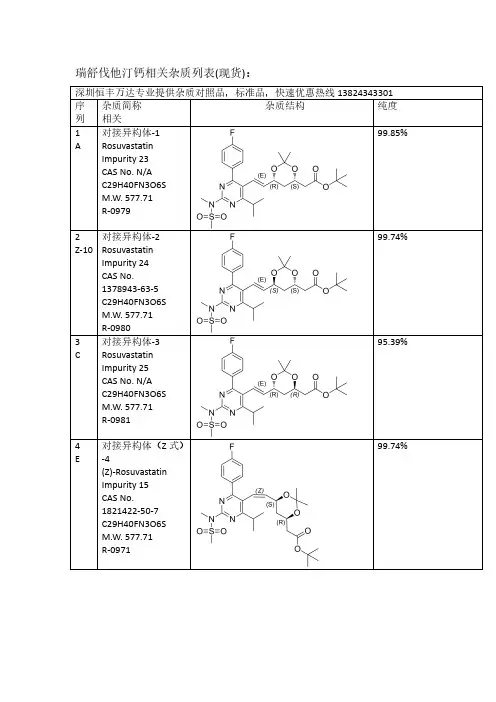
瑞舒伐他汀钙相关杂质列表(现货):深圳恒丰万达专业提供杂质对照品,标准品,快速优惠热线138****3301序列杂质简称相关杂质结构纯度1A 对接异构体-1RosuvastatinImpurity 23CAS No.N/A C29H40FN3O6S M.W.577.71R-097999.85%2Z-10对接异构体-2RosuvastatinImpurity 24CAS No.1378943-63-5C29H40FN3O6S M.W.577.71R-098099.74%3C 对接异构体-3RosuvastatinImpurity 25CAS No.N/A C29H40FN3O6S M.W.577.71R-098195.39%4E对接异构体(Z 式)-4(Z)-Rosuvastatin Impurity 15CAS No.1821422-50-7C29H40FN3O6S M.W.577.71R-097199.74%5Q对接光降解-1CAS No.N/A C29H40FN3O6S M.W.577.71R-099099.31%6P对接光降解-2CAS No.N/A C29H40FN3O6S M.W.577.71R-099299.69%7I丙酮加合物CAS No.N/A C32H46FN3O7S M.W.635.7998.23%8Z-12对接脱氟CAS No.N/AC29H41N3O6S M.W.559.72R-099399.46%9Z-16双键环氧脱丙酮叉CAS No.N/AC29H40FN3O7S M.W.593.7199.18%10B脱丙酮叉异构体-1ent-Rosuvastatin tert-Butyl Ester CAS No.615263-60-0C26H36FN3O6S M.W.537.65R-091899.90%11Z-11脱丙酮叉异构体-2(3S,5S)-Rosuvastatintert-Butyl Ester CAS No.2185805-16-5C26H36FN3O6S M.W.537.65R-097699.66%12D 脱丙酮叉异构体-3(3R,5R)-tert-ButylRosuvastatin (Rosuvastatin Impurity)CAS No.2162136-65-2C26H36FN3O6S M.W.537.65R-0911100%13F 脱丙酮叉异构体(Z 式)-4CAS No.1821422-51-8C26H36FN3O6S M.W.537.65R-099699.44%14S脱丙酮叉光降解-1CAS No.N/A C26H36FN3O6S M.W.537.65R-098999.61%15R脱丙酮叉光降解-2CAS No.N/A C26H36FN3O6S M.W.537.65R-099199.20%16J丙酮加合物脱丙酮叉Rosuvastatin EP Impurity A CAS No.1714147-49-5C29H42FN3O7S M.W.595.72R-099799.65%17Z-13无氟脱丙酮叉CAS No.N/AC26H37N3O6S M.W.519.65R-099599.17%18Z-255-甲氧基脱叉杂质RosuvastatinImpurity 42CAS No.N/A C27H38FN3O6S M.W.551.67R-0910098.80%19Z-263-甲氧基脱叉杂质RosuvastatinImpurity 47CAS No.N/A C27H38FN3O6S M.W.551.67R-0910598.65%203,5-二甲氧基脱叉杂质Rosuvastatin Impurity 44CAS No.N/A C28H40FN3O6S M.W.565.70R-0910698%21G钙盐异构体-1Rosuvastatin EP Impurity G Calcium Salt CAS No.1242184-42-4(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.0499.88%22Z-1钙盐异构体-2(3S,5S)Rosuvastatin Calcium Salt CAS No.1584149-34-7(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.04R-091598.15%23H钙盐异构体-3Rosuvastatin EP Impurity B Calcium Salt(3R,5R)-Rosuvastatin Calcium Salt CAS No.1422515-55-61094100-06-7(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.04R-091296.13%24V钙盐异构体(Z 式)-4Rosuvastatin Z-Isomer Calcium Salt CAS No.1444772-08-01445208-17-2(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.0499.51%25Z-245-甲氧基钠盐CAS No.N/AC23H29FN3NaO6S M.W.517.5599.50%26Z-273-甲氧基钠盐CAS No.N/AC23H29FN3NaO6S M.W.517.5596.83%27Z-293,5-二甲氧基钠盐CAS No.N/AC24H31FN3NaO6S M.W.531.5797.78%28U钙盐异构体光降解-5RosuvastatinImpurity 1Calcium Salt CAS No.854898-49-0854898-48-9(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.0499.75%29T 钙盐异构体光降解-6RosuvastatinImpurity 2Calcium Salt CAS No.854898-50-3854898-53-6(free base)C22H27FN3O6S.1/2Ca M.W.480.5420.0499.83%30Z-18钠盐异构体光降解-7(混合物)RosuvastatinImpurity 1Calcium SaltCAS No.N/A C22H27FN3O6S.1/2Ca M.W.480.5420.04R-093499.16%31Z-20钙盐异构体光降解-8Rosuvastatin Impurity CAS No.N/A C22H26FN3O6S M.W.479.5296.69%32Z-14钙盐无氟DesfluoroRosuvastatin Calcium Salt CAS No.N/A847849-66-5(acid)C22H28N3O6S.1/2Ca M.W.462.5420.04R-099499.78%33K 丙酮加合物钙盐Rosuvastatin EPImpurity A Calcium Salt CAS No.1714147-47-31715120-13-0(free acid)C25H33FN3O7S.1/2Ca M.W.538.6120.04R-092599.46%34M 内酯Rosuvastatin EPImpurity D CAS No.503610-43-3C22H26FN3O5S M.W.463.52R-09199.46%35N 内酯异构体CAS No.N/AC22H26FN3O5S M.W.463.5299.46%36内酯异构体CAS No.N/A C22H26FN3O5S M.W.463.5297%37Z-283-甲氧基内酯CAS No.N/AC23H28FN3O5S M.W.477.5598.97%38L5-氧代Rosuvastatin EP Impurity C freed acid CAS No.1620823-61-1(sodium salt)1422619-13-3(acid)C22H26FN3O6S M.W.479.5297.92%39Z-63-氧代3-Oxo Rosuvastatin Sodium Salt CAS No.1346606-28-71346747-49-6(acid)C22H25FN3O6S.Na M.W.478.5222.99R-091798.61%40O内酯脱水Rosuvastatin2,6-Diene Lactone Impurity CAS No.1246665-85-9C22H24FN3O4S M.W.445.5299.36%R-094141Z-44,6-二烯Rosuvastatin4,6-Diene Impurity CAS No.1422954-13-9C22H26FN3O5S M.W.463.53R-092795.44%42Z-152,6-二烯CAS NO.1422954-12-8(free acid)C22H26FN3O5S R-092695.70%43Z-8脱甲基二钠盐(体内代谢产物)N-Desmethyl Rosuvastatin Disodium Salt CAS No.371775-74-5(free base)C21H24FN3O6S.2Na M.W.465.50222.99R-09598.87%44W光降解内酯CAS No.854898-47-8C22H26FN3O5S M.W.463.5299.80%45X 光降解内酯CAS No.854898-46-7C22H26FN3O5S M.W.463.5297.84%46Z-2Z 式异构体内酯CAS No.N/A C22H26FN3O5S M.W.463.5296.52%47Z-9脱甲基内酯(体内代谢产物)N-Desmethyl Rosuvastatin Lactone CAS:1797419-58-9C21H24FN3O5S M.W.449.5097.42%48Z-7基因毒性杂质(体内代谢产物)Rosuvastatin Impurity 28CAS No.N/A C22H28FN3O7S M.W.497.54R-098498.94%49Z-5母核烯醛(工艺相关杂质)CAS No.890028-66-7C18H20FN3O3S M.W.377.4398.85%50Z-42母核无氟膦盐CAS No.N/A C34H35BrN3O2PS M.W.660.6099.14%51Y 本体脱丙酮叉CAS No.N/A C26H36FN3O6S M.W.537.6599.74%更多其他项目:雷西纳德,阿格列汀,依鲁替尼,唑吡坦,利奈唑胺,西他沙星,沙丁胺醇,罗替戈汀,丙戊酸钠,左乙拉西坦,西格列汀,特地唑胺,帕瑞昔布钠,帕布昔利布,赛乐西帕,伏硫西汀,曲格列汀,米拉贝隆,沙芬酰胺,达泊西汀,吡格列酮,达泊西汀,吉非替尼,去甲肾上素,阿昔洛韦,文拉法辛,普拉洛芬,普拉克索,曲唑酮,茚达特罗,阿扎胞苷,酮替芬,依折麦布,西那卡塞,氨曲南,替诺福韦,厄多司坦,孤法辛,雷贝拉唑,阿法替尼,依达拉奉,帕利哌酮,达比加群酯,鲁拉西酮,尼非卡兰,瑞巴派特,苯达莫司汀,利伐沙班,法舒地尔,普拉格雷,维格列汀,索非布韦,文拉法辛等。



HPLC法测定盐酸法舒地尔注射液中盐酸法舒地尔的含量【中图分类号】r97 【文献标识码】a 【文章编号】1672-3783(2013)03-0271-02盐酸法舒地尔注射液国家食品药品监督管理局国家药品标准中含量测定所用的方法为紫外-可见分光光度法,高效液相色谱方法与紫外-可见分光光度法相比,能使主药与辅料能有效分离,避免辅料对含量测定的干扰,使检测结果更准确,所以将含量方法改为高效液相色谱法。
1 仪器与试药:岛津 spd-10a vp紫外检测器;岛津spd-m10a vp 二极管阵列检测器;岛津 lc-15c 溶剂泵;岛津lc-10at vp 溶剂泵;岛津 lcsolution 15c色谱工作站;岛津 lcsolution色谱工作站。
盐酸法舒地尔对照品(中国药品生物制品检定所,批号:100614-200401),盐酸法舒地尔注射液(天津红日药业,规格为2ml:30mg);甲醇为色谱纯,其他试剂均为分析纯。
2 方法2.1 色谱条件:色谱柱:phenomenex c18 (250×4.60mm,gemini 5μ c18 110 );柱温:25℃;流速:1.0ml/min;检测波长:275nm;运行时间:12min;进样体积:20μl;流动相:1.0%三乙胺水溶液(用磷酸调ph值至7.0):甲醇(55:45);系统适用性要求:理论板数按盐酸法舒地尔峰计算应不低于6600。
2.2 对照品溶液的配置:取盐酸法舒地尔对照品约30mg,精密称定,至100ml量瓶中,加流动相溶解并稀释至刻度,摇匀。
2.3 供试品的配置:精密量取各批市售品2ml至100ml量瓶,加流动相稀释至刻度,摇匀。
2.4 测定法:精密量取对照品溶液及供试品溶液20μl注入液相色谱仪,记录色谱图。
按外标法以峰面积计算,即得。
3 方法学研究3.1 波长的选择为了准确的测定盐酸法舒地尔的含量,参考国家药品标准“盐酸法舒地尔”有关物质项下的检测波长,并取本品及各步反应中间体进行uv光谱分析,结果可知除了高哌嗪对紫外无吸收外,在275nm 波长处,5-异喹啉磺酸、中间体及盐酸法舒地尔均有最大吸收。
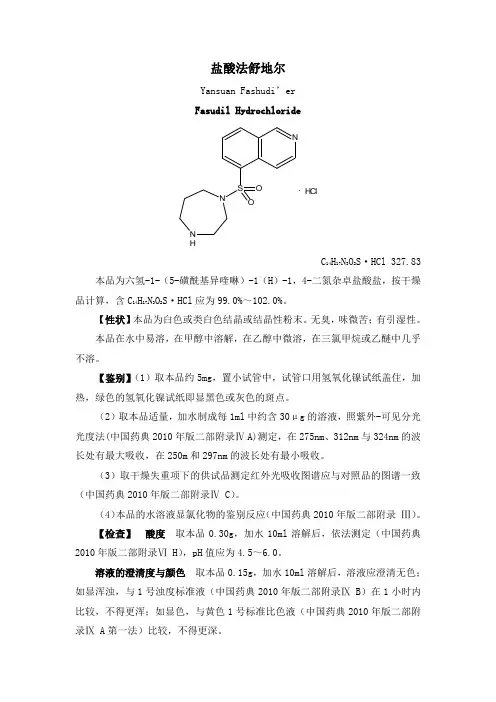
盐酸法舒地尔Yansuan Fashudi’er Fasudil HydrochlorideNS NO ONH.HClC 14H17N3O2S·HCl327.83本品为六氢-1-(5-磺酰基异喹啉)-1(H)-1,4-二氮杂卓盐酸盐,按干燥品计算,含C14H17N3O2S·HCl应为99.0%~102.0%。
【性状】本品为白色或类白色结晶或结晶性粉末。
无臭,味微苦;有引湿性。
本品在水中易溶,在甲醇中溶解,在乙醇中微溶,在三氯甲烷或乙醚中几乎不溶。
【鉴别】(1)取本品约5mg,置小试管中,试管口用氢氧化镍试纸盖住,加热,绿色的氢氧化镍试纸即显黑色或灰色的斑点。
(2)取本品适量,加水制成每1ml中约含30μg的溶液,照紫外-可见分光光度法(中国药典2010年版二部附录ⅣA)测定,在275nm、312nm与324nm的波长处有最大吸收,在250m和297nm的波长处有最小吸收。
(3)取干燥失重项下的供试品测定红外光吸收图谱应与对照品的图谱一致(中国药典2010年版二部附录Ⅳ C)。
(4)本品的水溶液显氯化物的鉴别反应(中国药典2010年版二部附录Ⅲ)。
【检查】酸度取本品0.30g,加水10ml溶解后,依法测定(中国药典2010年版二部附录Ⅵ H),pH值应为4.5~6.0。
溶液的澄清度与颜色取本品0.15g,加水10ml溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液(中国药典2010年版二部附录Ⅸ B)在1小时内比较,不得更浑;如显色,与黄色1号标准比色液(中国药典2010年版二部附录Ⅸ A第一法)比较,不得更深。
有关物质取本品适量,加流动相制成每1ml中约含0.2mg的溶液,作为供试品溶液,精密量取1ml,置100ml量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液;照含量测定项下的色谱条件,取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%~20%;再精密量取供试品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。

基因毒性⼩册⼦基因毒性⼩册⼦Contents吗多明中吗啉的测定 (2)噻托溴铵中杂质离⼦的测定 (3)左⼄拉西坦中四丁基铵的测定 (4)盐酸法舒地尔中⾼哌嗪的含量测定 (5)苯甲酸阿格列汀中3-氨基哌啶的测定 (6)盐酸⽶诺环素中三⼄胺的测定 (7)坎地沙坦酯中羟胺的测定 (8)头孢曲松中甲基肼的测定 (9)重组⼈胰岛素中微量⼄醇胺的测定 (10)⽶氮平中⼆⼄基⼄醇胺的分析 (11)利培酮中羟胺、2-羟⼄基肼、肼的分析 (12)维格列汀中⾦刚烷胺的分析 (13)雷沙吉兰中羟胺的分析 (14)盐酸帕洛诺司琼中的(S)-(-)-3-氨基奎宁环胺双盐酸盐的分析 (15)考来维仑中有机胺类有关物质的分析 (16)安乃近中⼆甲氨基⼄醇的分析 (17)替加环素中叔丁胺的测定 (18)多肽中三氟⼄酸的测定 (19)疫苗中氰根的测定 (20)药物中叠氮根的测定 (21)药品中甲磺酸和三氟甲磺酸的测定 (22)吗多明中吗啉的测定1.简介吗多明是临床常⽤的预防⼼绞痛药物。
作为⼀种钙拮抗剂,吗多明可扩张⾎管平滑肌,减轻⼼脏⼯作负荷,减少⼼肌氧耗,且能扩张冠状动脉,促进侧枝循环,改善缺⾎⼼肌缺⾎。
在吗多明⽣产的起始原料中⽤到了吗啉。
吗啉是⼯业⽤重要环胺之⼀,由于其具有氮氧杂环的结构特点,在医药⽅⾯被⼴泛⽤于⽣产病毒灵、布洛芬、咳必定等多种药物的合成。
吗啉对黏膜、上呼吸道、眼睛、⽪肤等有强烈的刺激性,对⼈体有较⼤伤害,必须严格控其制成药中的残留量。
⽬前测定吗啉最常见的⽅法为⽓相⾊谱法,但由于吗啉极性较⼤,使⽤⽓相⾊谱法存在担体处理、⾊谱柱寿命等问题,且其灵敏度较低,⽆法满⾜质控要求。
吗啉的结构中含有伯胺,酸性条件下在阳离⼦交换⾊谱柱上保留良好,且在电导检测器上有⾮常灵敏的响应。
离⼦⾊谱电导法⽤于吗多明中吗啉的残留监测,结果准确可靠。
2. 实验部分Thermo Fisher Dionex ICS 5000+,AS-AP⾃动进样器;甲基磺酸(Fisher,99%),ThermoScientific Barnstead GenPure Pro超纯⽔;⾊谱柱:;IonPac CS16(5×250mm)保护柱:Ionpac? CG16(5×50 mm);检测器:抑制电导检测;⾊谱图:图1 吗多明中吗啉的测定⾊谱图1-吗啉噻托溴铵中杂质离⼦的测定1.简介噻托溴铵由德国柏林格殷格翰公司研发,与辉瑞公司共同销售,2002年6⽉在荷兰和菲律宾⾸次上市。
第28卷,第4期光 谱 实 验 室V o l.28,N o.4 2011年7月Ch inese J ou rnal of S p ectroscop y L aboratory July,2011HPLC测定盐酸法舒地尔的有关物质葛欣 孟祥军① 李娜然(沈阳医学院化学教研室 沈阳市皇姑区黄河北大街146号 110034)摘 要 建立H PL C测定盐酸法舒地尔的有关物质。
采用C18色谱柱,以甲醇2磷酸二氢铵溶液(30∶70,用磷酸调pH值至3.5±0.05)为流动相;检测波长为275nm。
盐酸法舒地尔检测限为0.3m g mL,主成分峰与其有关物质能完全分离。
本方法简便、准确、专属性好,可用于盐酸法舒地尔有关物质的测定。
关键词 盐酸法舒地尔;有关物质;高效液相色谱法中图分类号:O657.7+2 文献标识码:B 文章编号:100428138(2011)04219082031 引言盐酸法舒地尔(Fasudil hydroch l o ride)是一种具有广泛药理作用的新型药物,它的分子结构为52异喹啉磺酰胺衍生物,为RHO激酶抑制物。
临床上主要应用于多种原因引起的缺血性脑血管疾病[1]。
盐酸法舒地尔原料在合成过程中存在有关杂质,为此,本研究参考新药转正标准W S12(X2111)22006Z盐酸法舒地尔及相关文献[2—4],通过方法学验证,建立了盐酸法舒地尔中对有关物质的H PL C,以对盐酸法舒地尔进行更有效的内在质量控制。
2 实验部分2.1 仪器与试剂L C210A tvp高效液相色谱仪(日本岛津公司);N2000色谱工作站(杭州赛尔泰科技有限公司)。
盐酸法舒地尔对照品(批号1006142200401,含量99.5%,中国药品生物制品检定所);盐酸法舒地尔(原料药,湖北黄石世星制药有限公司,批号20080601,20080602,20080603);甲醇(色谱纯);磷酸二氢铵(分析纯);其他试剂均为分析纯。