6.2 溶液组成的表示
- 格式:ppt
- 大小:12.33 MB
- 文档页数:33

第六章《溶解现象》6.1 物质在水中的分散一.溶解与乳化1.泥土以细小固体颗粒形式分散到水中,形成悬浊液2.食用油以小液滴形式分散到水中,形成乳浊液3.溶解:物质以分子或离子形式均匀分散到另一种物质中的过程4.溶液:物质溶解后形成的均一、稳定的混合物⑴均一、稳定的液体不一定是溶液。
如:水⑵溶液不一定无色。
如:KMnO4溶液紫红色,含Fe2+溶液浅绿色,含Fe3+溶液黄色,含Cu2+溶液蓝色5.乳化:乳化剂(洗洁精、肥皂)作用下,油以小液滴形式均匀的分散在水中,形成稳定的乳浊液。
[汽油去除油脂的原理是溶解]二.物质溶解过程中的能量变化1.氢氧化钠(NaOH)溶于水,放热,温度升高2.硝酸铵(NH4NO3)溶于水,吸热,温度降低3.氯化钠(NaCl)溶于水,温度不变三.水溶液的某些性质1.水溶液的凝固点降低(低于0℃)、沸点升高(高于100℃)2.某些水溶液具有导电性,因为溶液中含有自由移动的离子示例:稀硫酸能导电,因为溶液中含有自由移动的H+和SO42-;氯化钠溶液能导电,因为溶液中含有自由移动的Na+和Cl-[蔗糖溶液不能导电:蔗糖以分子形式分散在水中;氯化钠固体不能导电:Na+和Cl-不能自由移动]6.2 溶液组成的表示一.溶液的组成1.溶液组成溶液由溶质和溶剂组成被溶解的物质称为溶质,溶质可以是固体、液体、也可以是气体溶解溶质的物质称为溶剂,最常用的溶剂是水,汽油、酒精也可作溶剂1.溶质质量分数计算公式:(溶质质量÷溶液质量)×100%注:饱和溶液的溶质质量分数可以根据溶解度计算:S÷(100+S),S越大,值越大2.溶液配制⑴步骤:计算、称量、溶解⑵仪器:天平、量筒、胶头滴管、烧杯、玻璃棒⑶操作注意①称固体时,注意遵循左物右码。
[若颠倒,实际称量= 砝码质量-游码质量] ②量水时,视线与凹液面最低处相平。
[仰视量取量多,俯视量取量少] ③溶解不可用量筒 3.溶液稀释含义:向溶液中加水,使浓溶液变成稀溶液 ⑴步骤:计算、量取、溶解计算方法:①稀释前后,溶质质量不变②加入水的质量 = 稀溶液质量 - 浓溶液质量 ⑵仪器:量筒、胶头滴管、烧杯、玻璃棒6.3 溶解性一.溶解性的影响因素1.溶质的性质。


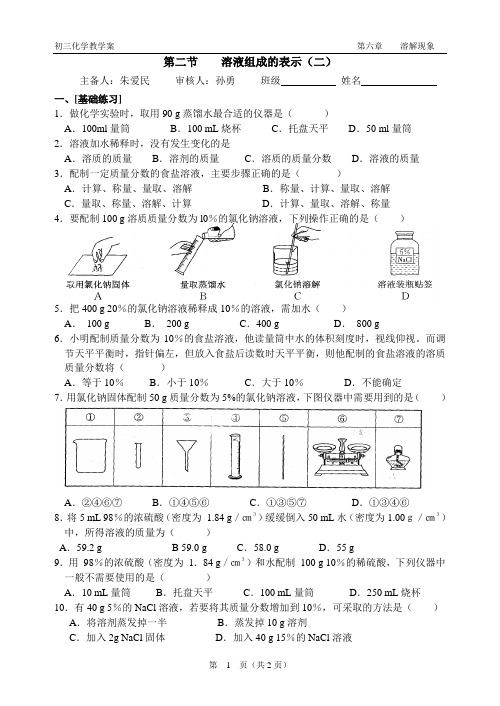
初三化学教学案第六章溶解现象第二节溶液组成的表示(二)主备人:朱爱民审核人:孙勇班级姓名一、[基础练习]1.做化学实验时,取用90 g蒸馏水最合适的仪器是()A.100ml量筒B.100 mL烧杯C.托盘天平D.50 ml量筒2.溶液加水稀释时,没有发生变化的是A.溶质的质量B.溶剂的质量C.溶质的质量分数D.溶液的质量3.配制一定质量分数的食盐溶液,主要步骤正确的是()A.计算、称量、量取、溶解B.称量、计算、量取、溶解C.量取、称量、溶解、计算D.计算、量取、溶解、称量4.要配制100 g溶质质量分数为l0%的氯化钠溶液,下列操作正确的是()5.把400 g 20%的氯化钠溶液稀释成10%的溶液,需加水()A.100 g B.200 g C.400 g D.800 g6.小明配制质量分数为10%的食盐溶液,他读量筒中水的体积刻度时,视线仰视。
而调节天平平衡时,指针偏左,但放入食盐后读数时天平平衡,则他配制的食盐溶液的溶质质量分数将()A.等于10%B.小于10%C.大于10%D.不能确定7.用氯化钠固体配制50 g质量分数为5%的氯化钠溶液,下图仪器中需要用到的是()A.②④⑥⑦B.①④⑤⑥C.①③⑤⑦D.①③④⑥8.将5 mL 98%的浓硫酸(密度为1.84 g/㎝3)缓缓倒入50 mL水(密度为1.00g/㎝3)中,所得溶液的质量为()A.59.2 g B 59.0 g C.58.0 g D.55 g9.用98%的浓硫酸(密度为1.84 g/㎝3)和水配制100 g 10%的稀硫酸,下列仪器中一般不需要使用的是()A.10 mL量筒B.托盘天平C.100 mL量筒D.250 mL烧杯10.有40 g 5%的NaCl溶液,若要将其质量分数增加到10%,可采取的方法是()A.将溶剂蒸发掉一半B.蒸发掉10 g溶剂C.加入2g NaCl固体D.加入40 g 15%的NaCl溶液学问二字,须要拆开看,学是学,问是问2011-11-29 11.电解水时,常在水中加入少量硫酸以增强水的导电性,若用8%的硫酸100 g通直流电电解,过一段时间后,硫酸的溶质质量分数为10%,则被电解的水的质量为()A.10g B.20 g C.25 g D.30 g12.将100g含水量为96%的KMnO4溶液稀释成含水量为98%的溶液,需加水的质量为()A.100 g B.50 g C.2g D.无法计算13.实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液。


第2节溶液组成的表示第1课时溶液的组成与溶液浓度的表示知识点1溶液的组成1.下列有关溶液的说法错误的是()A.溶液一定是无色透明的B.溶液由溶质和溶剂组成C.溶质可以是固体、液体和气体D.溶液质量等于溶质质量与溶剂质量之和2. 下列常见的医用溶液中,溶剂不是水的是,常温下溶质是液体的是。
A.葡萄糖注射液B.生理盐水C.消毒酒精D.碘酒3.下列可以作为溶质的是()A.只有固体B.只有液体C.只有气体D.固体、液体或气体4.把少量白磷溶于二硫化碳(一种液态有机物)中制成溶液,其中是溶质,____________是溶剂,这种溶液被称作溶液。
5.请你各举出一个实例,说明下列有关溶液的叙述是错误的。
(1)溶液中的溶质只能是一种。
实例:________是溶液,但其溶质不是一种。
(2)溶液中的溶质一定都是固体。
实例:________可作溶质,但不是固体。
(3)溶液中的溶剂一定是水。
实例:________中________是溶剂,而不是水。
6.请将下列溶液中的溶质和溶剂填写在下表中。
A.75%的酒精溶液B.稀盐酸C.澄清石灰水D.碘酒E.硫酸铜溶液F.镁和稀硫酸恰好完全反应后所形成的溶液知识点2溶质的质量分数7.对“溶质质量分数为10%的氯化钠溶液”含义的解释错误的是()A.100 g水中溶解了10 g氯化钠B.100 g氯化钠溶液中溶解有10 g氯化钠C.将10 g氯化钠溶于90 g水中所得的溶液D.将氯化钠与水按1∶9的质量比配成的溶液8.20%的蔗糖溶液中,溶质、溶剂、溶液之间的质量比是()A.1∶4∶5 B.5∶4∶1C.4∶1∶5 D.20∶100∶809.海水淡化可采用膜分离技术,如图6-2-1所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,对加压后右侧海水成分变化进行分析,正确的是()图6-2-1A.溶质质量增加B.溶液质量不变C.溶剂质量减少D.溶质质量分数不变10.从一瓶氯化钾溶液中取出20 g溶液,蒸干后得到2.8 g 氯化钾固体,试确定这瓶溶液中溶质的质量分数。
班级姓名1.对10%的食盐溶液含义的解释错误的是 ( ) A.100克水中溶解了10克食盐 B.100克食盐溶液中含有10克食盐C.将10克食盐溶于90克水中所得的溶液 D.食盐与溶液的质量比是1:10 2.常用抗生素“先锋Ⅵ”为粉末状固体,每瓶含“先锋Ⅵ”0.5 g,注射时应配成质量分数不高于20%,的溶液,则使用时每瓶至少需加入蒸馏水 ( ) A.1 mL B.2 mL C.3 mL D.4 mL3.现有1 000 mL20%的硫酸溶液,其密度为1.14 g/cm3,下列说法正确的是()A.该溶液含溶质20 g B.该溶液中,溶质质量:溶液质量=1:6C.该溶液中,溶质质量:溶剂质量=1:5 D.该溶液中,溶液质量:溶剂质量=5:4 4.日常生活中除去油污的方法很多,下列现象不属于乳化的是A.修车工用汽油洗去手上的油污B.洗发精洗去头发上的油脂C.洗面奶洗去皮肤上的油脂D.洗洁精洗去餐具上的油污5.某同学设计的下列实验方案中.,你认为不能达到实验目的的是A.用燃着的木条鉴别二氧化碳和氧气 B.用食醋除去水瓶胆中的水垢C.用水鉴别硝酸铵固体和氢氧化钠固体 D.用食盐水鉴别硬水和软水6.如图所示实验,装置中出现的现象是A.铁丝不变化 B.铁丝逐渐消失C.试管中的液面不变化D.试管中的液面上升7、下列有关溶液的说法正确的是A.盐水的沸点比水低 B.无色澄清液体一定是溶液C.只有固体能作溶质 D.溶液的各部分性质均相同8.要使右图装置中的小气球鼓起来,则使用的固体和滴入液体可以是①石灰石和稀盐酸②镁和稀硫酸③固体氢氧化钠和水④生石灰和水A.①②③ B.①②③④ C.①②④ D.②③④9.以“>”或“<”或“=”填空。
(1)20℃,1 L水与1 L酒精混合后的体积__________2 L。
(2)20℃,1g镁与1g稀硫酸充分反应后所得的溶液的质量___________2g,(3)20℃,1 g硫粉在1 g氧气中完全燃烧后生成的二氧化硫的质量_________2g,10、某些物质溶于水电离出自由移动的而使溶液能导电。
溶液组成的表示溶液组成的表示使学生认识溶液教学过程:【创设情景】在上节课中我们已经讨论了溶液在人类的生活和生产中有着重要的作用。
而在使用溶液时,人们往往需要知道溶液的组成和溶液中各种物质的质量关系。
一、回顾、预习与交流【旧知回顾】:1.下列物质中,哪些属于溶液?① 少量面粉加入水中振荡后的液体② 澄清石灰水中通入适量的二氧化碳③生理盐水④ 稀盐酸⑤稀硫酸⑥ 冰溶于水⑦ 澄清的海水⑧ 液态氧⑨ 啤酒2.溶液是物,食盐水是和的混合物,所有的溶液都是由和组成的。
被溶解的物质叫,溶解溶质的物质叫做,在食盐水溶液中,是溶质,是溶剂。
【新知导学】:二、合作、研讨与点拨(一)溶液的组成汽油归纳:(1)溶质的状态可以是、、,溶剂状态一般是,最常见的溶剂是。
(2)溶质可以有种,溶剂只有种。
当固体、气体溶于液体时,固体、气体为溶质,液体为溶剂;当两种液体相互溶解时,把量多的物质叫溶剂,量少的物质为溶质;如果有水,不管量多量少,水是溶剂,另一种物质为溶质。
(二).溶液的命名:溶质的溶剂溶液,如果没有说明溶剂的名称,则溶剂为水(1)硫酸铜溶于水得到溶液,简称为(2)酒精溶于水得到溶液,简称为(3)碘溶于酒精得到溶液,简称为(4)白磷溶于二硫化碳中,得到溶液,氯化氢溶于水中,得到溶液,俗称。
(5)铁和硫酸铜溶液恰好完全反应后得到的溶液(三)溶液的质量和体积1.溶液质量= +溶液的体积≠+,为什么?溶液的质量===溶液的体积×当溶质和溶剂混合混合后,讨论下列有关量的关系?①.10克NaCl完全溶解在100克水中所得溶液质量 110克食盐水;②.10ml酒精和10ml水混合后所得溶液体积 20ml的酒精溶液;③.某食盐水的密度为1.04克/毫升,现取50毫升的该食盐水,则该溶液的质量克。
三、总结、反思与提升(总结)1、溶液的命名:溶质的溶剂溶液2、溶质质量= ×3、溶液质量= ÷溶液的体积≠+,(反思)1、氧化钙放入水中,溶质是什么?为什么?还有什么现象?2、硫酸铜晶体俗称胆矾、蓝矾,化学式是CuSO4•5H2O,硫酸铜晶体溶于水形成的溶液,溶质是。
6.2 溶液组成的表示课时练习【课前预习】1.溶液是由和组成的。
其中叫做溶质,而叫溶剂。
2.我们常见的溶液都是溶液,所以是最常见的溶剂,一般不指明溶剂的溶液都是指。
但如果不是以水为溶剂,则根据该溶液组成物质的状态或多少确定:如组成物质有液态,则液态物质为,如组成物质都是液态的,则含量较大的为,含量较少的为。
【课堂练习】3.医院里常用的碘酒,溶剂是()A.碘B.碘酒C.水D.酒精4.溶液中溶质的状态()A.只能是固态B.只能是液态C.只能是气态D.可以是固态、液态或气态5.实验室用36%的浓盐酸配制5%的稀盐酸500mL,应选用的仪器有(D )A.托盘天平、酒精灯、试管、药匙B.托盘天平、玻璃棒、烧杯、漏斗C.托盘天平、铁架台、试管、量筒D.托盘天平、玻璃棒、烧杯、量筒6.小唐同学用98%的浓硫酸配制一定质量10%的稀硫酸。
在量取浓硫酸时,对量筒俯视读数(如右图,其他每步均按规范进行),结果他配制的稀硫酸中溶质的质量分数与要求的10%相比()A:偏高B:偏低C:不变D:无法判断7.给溶液命名时,通常把的名称放在前,把的名称放在后。
如把固体白磷溶于二硫化碳(一种有机物)时,所形成的液体叫做的,其中是溶质,是溶剂。
8.写出下列溶液中的溶质的名称:(1)澄清石灰水(2)氢氧化钠溶液(3)醋酸铅溶液(4)硫酸溶液(5)白酒(6)盐酸9.用硫酸铜固体和水配制质量分数为10%的硫酸铜溶液,其操作步骤应该是、、。
若用溶质质量分数为10%的硫酸铜溶液配制溶质质量分数为5%的硫酸铜溶液,其操作步骤是、、。
【课后测试】一、选择题10.下列关于溶液中溶质与溶剂的说法正确的是()A.溶液溶剂一定是液体B.溶质只能是固体C.溶剂可能是固体、气体或液体D.溶质只能是气体11.当烧杯中溶液的外部条件不改变(水分不蒸发、温度不改变、压强无变化)时,溶液中的溶质会()A.沉降在烧杯底部B.漂浮在溶液表面C.会集合成小颗粒D.不会分离出来12.下列关于溶液的说法中,不正确的是()A.溶液中的溶质是以分子或离子的形式分散在溶剂中的B.溶液是生命活动必须的一类重要物质C.空气可以看作是气态的溶液,而一些合金也可看作是固态的溶液D.不溶的物质绝对不能形成溶液二、填空题13.填写下列空白:三、简答题14.小李在用氯化钠固体配制500g20%的食盐水时,发现最终所得到的溶液的质量分数小于20%,试分析造成上述问题的可能原因。