氯化亚锡的还原处理
- 格式:doc
- 大小:20.00 KB
- 文档页数:1

钼的测定-氯化亚锡还原硫氰酸盐快速光度法
一、主要试剂:
1、高氯酸:70%
2、盐酸(浓)
3、氯化亚锡-盐酸混合液:于盛有20亳升浓盐酸的500毫升烧中,加入6克氯化亚锡,溶解后加280毫升水,再加6克硫氰酸钠,搅拌溶解。
4、空白液:于20毫升盐酸中加6克氯化亚锡,溶解后加280毫升水,搅拌均匀。
二、分析操作:
显色溶液:称取试样0.0500克于200毫升三角烧杯中,加5毫升HCL,3毫升HCLO4加热溶解后冒高氯酸烟至瓶口,溶液不冒气泡或变为红色时立即加入50毫升混合液,摇匀,用1cm比色杯测其消光值,在JSB系列或JQ系列分析仪器上测定含量。
参比溶液:称取同一试样,按上述溶解后,加入空白液,此溶液作为参比液。
注:
1、如消光值太大时则可改少称样为25.0毫克。
2、不含铬、镍、铜的试样,可用水作参比液。
3、每一种试剂必须摇匀,最好向瓶中心加入,不要倒在瓶壁,以免影响结果。

磷的测定(氯化亚锡还原光度法)概述1.方法原理在酸性条件下,正磷酸盐与钼酸铵反应,生产磷钼杂多酸。
当加入还原剂氯化亚锡后,则转变成蓝色络合物,通常称为钼蓝。
2.干扰及消除氯离子含量达0.15%以上时,使显色减弱(其他卤素离子亦同);硫酸根离子,含量在1%以上时,则使色度增加;高铁(Fe3+)离子具有氧化作用,含量达40mg/L时,可影响显色;铜(Cu2+)离子含量大于1mg/L时,可出现负偏差;硅酸在此显色条件下不干扰;砷酸可与磷酸一样显色,其色度约为磷酸的1/20。
水中过锰酸盐、六价铬等离子含量较高时,影响磷钼蓝显色,遇此情况,可加适量亚硫酸钠溶液使还原,并再经煮沸以除去剩余的亚硫酸根离子。
3.方法的适用范围本方法最低检出浓度0.025mg/L,测定上限为0.6mg/L。
适用于地面水中正磷酸盐的测定。
仪器分光光度计。
试剂(1)钼酸铵溶液:称取8.25g钼酸铵溶于约75ml水中,另量取100ml浓硫酸徐徐注入300ml水中。
冷却后,将钼酸铵溶液在搅拌下注入硫酸溶液中,加水至500ml,贮于聚乙烯瓶中,如混浊或变色则应重配。
(2)氯化亚锡溶液:称取0.5g氯化亚锡,加2.5ml浓盐酸使完全溶解,得透明溶液(必要时放臵过夜或稍稍加温)后,加水稀释至25ml,加一粒金属锡,臵冷暗处,一周后重配。
(3)磷酸盐贮备溶液:将磷酸二氢钾(KH2PO4)于110℃干燥2h,在干燥器中放冷。
称取0.217g溶于水,移入1000ml容量瓶中。
加(1+1)硫酸5ml,用水稀释至标线。
此溶液每毫升含50.0μg磷(以P计)。
(4)磷酸盐标准溶液:吸取10.00ml磷酸盐贮备溶液于250ml容量瓶中,用水稀释至标线。
此溶液每毫升含2.00μg磷。
临用时现配。
步骤1.标准曲线的绘制取数支50ml具塞比色管,分别加入磷酸盐标准使用液0、0.50、1.00、3.00、5.00、10.0、15.0ml,加水至标线。
(1)显色:向比色管中加入5ml钼酸铵溶液,混匀。

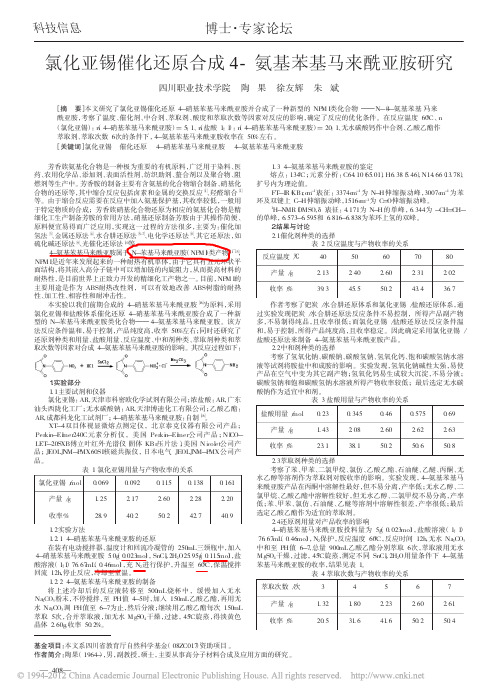
2012年2月内蒙古科技与经济F ebruar y2012 第4期总第254期Inner M o ngo lia Science T echnolo gy&Economy N o.4T o tal N o.254氯化亚锡还原硫氰酸钾分光光度法测定矿石中钼含量X周长玉(内蒙古化工职业学院,内蒙古呼和浩特 010011) 摘 要:论述了采用氯化亚锡还原硫氰酸钾分光光度法测定矿石中钼的含量的方法。
实验中矿样经高温处理,溶解过滤配成溶液后,用氯化亚锡、硫氰酸钾、磷酸盐处理标样和矿样溶液,其中氯化亚锡为还原剂,硫氰酸钾为显色络合剂,磷酸盐为稳定剂。
在此条件下得到标准曲线方程为A=0.9997c-0.0008,其相关系数为0.9997,说明在此条件下,吸光度和浓度间有很好的线性关系。
利用该关系式对矿样中钼含量进行了分析测定,测定结果的相对平均偏差分别为0和1.52%,说明在此条件下,测定结果的精密度高,符合测定要求。
关键词:分光光度法;矿石;钼含量 中图分类号:P618.65;P675 文献标识码:A 文章编号:1007—6921(2012)04—0076—02 目前,分析测定钼含量的方法很多,有极谱法、X射线荧光光谱法、原子发射光谱法、重量法、分光光度法和滴定法,其中尤以分光光度法为多[1-6],它具有操作简单,灵敏度高,经济、方便、快速等优点,但其缺点是显色溶液稳定性差。
研究中发现,钼-硫氰酸盐红色络合物的稳定时间只有20min左右,因此必须在显色后15min~20m in内完成比色。
贵州省地质中心发现测定钨时,用二氯化锡-硫氰酸盐与钨生成黄色络合物时没有稳定时间,等待的时间稍长溶液就会出现浑浊,但用磷酸分解试样,用二氯化锡-硫氰酸盐方法测定钢铁中的钨,在此体系中生成的黄色络合物稳定时间则长达十几小时。
由此推测磷酸盐对钨与硫氰酸盐生成的黄色络合物起到了稳定作用。
但是贵州省地质中心实验室操作规程和文献等中并未提及有关测定矿石中钼的方法。

焦亚硫酸钠还原黄金方法
1. 亚硫酸钠溶液法将黄金粉末溶解在浓硫酸中,加入适量的亚硫酸钠溶液,搅拌均匀后加热,使反应进行。
反应结束后,过滤、洗涤和干燥即可得到纯金。
2. 氢氧化钠溶液法将黄金粉末与氢氧化钠溶液混合,加热反应,生成金的氢氧化物沉淀。
过滤、洗涤和干燥后,将沉淀转化为金粉。
3. 氰化钾还原法将黄金粉末与氰化钾混合,加热反应生成氰化金。
将氰化金沉淀过滤、洗涤和干燥后,用氢气还原氰化金为金属金。
4. 氯化亚锡还原法将黄金粉末与氯化亚锡混合,加热反应生成硫化铜和金属金。
将硫化铜沉淀过滤、洗涤和干燥后,用氢气还原硫化铜为金属金。

氯化亚锡标准溶液1. 引言氯化亚锡(SnCl2)是一种无机化合物,常用作还原剂、光学材料、电镀和制药等领域中的重要原料。
为了确保实验和工业生产的准确性和一致性,研究人员通常会使用氯化亚锡标准溶液进行定量分析和校准设备。
本文将介绍氯化亚锡标准溶液的制备方法和常见的使用注意事项。
2. 氯化亚锡标准溶液的制备方法氯化亚锡标准溶液的制备方法主要有两种:直接溶解法和配制法。
2.1 直接溶解法直接溶解法是将固体氯化亚锡直接溶解于溶剂中,然后适当稀释得到所需浓度的标准溶液。
具体步骤如下:1.准备所需的实验器皿(如烧杯或容量瓶),并用去离子水或其他适当的溶剂预先清洗和干燥。
2.称取适量的氯化亚锡固体,并将其加入到预先清洗的容器中。
3.加入足够的溶剂(去离子水或其他适当的溶剂),并充分搅拌直至固体完全溶解。
4.如果需要得到一定浓度的标准溶液,可以根据所需的溶液浓度和体积计算出所需溶剂和氯化亚锡的量,按照同样的步骤进行制备。
2.2 配制法配制法是通过将已知浓度的氯化亚锡标准溶液与适量的溶剂混合,稀释得到所需浓度的标准溶液。
具体步骤如下:1.准备所需的实验器皿,并用去离子水或其他适当的溶剂预先清洗和干燥。
2.根据所需的溶液浓度和体积计算出所需溶液的体积以及所需的氯化亚锡和溶剂的量。
3.取一定体积的已知浓度的氯化亚锡标准溶液,并将其加入到预先清洗的容器中。
4.加入适量的溶剂,并充分搅拌直至混合均匀。
5.如果需要得到一定浓度的标准溶液,可以根据所需的溶液浓度和体积计算出所需溶剂和氯化亚锡的量,按照同样的步骤进行配制。
3. 使用注意事项在使用氯化亚锡标准溶液时,需要注意以下事项:•氯化亚锡标准溶液具有还原性和强腐蚀性,使用时应戴上防护手套和护目镜,避免直接接触皮肤和眼睛。
•制备和使用过程中应保持实验环境的通风良好,避免吸入氯化亚锡蒸气。
•标准溶液的贮存和保存应采取适当的措施,避免溶液的挥发和污染。
•氯化亚锡标准溶液的浓度可以通过分光光度法、滴定法或其他定量分析方法进行测定和校准。
甲基磺酰氯的新合成方法-概述说明以及解释1.引言1.1 概述甲基磺酰氯是一种常用的有机合成试剂,广泛应用于有机合成反应中。
然而,目前已知的甲基磺酰氯的合成方法存在一些不足之处,如产率低、废弃物多、操作条件较为繁琐等。
因此,寻找一种新的合成甲基磺酰氯的方法成为了有机合成领域的研究热点。
本文旨在介绍甲基磺酰氯的新合成方法以解决上述问题。
首先,我们将详细介绍两种不同的合成方法,并对它们进行比较与分析。
方法一采用了一系列简单易得的原料,在一定的反应条件下经过几步反应即可得到甲基磺酰氯。
方法二则利用了新型催化剂的引入,在短时间内高效合成甲基磺酰氯。
在这两种方法中,我们将详细描述其步骤与反应机理,并分析它们的优点和适用性。
在分析的基础上,我们将对这两种方法进行综合总结,比较它们的优缺点。
方法一具有原料易得、步骤简单等优点,但产率相对较低,废弃物较多;而方法二在反应时间短、产率高等方面有明显优势,但催化剂的引入增加了操作复杂性。
综合考虑,我们将进一步指出二者的适用范围,并提出进一步优化合成甲基磺酰氯方法的展望。
通过本文的研究,我们希望为甲基磺酰氯的合成方法提供新的思路和方向,并为有机合成领域的研究提供有价值的参考。
1.2 文章结构文章结构部分的内容可以按照以下方式进行编写:文章结构部分的功能是为读者提供一个全面的了解本文内容以及各个章节之间的逻辑关系。
本文按以下结构组织:第一部分为引言部分,包括概述、文章结构和目的。
第二部分为正文部分,主要介绍了两种新的甲基磺酰氯的合成方法。
方法一部分详细描述了该方法的步骤,然后说明了该方法的优点。
方法二部分也会详细介绍该方法的步骤,同时也会说明该方法的优点。
第三部分为结论部分,主要包括对方法一和方法二的优缺点进行总结和展望甲基磺酰氯新合成方法的研究方向。
通过以上结构的组织,本文旨在全面介绍甲基磺酰氯的新合成方法,并对两种方法进行比较分析,为读者提供一个系统、清晰的了解新合成方法的文章框架。
重铬酸钾容量法测定铁摘要:在盐酸溶液中,用氯化亚锡溶液将铁(Ⅲ)还原为铁(Ⅱ),然后加入氯化高汞溶液以氧化过量的氯化亚锡,用二苯胺磺酸钠为指示剂,以重铬酸钾标准溶液滴定,溶液由绿色变为蓝紫色,即为终点,以此计算样品中铁的含量关键词:氯化亚锡还原重铬酸钾氧化引言在盐酸溶液中,用氯化亚锡溶液将铁(Ⅲ)还原为铁(Ⅱ),然后加入氯化高汞溶液以氧化过量的氯化亚锡,用二苯胺磺酸钠为指示剂,以重铬酸钾标准溶液滴定。
其反应式如下:2Fe3++Sn2++6Cl-→2Fe2++SnCl62-Sn2++4Cl-+2HgCl2→SnCl62-+Hg2Cl2↓6Fe2++Cr2O72-+14H+→6Fe3++2Cr3++7H2O由于氯化亚锡能将铜(Ⅱ)还原为铜(Ⅰ),铜(Ⅰ)能被重铬酸钾氧化,同时铜离子又能促使铁(Ⅱ)被空气中的氧氧化,所以铜量高时干扰测定。
钼也能被氯化亚锡还原严重干扰测定。
钨被还原为钨蓝。
当钴、镍含量高时,由于钴、镍离子本身具有颜色,使铁(Ⅲ)还原时不易观察终点,但加入过量氨水,能使铁生成氢氧化物沉淀并与上述元素进行分离。
砷、锑均能被氯化亚锡还原,尔后又被重铬酸钾滴定,使结果偏高。
大量钒的存在能影响测定铁的准确性。
大量絮状硅酸存在,会导致结果偏低,因为铁(Ⅲ)被它们吸附和包裹,使其不易完全被氯化亚锡所还原,可用氢氟酸、硫酸处理试样。
硝酸的存在严重影响还原和滴定终点的观察,因此在分解试样后必须用硫酸将硝酸完全赶尽。
本法适用于0.5%以上铁的测定。
1 试剂配制氯化亚锡溶液:100g/L,称取10g氯化亚锡溶于10mL盐酸中,用水稀释至100mL。
氯化高汞溶液:5%,称取5g氯化高汞溶于100mL水中。
硫-磷混酸:将150mL硫酸慢慢加入500mL水中,冷却后加入150mL磷酸,用水稀释至1000mL,混匀。
重铬酸钾标准溶液:称取1.7559g预先在150℃烘干1h的重铬酸钾基准试剂于250mL烧杯中,以少量水溶解后移入1000mL容量瓶中,用水定容,摇匀。
氯化亚锡还原重氮盐反应机理
氯化亚锡还原重氮盐反应是一种重要的有机合成反应,其机理经过多年的研究已经得到了比较详细的解释。
本文将对这种反应机理进行阐述。
首先,我们需要了解一下什么是重氮盐。
重氮盐是一种含有-
N≡N基团的化合物,它们在有机合成中具有广泛的应用。
重
氮盐可以通过亚硝酸钠和酸的反应制备得到,例如:
R-NH2 + HNO2 + HCl → R-N≡N+ Cl- + 2H2O
其中,R代表有机基团。
氯化亚锡还原重氮盐反应是指将重氮盐还原成相应的氨基化合物的反应。
这种反应通常使用氯化亚锡(SnCl2)作为还原剂,例如:
R-N≡N+ Cl- + SnCl2 + 2HCl → R-NH2 + SnCl4 + H2O
这种反应的机理比较复杂,但可以分为以下几个步骤:
1. 氯化亚锡与重氮盐发生电子转移,生成亚锡离子和相应的亚硝基化合物。
R-N≡N+ Cl- + SnCl2 → R-N≡N: + SnCl3-
2. 亚锡离子与亚硝基化合物发生加成反应,生成一个中间体。
R-N≡N: + SnCl3- → R-N≡N-SnCl3
3. 中间体发生消旋反应,生成两个不对称的中间体。
R-N≡N-SnCl3 → R-NH-SnCl3 + N2
4. 两个中间体再次发生加成反应,生成两个不同的产物。
R-NH-SnCl3 + R-N≡N-SnCl3 → R-NH2 + SnCl4 + Sn
其中,Sn代表金属锡。
总之,氯化亚锡还原重氮盐反应的机理比较复杂,但可以通过以上步骤来解释。
这种反应在有机合成中具有广泛的应用,可以用于制备各种氨基化合物。