磺基水杨酸合铁Ⅲ配合物的组成及稳定常数的测定
- 格式:doc
- 大小:153.00 KB
- 文档页数:6


实验六 磺基水杨酸铁(Ⅲ)配离子的组成和稳定常数的测定一、实验目的1.采用浓度连续变更法测量配合物的组成和配位化合物的稳定常数。
2.学习分光光度计的使用及实验数据的处理方法。
二、实验原理磺基水杨酸与Fe 3+离子可形成稳定的配合物:起始浓度/mol·dm -3 c 0 0 平衡浓度/ mol·dm -3 c-c α c α c α()n eq Leq eqc c c K ⋅=MML (表观)不稳 或()eq neq Leqc c c K MLM⋅=(表观)稳97.21010⋅=(表观)稳稳K K当pH=2~3时,生成1:1型紫红色螯合物ML ,其表观稳定常数:2MLM 1ααc c c c K eq eqL eq -=⋅=稳 121-DDD =αα配合物的解离度:—朗伯比尔定律:有色溶液的吸光度D 与溶液的浓度成正比()1 c b D ⋅⋅=ε当温度、液层厚度及溶液性质一定时,()1式可写成:()2 kc D =以吸光度D 为纵坐标,以配体的物质的量分数为横坐标作图。
n n ML L M +LM ML n n +三、实验内容1.溶液的配制(1)配制3dm mol 0010.0-⋅ +3Fe溶液:准确吸取35.00cm 3dmmol 0100.0-⋅()()244SO Fe NH 溶液于350cm 容量瓶中,用3dmmol 0100.0-⋅4HClO 溶液稀释至刻度,摇匀备用。
(2)配制3dm mol 0010.0-⋅磺基水杨酸溶液:准确吸取35.00cm 3dm mol 0100.0-⋅磺基水杨酸溶液于350cm 容量瓶中,用3dm mol 0100.0-⋅4HClO 溶液稀释至刻度,摇匀备用。
2.浓度连续变更法配制配离子溶液及吸光度的测定(1)按下表配制溶液于310.00cm 比色管中,注意比色管编号,用3dm mol 0100.0-⋅4HClO 溶液稀释至310.00cm 刻度线,摇匀。

磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定嘿,朋友们!今天咱来聊聊磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定。
这可真是个有趣的玩意儿啊!你想想看,就像搭积木一样,各种分子凑在一起,形成了特别的组合。
磺基水杨酸和铁(Ⅲ),它们俩碰到一块儿,会产生什么样奇妙的反应呢?这就需要我们去探索啦!要测定这个组成和稳定常数,那可不是一件随随便便就能搞定的事儿。
得像侦探破案一样,仔细地观察、分析。
首先得准备好各种试剂和仪器,这就好比战士上战场得有趁手的兵器呀!然后呢,通过一系列的实验操作,一点一点地揭开它们的神秘面纱。
在这个过程中,可不能马虎大意哟!稍有不慎,可能就会得出错误的结果。
这就好像走钢丝,得小心翼翼,保持平衡。
要是不小心手抖了一下,或者加错了试剂,那可就糟糕啦!咱可以把这个过程想象成一场冒险,每一步都充满了未知和挑战。
比如说,在调节溶液酸碱度的时候,就像是在给一个小脾气的娃娃哄开心,得掌握好那个度。
太酸了不行,太碱了也不行,得刚刚好才行呢!还有啊,观察实验现象的时候可得瞪大了眼睛。
那一点点细微的变化,都可能是重要的线索。
就像在茫茫人海中寻找一个特别的人,得有敏锐的观察力。
当我们通过努力,终于测定出磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数时,那种成就感,哇,简直无法形容!就好像登山者终于登上了山顶,看到了那壮丽的景色。
总之呢,这个测定的过程充满了乐趣和挑战。
需要我们有耐心、细心,还要有那么一点点的好奇心。
朋友们,你们准备好了吗?快来和我一起踏上这场奇妙的科学之旅吧!相信你们一定会爱上这个过程的,就像我一样!别犹豫啦,赶紧行动起来吧!。

磺基水杨酸合铁配合物组成及其稳定常数测定实验七铁(III)离子与磺基水杨酸配合物的组成和稳定常数的测定一、实验目的1.了解采用分光光度法测定配合物组成和稳定常数的原理和方法。
2.学习用图解法处理实验数据的方法。
3.进一步学习分光光度计使用方法,了解其工作原理。
4. 进一步练习吸量管、容量瓶的使用二、实验原理磺基水杨酸(简式为H3R)可以与Fe3+ 形成稳定的配合物。
配合物的组成随溶液pH值的不同而改变。
在pH=2~3、4~9、9~11时,磺基水杨酸与Fe3+能分别形成三种不同颜色、不同组成的配离子。
本实验是测定pH=2~3时所形成的红褐色磺基水杨酸合铁(Ⅲ)配离子的组成及其稳定常数。
实验中通过加入一定量的HClO4溶液来控制溶液的pH值。
由于所测溶液中磺基水杨酸是无色的,Fe3+溶液的浓度很小,也可认为是无色的,只有磺基水杨酸合铁(Ⅲ)配离子(MRn)是有色的。
根据朗伯—比耳定律A=εbc可知,当波长λ、溶液的温度T及比色皿的厚度b均一定时,溶液的吸光度A只与有色配离子的浓度c成正比。
通过对溶液吸光度的测定,可以求出配离子的组成。
用光度法测定配离子组成,通常有摩尔比法、等摩尔连续变化法、斜率法和平衡移动法等,每种方法都有一定的适用范围,本实验采用等摩尔连续变化法,通过分光光度计测定配位化合物的组成。
具体操作时,取用摩尔浓度相等的金属离子溶液和配位体溶液,按照不同的体积比(即摩尔数之比)配成一系列溶液,测定其吸光度值。
以吸光度值A 为纵坐标,体积分数(,即摩尔分数。
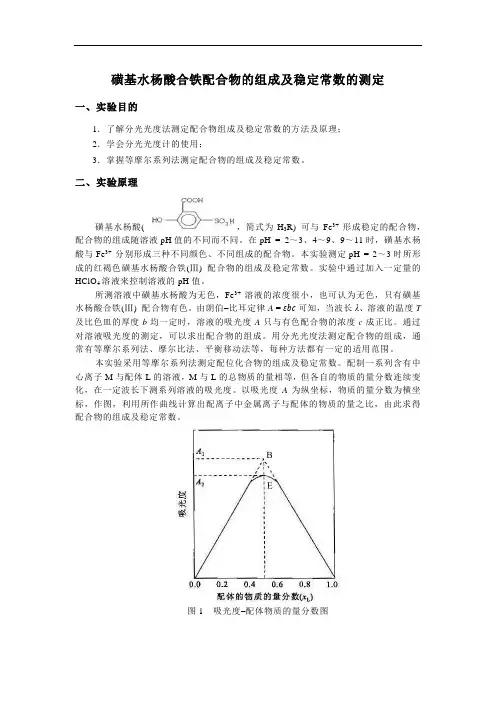
式中:V M为金属离子溶液的体积,V L为配位体溶液的体积)为横坐标作图得如图1所示的曲线,将曲线两边的直线部分延长相交于B点,B点对应的吸光度值A B 最大。
由B点对应的摩尔分数值,可计算配离子中金属离子与配位体的摩尔数之比,即可求得配离子MLn 中配位体的数目n 。
图 1 配位体摩尔分数-吸光度图在图1中,在B点最大吸收处对应的摩尔分数值为0.5,则:即:金属离子与配位体摩尔数之比为1︰1。
磺基水杨酸合铁配合物的组成及稳定常数的测定一、实验目的1.了解分光光度法测定配合物组成及稳定常数的方法及原理;2.学会分光光度计的使用;3.掌握等摩尔系列法测定配合物的组成及稳定常数。
二、实验原理磺基水杨酸( ,简式为H3R) 可与Fe3+ 形成稳定的配合物,配合物的组成随溶液pH值的不同而不同。
在pH = 2~3、4~9、9~11时,磺基水杨酸与Fe3+ 分别形成三种不同颜色、不同组成的配合物。
本实验测定pH = 2~3时所形成的红褐色磺基水杨酸合铁(Ⅲ) 配合物的组成及稳定常数。
实验中通过加入一定量的HClO4溶液来控制溶液的pH值。
所测溶液中磺基水杨酸为无色,Fe3+ 溶液的浓度很小,也可认为无色,只有磺基水杨酸合铁(Ⅲ) 配合物有色。
由朗伯–比耳定律A = εbc可知,当波长λ、溶液的温度T 及比色皿的厚度b均一定时,溶液的吸光度A只与有色配合物的浓度c成正比。
通过对溶液吸光度的测定,可以求出配合物的组成。
用分光光度法测定配合物的组成,通常有等摩尔系列法、摩尔比法、平衡移动法等,每种方法都有一定的适用范围。
本实验采用等摩尔系列法测定配位化合物的组成及稳定常数。
配制一系列含有中心离子M与配体L的溶液,M与L的总物质的量相等,但各自的物质的量分数连续变化,在一定波长下测系列溶液的吸光度。
以吸光度A为纵坐标,物质的量分数为横坐标,作图,利用所作曲线计算出配离子中金属离子与配体的物质的量之比,由此求得配合物的组成及稳定常数。
图1吸光度–配体物质的量分数图具体操作时,取用物质的量浓度相同的金属离子溶液和配体溶液,按照不同的体积比(即物质的量之比) 配成一系列溶液,测定其吸光度值。
以吸光度值 A 为纵坐标,体积分数(,即物质的量分数。
式中:V M为金属离子溶液的体积,V L为配体溶液的体积) 为横坐标作图,得到吸光度–配体物质的量分数图(如图1所示),将曲线两边的直线部分延长相交于B点,B点对应的吸光度值A1 最大。

实验十五 磺基水酸和铁(III )配合物的组成及稳定常数的测定【实验目的】了解光度法测定配合物的组分及其稳定常数的原理和方法。
测定pH ﹤2.5时磺基水酸铁的组成及其稳定常数。
学习分光光度计的使用。
【实验原理】磺基水酸(,简式为R H 3)与+3Fe 可以形成稳定的配合物,因溶液pH 的不同,形成配合物的组成也不同。
本实验将测定pH ﹤2.5时形成红褐色的磺基水酸合铁(III )配离子的组成及其稳定常数。
测定配合物的组成常用光度法,其基本原理如下。
当一束波长一定的单色光通过有色溶液时一部分光被溶液吸收,一部分光透过溶液。
对光的被溶液吸收和投过程度,通常有两种表示方法:一种是同透光率T 表示。
即透过光的强度t I 与射入光的强度0I 之比:I I T t=另一种试用吸光度A (又称消光法,光密度)来表示。
它是取透光率的负对数:tI I T A 0lglg =-= A 值大表示光被有色溶液吸收的程度大,反之A 值小,光被溶液吸收的程度小。
实验结果证明:有色溶液对光的吸收程度与溶液的浓度c 和光穿过的液层厚度d 的乘积成正比。
这一规律称朗波—比耳定律:cd A ε=式中ε是消光系数(或吸光系数)。
当波长一定时,它是有色物质的一个特征常数。
由于所测溶液中磺基水酸是无色的,+3Fe 溶液的浓度很稀,也可认为是无色的,只是磺基水酸铁配合离子(n MR )是有色的,因此,溶液的吸光度只与配离子的浓度成正比。
通过对溶液吸光度的测定,可求出该配离子的组成。
下面介绍一种常用方法:等摩尔系列法:即用一定波长的单色光,测定一系列组分变化的溶液的吸光度(中心离子M 和配体R 的总物质的量保持不变,而M 和R 的摩尔分数连续[][][])RM/(R+图15—1 A—[][][])RM/(R+曲线变化)。
显然,在这一系列溶液中,有一些溶液的金属离子是过量的。
而另一些溶液配体也是过量的;在这两部分溶液中,配离子的浓度都不可达到最大值;只有当溶液中金属离子与配体的摩尔比与配离子的组成一致时配离子的浓度才能最大。


5-磺基水杨酸合铁(ⅲ)配合物的组成及其稳定常数测定实验的教学方式改革1. 实验目的:了解配位化学的基本原理,掌握 5-磺基水杨酸合铁(Ⅲ)配合物的组成及其稳定常数测定实验原理,探讨教学方式改革的必要性和可行性。
2. 实验原理:5-磺基水杨酸 (H4SB) 溶解于水中形成酸性溶液,在加入FeCl3 后,Fe3+可和配体 H4SB 形成深红色的水杨庚酸铁(Ⅲ)配合物 Fe(SB)。
在后续测定过程中,通过变化重金属离子浓度与溶液 pH 值,测定 Fe(SB) 的稳定常数 K 和生成计量比。
3. 实验步骤:步骤 1: Fe(SB) 的制备1.1 用 0.1 mol/L HCl 溶解 5-磺基水杨酸,调节 pH 值至2.0。
1.2 在磁力搅拌下缓慢加入 0.1 mol/L FeCl3 溶液,直至出现红棕色沉淀,继续搅拌 10 min。
1.3 用 NaOH 溶液调节 pH 值至 3.5,离心分离沉淀并洗涤干净,使体系维持弱酸性状态。
1.4 用 80% 的乙醇溶解沉淀,得到 Fe(SB) 的制备物。
步骤 2:稳定常数 K 值测定2.1 准备不同浓度的 FeCl3 溶液,分别为 1×10^-3、2×10^-3、3×10^-3mol/L。
2.2 准备 pH 值不同的初始混合溶液,分别为 pH=2.00、2.20、2.40、2.60、2.80。
2.3 将 0.1 mol/L 的 HCl 与 0.02 mol/L 的 H4SB 混合,得到络合物的初始溶液 S。
2.4 向 S 中加入不同浓度的 FeCl3 改变重金属离子浓度,一定时间后,令溶液达到化学平衡。
2.5 测定化学平衡时的溶质浓度与 pH 值,并计算 Fe(SB) 的稳定常数 K。
4. 实验结果及解释:4.1 制备的 Fe(SB) 结构式为 Fe(SB)(H2O)2。
4.2 Fe3+ 与 H4SB 的生成计量比为 1:1。
4.3 当浓度为 2.6×10^-4 mol/L 时,Fe(SB) 组成最稳定,稳定常数K=7.07×10^3。

工程化学实验备课笔记磺基水杨酸合铁Ⅲ配合物的组成及稳定常数的测定实验目的1.掌握用比色法测定配合物的组成和配离子的稳定常数的原理和方法..2.进一步学习分光光度计的使用及有关实验数据的处理方法..实验原理磺基水杨酸;简式为H3R的一级电离常数K1θ=3×10-3与Fe3+可以形成稳定的配合物;因溶液的pH不同;形在配合物的组成也不同..磺基水杨酸溶液是无色的;Fe3+的浓度很稀时也可以认为是无色的;它们在pH值为2~3时;生成紫红色的螯合物有一个配位体;反应可表示如下:pH值为4~9时;生成红色螯合物有2个配位体;pH值为9~11.5时;生成黄色螯合物有3个配位体;pH>12时;有色螯合物;被破坏而生成FeOH3沉淀..测定配合物的组成常用光度计;其前提条件是溶液中的中心离子和配位体都为无色;只有它们所形成的配合物有色..本实验是在pH值为2~3的条件下;用光度法测定上述配合物的组成和稳定常数的;如前所述;测定的前提条件是基本满足的;实验中用高氯酸HClO4来控制溶液的pH值和作空白溶液其优点主要是ClO4-不易与金属离子配合..由朗伯—比尔定律可知;所测溶液的吸光度在液层厚度一定时;只与配离子的浓度成正比..通过对溶液吸光度的测定;可以求出该配离子的组成..下面介绍一种常用的测定方法:等摩尔系列法:即用一定波长的单色光;测定一系列变化组分的溶液的吸光度中心离子M和配体R的总摩尔数保持不变;而M和R 的摩尔分数连续变化..显然;在这一系列的溶液中;有一些溶液中金属离子是过量的;而另一些溶液中配体是过量的;在这两部分溶液中;配离子的浓度都不可能达到最大值;只有当溶液离子与配体的摩尔数之比与配离子的组成一致时;配离子的浓度才能最大..由于中心离子和配体基本无色;只有配离子有色;所以配离子的浓度越大;溶液颜色越深;其吸光度也就越大;若以吸光度对配体的摩尔分数作图;则从图上最大吸收峰处可以求得配合物的组成n值;如图所示;根据最大吸收处:等摩尔系列法由此可知该配合物的组成MR..最大吸光度A 点可被认为M 和R 全部形成配合物时的吸光度;其值D 1..由于配离子有一部分离解;其浓度再稍小些;所以实验测得的最大吸光度在B 点;其值为D 2;因此配离子的离解度α可表示为:α=D 1-D 2/D 1再根据1∶1组成配合物的关系式即可导出稳定常数 K 稳θ 或β..式中是c 相应于A 点的金属离子浓度这里的是 K 稳θ没有考虑溶液中的Fe3+离子的水解平衡和磺基水杨酸电离平衡的表现稳定常数.. 试剂和仪器1.仪器:UV2600型紫外可见分光光度计;烧杯100mL;3只;容量瓶100mL;9只;移液管 10mL;2只;洗耳球;玻璃棒;擦镜纸2.试剂以下试剂由教师准备酸:1、HClO 40.01mol·L -1:将4.4mL70%HClO 4溶液加入50mL水中;稀释到5000mL..2、磺基水杨酸0.0100mol·L -1:根据磺基水杨酸的结晶水情况计算其用量分子式C 6H 3OHCOOHSO 3H;无结晶水的磺基水杨酸分子量为218.2;将准确称量的分析纯磺基水杨酸溶于0.01mol·L -1HClO 4溶液中配制成1000mL..盐: NH 4FeSO 42 0.0100mol·L -1;1000mL :将4.8220g 分析纯NH 4FeSO 42·12H 2O 分子量为482.2晶体溶于0.01mol·L -1HClO 4溶液中配制成1000mL.. 实验步骤 1. 溶液的配制1 配制0.0010mol·L -1 Fe 3+溶液用移液管吸取10.00mLNH4FeSO420.0100mol·L -1溶液;注入100mL 容量瓶中;用HClO 40.01 mol·L -1溶液稀释至该度;摇匀;备用..2配制0.0010 mol·L -1磺基水杨酸H3R 溶液 用移液管量取10.00mLH3R0.0100mol·L -1溶液;注入100mL容量瓶中;用HClO40.01mol·L-1溶液稀释至刻度;摇匀;备用..2. 系列配离子或配合物溶液吸光度的测定1 用移液管按表的体积数量取各溶液;分别注入已编号的/mL定容到100mL..100mL容量瓶中;用0.01mol·L-1 HClO42 用波长扫描方式对其中的5号溶液进行扫描;得到吸收曲线;确定最大吸收波长..3 选取上面步骤所确定的扫描波长;在该波长下;分别测定各待测溶液的吸光度;并记录已稳定的读数..表数据记录和处理90.99..00 1.00101100数据记录及处理1实验数据记录摩尔比:Fe/Fe+acid00.10.20.30.40.50.60.70.80.91 A吸光度2用等摩尔变化法确定配合物组成:根据表中的数据;作吸光度A 对摩尔比Fe/acid 的关系图..将两侧的直线部分延长;交于一点;由交点确定配位数n..按3计算配合物的稳定常数..3磺基水杨酸合铁Ⅲ配合物的组成及其稳定常数的求得从图中找出D1和D2;计算α和稳定常数..其中C为配合物初始浓度:本实验条件下;配合物配合比为1:1;即摩尔比为0.5..此时配合物初始浓度为:C=0.001×5/100母液浓度为0.001;5 mL 混合后;变为100mL; 思考题1 本实验测定配合物的组成及稳定常数的原理如何2 用等摩尔系列法测定配合物组成时;为什么说溶液中金属离子的摩尔数与配位体的摩尔数之比正好与配离子组成相同时;配离子的浓度为最大3 在测定吸光度时;如果温度变化较大;对测得的稳定常数有何影响4本实验为什么用HClO4溶液作空白溶液为什么选用500nm波长的光源来测定溶液的吸光度5使用分光光度计要注意哪些操作。

实验16铁(Ⅲ)与磺基水杨酸配合物的组成及稳定常数测定一、实验目的1、了解光度法测定配合物的组成及稳定常数的原理和方法。
2、练习分光光度计的使用。
3、学习有关实验数据的处理方法。
二、实验原理根据郎伯-比尔定律,A=Kcl,如液层的厚度l不变,吸光度(或光密度,有色物质对光的吸收程度)A只与有色物质的浓度c成正比。
K为特征常数。
设中心离子(M)和配位体(L)在某种条件下反应,只生成一种配合物:M+n L=MLn (略去电荷)如果M和L都是无色的,而MLn有色,则此溶液的吸光度与配合物浓度成正比。
测得此溶液的吸光度,即可求出该配合物组成和稳定常数。
本实验使用等摩尔系列法(又称Job法)进行测定。
所谓等摩尔系列法,就是保持溶液中中心离子浓度与配位体浓度之和不变,改变中心离子与配位体的相对量,配置成一系列溶液,其中有一些溶液的中心离子是过量的,而有一些溶液的配位体是过量的。
在这两种情况下配离子浓度都不能达到最大值,只有当溶液中心离子与配位体的物质的量之比与配离子的组成一致时,配离子的浓度才能最大,吸光度也最大。
若以吸光度与配位体的摩尔分数作图,则从图上吸收处的摩尔分数,可以求得组成n值。
图6-1 磺基水杨酸铁的光密度-组成图配合物稳定常数的求法如图6-1所示。
在A处的吸光度A1被认为是M和L全部形成了配合物ML时的吸光度,在B处的吸光度A2是由于ML发生部分解离而剩下的那部分配合物的吸光度。
因此配合物ML的解离度α:α=( A1- A2)/ A1配合物ML 的稳定常数可由下列平衡关系导出: ML = M + L 开始浓度c 0 0平衡浓度 c-c α c α c α K(稳)=[ML]/[M][L]=(1-α)/ c α2其中c 是相应于A 点的中心离子浓度。
注意:这里求出的K(稳)是表观稳定常数,欲求得热力学稳定常数,必须根据实验条件(离子强度、pH 等)进行校正。
本实验测定磺基水杨酸与Fe3+形成螯合物的组成及稳定常数。

磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定【摘要】磺基水杨酸(SO3HHOCOOH简化为H3R),与Fe3+可以形成稳定的配合物,配合物的组成随溶液的pH值的不同而改变。
在pH=2~3时,pH=4~9时,pH=9~11.5时,磺基水杨酸与Fe3+能分别形成不同颜色且具有不同组成的配离子。
等摩尔连续变化法是配制一系列溶液,保持溶液中度、离子强度、温度和金属离子与配体的总物质的量不变改变金属离子cM和配体的摩尔分数使之连续化,在最大吸收波长处测定各溶液的吸光度,以吸光度A配体的摩尔分数xR作图,根据两边线性部分的延线相交之点所对应的配体摩尔分数值,即可求出配合的组成比可以认为相交之点Amax为配合物以n完全配位而不离解的吸光度,而实验测得值为A,两者之差就是由配合物离解所造成的.由此可求K稳,相应计算同摩尔比法.【关键字】分光广度法等摩尔连续变化法伯朗-比尔定律配合物配位数【实验目的】1、了解光度法测配合物配位数和稳定常数的一种原理和方法;2、测定pH<2.5时,磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数;3、学习分光光度计的应用;4、巩固溶液配制及作图法处理数据的方法。
【实验原理】1、伯朗-比尔定律当具有一定波长的单色光通过有色溶液时,一部分光被溶液吸收,另一部分光透过溶液。
I o一定时,I a越大,I t就越小。
一般将透过光强度I t与入射光强度I0之比叫透光度,以T表示:T越大,溶液透光程度越大,对光的吸收程度越小。
一般用A表示有色溶液对光的吸收程度,A越大,T越大,对于同一溶液而言,其吸光度与浓度c和液层厚度d成正比,即伯朗-比尔定律,若入射光波长、比色皿(溶液)的厚度d一定时,吸光度只与溶液的浓度c成正比。
通常测定某一物的一系列已知浓度的吸光度,以A为纵标,c为横标,绘出A-c标准曲线,则其斜率为k = εd,如果测定该物未知浓度c i溶液的吸光度为A i,则由A i/k或从标准曲线就可以求出c i来。
实验七铁(III)离子与磺基水杨酸配合物的组成和稳定常数的测定一、实验目的1.了解采用分光光度法测定配合物组成和稳定常数的原理和方法。
2.学习用图解法处理实验数据的方法。
3.进一步学习分光光度计使用方法,了解其工作原理。
4. 进一步练习吸量管、容量瓶的使用二、实验原理磺基水杨酸(简式为H3R)可以与Fe3+ 形成稳定的配合物。
配合物的组成随溶液pH值的不同而改变。
在pH=2~3、4~9、9~11时,磺基水杨酸与Fe3+能分别形成三种不同颜色、不同组成的配离子。
本实验是测定pH=2~3时所形成的红褐色磺基水杨酸合铁(Ⅲ)配离子的组成及其稳定常数。
实验中通过加入一定量的HClO4溶液来控制溶液的pH值。
由于所测溶液中磺基水杨酸是无色的,Fe3+溶液的浓度很小,也可认为是无色的,只有磺基水杨酸合铁(Ⅲ)配离子(MRn)是有色的。
根据朗伯—比耳定律A=εbc可知,当波长λ、溶液的温度T及比色皿的厚度b均一定时,溶液的吸光度A只与有色配离子的浓度c成正比。
通过对溶液吸光度的测定,可以求出配离子的组成。
用光度法测定配离子组成,通常有摩尔比法、等摩尔连续变化法、斜率法和平衡移动法等,每种方法都有一定的适用范围,本实验采用等摩尔连续变化法,通过分光光度计测定配位化合物的组成。
具体操作时,取用摩尔浓度相等的金属离子溶液和配位体溶液,按照不同的体积比(即摩尔数之比)配成一系列溶液,测定其吸光度值。
以吸光度值A 为纵坐标,体积分数(,即摩尔分数。
式中:V M为金属离子溶液的体积,V L为配位体溶液的体积)为横坐标作图得如图1所示的曲线,将曲线两边的直线部分延长相交于B点,B点对应的吸光度值A B 最大。
由B点对应的摩尔分数值,可计算配离子中金属离子与配位体的摩尔数之比,即可求得配离子MLn 中配位体的数目n 。
图 1 配位体摩尔分数-吸光度图在图1中,在B点最大吸收处对应的摩尔分数值为0.5,则:即:金属离子与配位体摩尔数之比为1︰1。
磺基水杨酸合铁(Ⅲ)的组成和K 稳的测定(分光光度法)一、实验目的1.初步了解分光光度法测定溶液中配合物的组成和稳定常数的原理和方法。
2.学习有关实验数据的处理方法。
3.练习使用分光光度计。
二、实验原理当一束具有一定波长的单色光通过一定宽度的有色溶液时,有色物质对光的吸收程度(用吸光度A 表示)与有色物质的浓度、液层宽度成正比:A =Kbc这就是朗伯-比耳定律。
式中c 为有色物质浓度;b 为液层宽度;K 为比例常数,其数值与入射光的波长、有色物质的性质和温度有关。
当有色物质成分明确,其相对分子质量已知的情况下,可用ε代替K ,ε称摩尔吸光系数,在数值上等于单位摩尔浓度在单位光程中所测得的溶液的吸光度:A =εbc磺基水杨酸与Fe 3+形成的配合物的组成和颜色因pH 不同而异。
当溶液的pH <4时,形成紫红色的配合物;pH 在4~10 间生成红色的配合物;pH 在10左右时,生成黄色配合物。
本实验用等物质的量系列法测定pH=2时磺基水杨酸与Fe 3+形成的配合物的组成和稳定常数。
等物质的量系列法就是在保持每份溶液中金属离子的浓度(c M )与配体的浓度(c R )之和不变(即总的物质的量不变)的前提下,改变这两种溶液的相对量,配制一系列溶液并测定每份溶液的吸光度。
若以不同的物质的量比RM M n n n 与对应的吸光度A 作图得物质的量比-吸光度曲线,曲线上与吸光度极大值相对应的物质的量比就是该有色配合物中金属离子与配体的组成之比。
图1表示一个典型的低稳定性的配合物MR 的物质的量比与吸光度曲线,将两边直线部分延长相交于B ,B 点位于50%处,即金属离子与配体的物质的量比为1:1。
从图可见,当物质完全以MR 形式存在时,在B 点MR 的浓度最大,对应的吸光度为A 1,但由于配合物一部分离解,实验测得的最大吸光度对应于E 点的A 2。
若配合物的解离度为α,则图1物质的量比—吸光度曲线α =121A A A - l:l 型配合物的标准稳定常数K 可由下列平衡关系导出:M + MR起始浓度 0 0 c平衡浓度 cα cα c (1-α)21ααc c c c K R M MR -=⋅=式中,c MR 、、c M 、c R 为离解平衡时的各物质浓度,c 是溶液内MR 的起始浓度,即当RM M n n n +=50%时,其值相当于溶液中金属离子或配位体的起始浓度的一半。