电渗析课件
- 格式:doc
- 大小:514.00 KB
- 文档页数:7






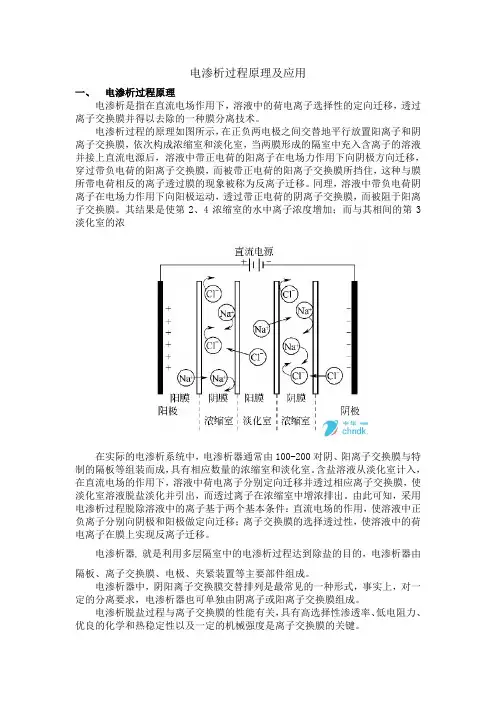
电渗析过程原理及应用一、电渗析过程原理电渗析是指在直流电场作用下,溶液中的荷电离子选择性的定向迁移,透过离子交换膜并得以去除的一种膜分离技术。
电渗析过程的原理如图所示,在正负两电极之间交替地平行放置阳离子和阴离子交换膜,依次构成浓缩室和淡化室,当两膜形成的隔室中充入含离子的溶液并接上直流电源后,溶液中带正电荷的阳离子在电场力作用下向阴极方向迁移,穿过带负电荷的阳离子交换膜,而被带正电荷的阳离子交换膜所挡住,这种与膜所带电荷相反的离子透过膜的现象被称为反离子迁移。
同理,溶液中带负电荷阴离子在电场力作用下向阳极运动,透过带正电荷的阴离子交换膜,而被阻于阳离子交换膜。
其结果是使第2、4浓缩室的水中离子浓度增加;而与其相间的第3淡化室的浓在实际的电渗析系统中,电渗析器通常由100-200对阴、阳离子交换膜与特制的隔板等组装而成,具有相应数量的浓缩室和淡化室。
含盐溶液从淡化室计入,在直流电场的作用下,溶液中荷电离子分别定向迁移并透过相应离子交换膜,使淡化室溶液脱盐淡化并引出,而透过离子在浓缩室中增浓排出。
由此可知,采用电渗析过程脱除溶液中的离子基于两个基本条件:直流电场的作用,使溶液中正负离子分别向阴极和阳极做定向迁移;离子交换膜的选择透过性,使溶液中的荷电离子在膜上实现反离子迁移。
电渗析器, 就是利用多层隔室中的电渗析过程达到除盐的目的,电渗析器由隔板、离子交换膜、电极、夹紧装置等主要部件组成。
电渗析器中,阴阳离子交换膜交替排列是最常见的一种形式,事实上,对一定的分离要求,电渗析器也可单独由阴离子或阳离子交换膜组成。
电渗析脱盐过程与离子交换膜的性能有关,具有高选择性渗透率、低电阻力、优良的化学和热稳定性以及一定的机械强度是离子交换膜的关键。
二、电渗析的基本理论1、Sollner双电层理论1949年Sollner提出解释离子交换膜的双电层理论,以阳离子交换膜为例,当离子交换膜浸入电解质溶液中,膜中的活性基团在溶剂水的作用下发生解离产生反离子,反离子进入水溶液,膜上活性基团在电离后带有电荷,以致在膜表面固定基团附近,电解质溶液中带相反电荷(可交换)的离子形成双电层。

![[历史学]第五章 电渗析与电除盐ppt课件](https://uimg.taocdn.com/f5b5b3eceff9aef8951e0669.webp)
电渗析过程原理及应用一、电渗析过程原理电渗析是指在直流电场作用下,溶液中的荷电离子选择性的定向迁移,透过离子交换膜并得以去除的一种膜分离技术。
电渗析过程的原理如图所示,在正负两电极之间交替地平行放置阳离子和阴离子交换膜,依次构成浓缩室和淡化室,当两膜形成的隔室中充入含离子的溶液并接上直流电源后,溶液中带正电荷的阳离子在电场力作用下向阴极方向迁移,穿过带负电荷的阳离子交换膜,而被带正电荷的阳离子交换膜所挡住,这种与膜所带电荷相反的离子透过膜的现象被称为反离子迁移。
同理,溶液中带负电荷阴离子在电场力作用下向阳极运动,透过带正电荷的阴离子交换膜,而被阻于阳离子交换膜。
其结果是使第2、4浓缩室的水中离子浓度增加;而与其相间的第3淡化室的浓在实际的电渗析系统中,电渗析器通常由100-200对阴、阳离子交换膜与特制的隔板等组装而成,具有相应数量的浓缩室和淡化室。
含盐溶液从淡化室计入,在直流电场的作用下,溶液中荷电离子分别定向迁移并透过相应离子交换膜,使淡化室溶液脱盐淡化并引出,而透过离子在浓缩室中增浓排出。
由此可知,采用电渗析过程脱除溶液中的离子基于两个基本条件:直流电场的作用,使溶液中正负离子分别向阴极和阳极做定向迁移;离子交换膜的选择透过性,使溶液中的荷电离子在膜上实现反离子迁移。
电渗析器, 就是利用多层隔室中的电渗析过程达到除盐的目的,电渗析器由隔板、离子交换膜、电极、夹紧装置等主要部件组成。
电渗析器中,阴阳离子交换膜交替排列是最常见的一种形式,事实上,对一定的分离要求,电渗析器也可单独由阴离子或阳离子交换膜组成。
电渗析脱盐过程与离子交换膜的性能有关,具有高选择性渗透率、低电阻力、优良的化学和热稳定性以及一定的机械强度是离子交换膜的关键。
二、电渗析的基本理论1、Sollner双电层理论1949年Sollner提出解释离子交换膜的双电层理论,以阳离子交换膜为例,当离子交换膜浸入电解质溶液中,膜中的活性基团在溶剂水的作用下发生解离产生反离子,反离子进入水溶液,膜上活性基团在电离后带有电荷,以致在膜表面固定基团附近,电解质溶液中带相反电荷(可交换)的离子形成双电层。
一般条件下离子交换膜上固定基团能构成足够强烈的负电场,使膜外溶液中带正荷离子极易迁移靠近并进入膜孔隙,而排斥带负电荷离子。
如果膜上的活性基团少,则其静电吸引力也随之减小,对同电荷离子的排斥作用也减小,降低了阳膜对阳离子的选择透过性;如果膜外溶液浓度很大,则扩散双电层的厚度会变薄,一部分带负电荷的离子靠近阳膜的机会增大并导致非选择性透过阳离子交换膜;而对阴离子交换膜的情况恰好相反。
由此可得以下电渗析的规律:(1)、异电荷相吸;(2)、膜中固定离子越多,吸引力越强,选择性越好;(3)、在电场作用下,溶液中的阳离子作定向连续迁移通过带负电的阳膜。
2、Gibbs-Donnan膜平衡理论Gibbs-Donnan平衡理论当时主要用于膜两侧的大分子渗透平衡,以及离子交换树脂与电解质溶液间的平衡,以后发展成也能满意地解释膜与电解质溶液间的离子平衡。
当离子交换膜浸入氯化钠溶液中时,溶液中的离子和膜内离子发生交换作用,最后达到平衡,构成膜内外离子的平衡体系。
如图所示:当将一张磺酸钠型阳膜浸入氯化钠溶液中时,膜中活性基团解离出的钠离子能进入溶液,溶液中的钠离子和氯离子也可能进入膜内,最后达到离子间的交换平衡。
但平衡时由于固定离子的影响,可透过离子在膜两边不是平均分布。
离子交换膜的Gibbs-Donnan平衡主要基于以下两个假设:其一是膜内外离子的化学位相等,即(1)式中、分别为离子在溶液中和膜内的化学位。
其二为膜内外各种离子其总浓度必须满足电中性的条件,则有(2)式中、分别为各种离子的价数和在膜内及溶液中的浓度。
从以上两个公式可推出以下关系式:(3)对稀溶液上式可简化为:=(4)对于非理想溶液(离子溶液通常为非理想的),上式应用活度系数加以校正。
引入平均离子活度系数,则上式变成(5)式中对单价阳离子和阴离子 =( r+r-)0.5分析以上方程,可知平衡时,溶液中与膜内固定离子符号的反离子容易进入膜内,同性离子则不容易进入膜内,使离子交换膜对反离子具有选择通过性。
若膜内活性基团的浓度[R-] 远大于膜外溶液浓度,则[Cl-]将减小,[R-]相对于[Cl-]愈高,[Cl-]愈小。
从式 (3)还可以看出,只要溶液中[Cl-]不等于零,那么膜内的[Cl-]也不可能等于零,所以膜的选择透过性不可能达到百分之百。
因此,从Gibbs-Donnan理论,可得出以下规律:(1)、膜上[cR-]趋向0,则式(3)右边接近于1,膜无选择性;(2)、当膜上[cR-]趋向无穷大,也即膜上的同名离子很少,则膜的选择性趋向100%;(3)、当被处理溶液中的[cCl-]>>膜上[cR-],即溶液中的[cCl-]很大,膜内[cR-]很小,膜的选择性将会下降,由此可推知离子交换膜不宜在高浓度下操作。
三、电渗析过程中的传递现象电渗析装置在运行过程中的传递现象是非常复杂的。
对NaCl水溶液进行电渗析时,具有几种传递现象发生。
1、反离子迁移,也即为膜上固定离子基团电荷相反的离子迁移。
这种迁移是电渗析的主要传递过程,电渗析利用这种迁移达到溶液脱盐或浓缩的目的。
2、同名离子的迁移,也即为与膜上固定离子(基团)电荷相同的离子的迁移,这种迁移是由于在阳离子交换膜中进入的少量阴离子,阴离子交换膜进入的少量阳离子引起的。
因此,离子交换膜的选择性不可能达到100%。
同名离子的迁移方向与浓度梯度方向相反,因此而降低了电渗析过程的效率。
但与反离子迁移相比,同名离子的迁移数一般很小。
3、电解质的渗析,这种渗析主要由于膜的两侧浓水室与淡水室的浓度差引起的,使得电解质由浓水室向淡水室扩散。
这种扩散速率随浓水室侧浓度的提高而增大。
4、水的渗透,随着电渗析的进行,淡水室中水含量逐渐升高,由于渗透压的作用,淡水室中的水会向浓水室渗透。
两室浓度差越大,水的渗透量也越大,从而使淡水大量损失。
5、水的分解,这是由于电渗析过程中产生浓差极化,或中性水离解成OH-和H+所造成,控制浓差极化可防止这种现象产生。
6、水的电渗析,由于离子的水合作用,在反离子和同名离子迁移时,会携带一定的水分子迁移。
7、压差渗透,由于膜两侧的压力差,造成高压侧溶液向低压侧渗漏。
以上的几种传递现象中,只有反离子迁移才具有脱盐或浓缩作用,而除反离子迁移外的其余几种传递现象,在电渗进行过程中都应设法降低或消除。
四、电渗析的新进展1.无极水电渗析技术无极水电渗析是传统电渗析的一种改进形式,它的主要特点是除去了传统电渗析的极室和极水。
图1 所示是无极水电渗析装置的示意图,该装置的电极紧贴一层或多层阴离子交换膜,它们在电气上都是相互联接的,这样既可以防止金属离子进入离子交换膜,同时又防止极板结垢和延长电极的使用寿命,由于取消了极室,无极水排放,极大地提高了原水的利用率。
图1 无极水电渗析器的结构地示意图AM.阴离子交换膜;CM.阳离子交换膜;1.阳极;2.阴极;3.非金属导电层;4.隔板;5.浓水出口;6. 淡水出口无极水电渗析器自1991 年问世以来,在应用中不断改善,装置在运行方式上采用频繁倒极,全自动操作,水质数字显示,自动报警,以城市自来水为进水,单台多极多段配置,脱盐率可达99 %以上;由于取消了极水水路,无极水排放,原水的利用率可达70 %以上;吨水耗电较常规电渗析节省1/ 3左右。
目前,无极水全自动控制电渗析器已在国内20 个省、市使用,近来,还远销东南亚。
2.无隔板电渗析器电渗析器自发明以来,一直采用浓淡水隔板、离子交换膜和电极等部件组装而成。
1994 年,江维达设计出了无隔板电渗析器(如图2) ,它主要是用新设计的JM 离子交换网膜构件取代离子交换膜和隔板,同时此新构件具有普通离子交换膜和隔板的功能。
无隔板电渗析器是一种不需要配置隔板,直接由JM 离子交换网膜和电极为主要部件组装而成的新型电渗析器。
现已研制成220mm ×150mm 样机,该机在相同条件下与有隔板的电渗析器比较,脱盐速率快,电耗可降低20 %以上。
图2 无隔板电渗析器的内部结构C.阳离子交换网膜;A.阴离子交换网膜; 1.网膜密封周边框;2.凹凸不平网膜;3 、5. 淡水进口方向;4 、6. 浓水进口方向3.卷式电渗析器卷式电渗析器是一种类似卷式反渗透组件结构的电渗析器,它的阴阳离子交换膜都放在同心圆筒内,并卷成螺旋状。
图3 所示是卷式电渗析器的结构示意图,阳极在圆筒的中心,阴极安放在圆筒的外壳上,淡液和浓液沿膜间通道流动,管道与图平面垂直,淡液通过管道而进出。
图3 卷式电渗析器示意图1.阳极;2.阴极;3.淡水进口;4.浓缩室;5. 淡液进出口在电渗析过程中,减少扩散层电阻(主要是淡水室扩散层) 具有重要意义,因为它占膜对总电阻的很大比例,特别是接近和发生浓度极化时,它约占总电阻的90 %。
扩散层电阻主要受流体力学条件的约束。
流体力学上的滞流层与电渗析过程的浓度扩散层有密切联系,滞流层厚度的减少将引起扩散层厚度的减少。
卷式电渗析器中液体的流体状态为螺旋流,它能使滞流层厚度大大减少,相应的扩散层厚度也将显著减少,因此,它能强化传质过程,提高脱盐效果和降低能耗。
卷式电渗析器结构的优点是能够使用像布匹那样长的离子交换膜,可把膜组装成受厂商和用户欢迎的箱式组件。
但卷式电渗析器至今没有应用实例,其主要缺点是螺旋膜堆难以密封,特别是圆筒中心管既作电极用,又要作集水管用,由于存在电极反应,使得离子交换膜与中心管粘结的部分不易密封。
4.填充床电渗析技术填充床电渗析,国外称为电去离子( EDI) ,是将离子交换膜与离子交换树脂有机地结合在一起,在直流电场的作用下实现去离子过程的一种新分离技术。
它的最大特点是利用水解离产生的H+和OH- 自动再生填充在电渗析器淡水室中的混床离子交换树脂,从而实现了持续深度脱盐。
图4 所示是填充床电渗析过程示意图[9 ] ,它是一种将电渗析和离子交换优点巧妙结合的脱盐方法,离子交换树脂颗粒填充在电渗析器的淡水室内,同时主要发生三个过程:在外电场的作用下,发生电渗析过程;离子交换树脂上的OH- 和H+ 离子与水中的电解质离子进行离子交换过程;电渗析的极化过程所产生的OH- 和H+ 及离子交换树脂本身的水解作用对交换剂进行的电化再生过程。
图4 填充床电渗析器结构示意图1.阴离子交换器;2.阳离子交换器;3.阳离子交换树脂;4.阴离子交换树脂;5.浓水室;6. 淡水室填充床电渗析或EDI 的概念始于1950 年[10 ] ,1955 年Walters[11 ]用填充床电渗析处理放射性废水首次报道了一些操作参数,直到1990 年, Ionpure公司[12 ]推出商品化的EDI 装置,才使它开始在工业上应用。