第五章卤代烃-第五章卤代烷(Haloalkanes)
- 格式:doc
- 大小:191.00 KB
- 文档页数:11





第五章卤代烃第五章卤代烷(Haloalkanes )教学目的与要求:1. 学会卤代烃的命名方法;2. 掌握卤代烃的结构,熟悉卤代烃的物理性质;3. 掌握卤代烃的反应、制备及亲核取代反应的机理。
教学重点、难点:1. 卤代烃的亲核反应机理,S N 2 机理与S N 1 机理;2. S N 2与S N 1立体化学;3. 影响S N 2与S N 1反应的因素;4.格氏试剂的制备与应用。
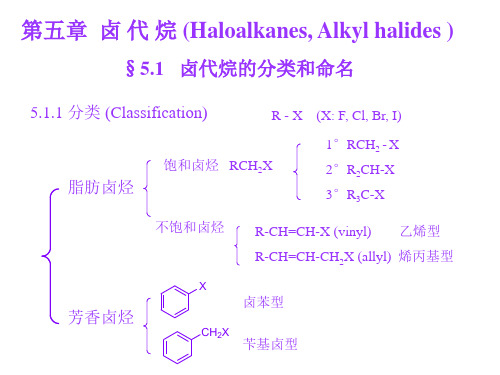
5.1 卤代烃的分类与命名5.1.1 卤代烃的分类1. 按卤原子的个数分类(1)单卤代烃:CH 3Cl 一氯甲烷; CH 3CH 2Br 溴乙烷 Ph-CH 2Br 苄基溴 (2)多卤代烃:CHCl 3 氯仿; CH 2BrCH 2Br 1,2-二溴乙烷 2. 按卤原子所连碳的级数分类 1°(伯)卤代烃——卤原子所连碳为一级碳 CH 3CH 3CH 2Br 1-溴丙烷 2°(仲)卤代烃——卤原子所连碳为二级碳 CH 3CHBrCH 3 2-溴丙烷 3°(叔)卤代烃——卤原子所连碳为三级碳 (CH 3)3CBr 叔丁基溴 5.1.2 卤代烃的命名 1. 普通命名法以卤原子为官能团,以烃基为取代基,称之某基卤。
比如: (CH 3)3C -Cl (CH 3)2CH -Cl CH 2=CH -Cl PhCH 2-Cl 叔丁基氯 异丙基氯 乙烯基氯 苄基氯 另外,多卤代烷还有一些习惯的特殊名称:CHCl 3 CHBr 3 CHI 3 称之卤仿或者三卤甲烷;CCl 4可称之四氯化碳或者四氯甲烷。
2. 系统命名法以卤原子为取代基,把卤原子看作是烃的衍生物, 以烃基或者其他官能团为官能团,基团列出顺序按顺序规则。
CH 3CH 2CH 2BrCH 3CHCH 3Br1-溴丙烷 2-溴丙烷 顺-1-甲基-2-氯环已烷5.2卤代烃的结构特征与物理性质5.2.1 卤代烷的结构卤代烷结构上的共同特征是烷基链上的一个sp 3碳与电负性元素(如F, Cl, Br, I )的p 轨道形成σ单键。
第五章卤代烷教学目的与要求:1.学会卤代烃的命名方法;2.掌握卤代烃的结构,了解卤代烃的物理性质;3.掌握卤代烃的反应、制备及亲核取代反应的机理。
教学重点、难点:1.卤代烃的亲核反应机理,S N2 机理和S N1 机理;2.S N2和S N1立体化学;3.影响S N2和S N1反应的因素;4.格氏试剂的制备和应用。
5.1 卤代烃的分类和命名5.1.1 卤代烃的分类1. 按卤原子的个数分类(1)单卤代烃:CH3Cl 一氯甲烷;CH3CH2Br 溴乙烷Ph-CH2Br 苄基溴(2)多卤代烃:CHCl3氯仿;CH2BrCH2Br 1,2-二溴乙烷2. 按卤原子所连碳的级数分类1°(伯)卤代烃——卤原子所连碳为一级碳CH3CH3CH2Br 1-溴丙烷2°(仲)卤代烃——卤原子所连碳为二级碳CH3CHBrCH32-溴丙烷3°(叔)卤代烃——卤原子所连碳为三级碳(CH3)3CBr 叔丁基溴5.1.2 卤代烃的命名1. 普通命名法以卤原子为官能团,以烃基为取代基,称为某基卤。
例如:(CH3)3C-Cl (CH3)2CH-Cl CH2=CH-Cl PhCH2-Cl叔丁基氯异丙基氯乙烯基氯苄基氯另外,多卤代烷还有一些习惯的特殊名称:CHCl3 CHBr3 CHI3称为卤仿或三卤甲烷;CCl4可称为四氯化碳或四氯甲烷。
2. 系统命名法以卤原子为取代基,把卤原子看作是烃的衍生物,以烃基或其他官能团为官能团,基团列出顺序按顺序规则。
CH3CH2CH2BrCH3CHCH3Br1-溴丙烷2-溴丙烷顺-1-甲基-2-氯环已烷5.2 卤代烃的结构特征和物理性质5.2.1 卤代烷的结构卤代烷结构上的共同特征是烷基链上的一个sp3碳与电负性元素(如F, Cl, Br, I)的p轨道形成σ单键。
5.2.2偶极矩(dipole moment)虽然碳-卤键都是共价键,但它们具有极性,也就是说,电子密度“重心”与原子核的正电荷中心不相重合。
这种不平衡产生一个偶极矩μ,表示为电荷q与核间距d的乘积:μ = q⨯d偶极-偶极相互作用(dipole-dipole interactions),它是一种比范德华引力强的分子间作用力。
5.2.3沸点一些一卤代物的沸点见表5.3o沸点顺序:RH<RF<RCl<RBr<RI。
从表中看出,较低分子量的正卤代烷在室温是气体。
从正氟丁烷、正氯丙烷、溴乙烷和碘甲烷开始,以后的卤代烷在室温则为液体。
这个结果主要是由于随着周期表向下移动,卤素的原子半径逐渐增大,于是分子间接触面积增大,从而范德华引力增加,导致沸点升高。
那么,拿分子大小类似的RBr 与RCH3(溴的范德华半径1.95Ǻ和甲基的范德华半径2.0Ǻ很类似)比较,会得到什么结果呢?溴代烷RBr比相应的烷烃RCH3的沸点高得多。
这是什么原因呢?可以用原子或基团的可极化性(polarizability)来解释这一现象。
5.2.4卤代烷的密度和溶解度卤代烷中密度随卤素原子序数的增加而增加,随碳原子数的增加而减小。
一氟代烷和一氯代烷的密度小于1,一溴代烷和一碘代烷的密度大于1,例如:氯乙烷、溴乙烷和碘乙烷的密度分别为0.903,1.460,卤代烷虽是极性分子,但是只有氟代烷能形成氢键。
因此,卤代烷中氟代烷的水溶性最好。
其它卤代烷的水溶性均比相同碳数的醚和醇的水溶性小。
5.3 一卤代烷的化学反应5.3.1取代反应1. 亲核取代反应的定义及基本形式卤代烷中卤原子的电负性很强,使C-X 键的电子对偏向卤原子,碳原子上带有部分正电荷,容易受富电子的亲核试剂进攻,卤原子带一对电子以负离子的形式离开,由于此类反应是亲核试剂来进攻带正电荷或部分正电荷的卤代烃中的碳原子,因此称为亲核取代反应(Nucleophilic Substitution reaction),用S N 来表示,反应的一般式为:2.卤代烃五大基本类型的亲核取代反应(1)被羟基取代卤代烷与NaOH水溶液共热,卤原子则被羟基—OH取代,产物是醇:RX+NaOH ROH+NaX这个反应也叫做卤代烃的水解反应。
一般卤代烷都可由相应的醇制得,故对于较简单的卤代烷,这个反应的合成价值不高。
而对于一些比较复杂的分子,引入一个羟基常比引入一个卤素原子困难。
故在合成上往往先引入卤素原子,然后水解再引入羟基。
例如工业上将一氯戊烷的各种异构体混合物通过水解反应制得戊醇各种异构体的混合物,用作工业溶剂。
卤代烷水解反应速度与卤代烷的结构、反应溶剂及反应条件等有关。
卤代烷水解反应的研究为探讨亲核取代反应机理提供了很多重要信息(见5.4及5.5)。
(2)被烷氧基取代卤代烷与醇钠作用,卤原子被烷氧基(RO-)取代而生成醚。
这是制备混合醚的方法,叫做Williamson 合成法。
RX+NaOR NaOR'+NaX这个反应所用的卤代烷,一般是伯卤代烷、烯丙基卤代烃及苄基卤代烃。
若用叔卤代烷与醇钠反应,往往发生消去反应得到烯烃,而不是亲核取代反应。
例如:2-甲基-2-溴丁烷在2mol·L-1浓度的乙醇钠乙醇溶液中进行反应,取代和消除产物的比例为1︰99。
(3)被氨基取代卤代烷与氨作用,卤原子可被氨基(—NH2)取代生成胺。
RX+NH3RNH2+HX由于氨(包括生成的胺)比水及醇具有更强的亲核性,故此反应得到的伯胺RNH2会进一步与卤代烷反应生成仲胺R2NH、叔胺R3N、及季銨盐R4N+X-。
若要制备伯胺,需要卤代烷与过量的NH3作用。
(4) 被氰基取代卤代烷与NaCN 或KCN 的醇溶液共热,则氰基(—CN)取代卤原子而得腈,腈水解可得羧酸、酰胺等。
RX+NaCNRCN+NaX生成的产物比反应物多一个C 原子。
这是有机合成中增长碳链的方法之一。
(5) 与AgNO 3的反应卤代烃与AgNO 3的乙醇溶液作用生成硝酸酯和卤化银沉淀,也是亲核取代反应之一。
由于这个反应对于鉴别不同烃基结构及不同卤素原子的卤代烃很有用。
因此单独作为一个反应来讨论。
RX+AgNO RNO 3+AgX硝酸酯RX ,AgNO 3 和硝酸酯都能溶于乙醇,但AgX 不溶。
卤代烃中烃基结构不同,生成AgX 沉淀的速度不同。
在室温下,烯丙基卤代烃、苄基卤代烃及叔卤代烃与 AgNO 3的醇溶液立即作用生成AgX 沉淀;而仲卤代烷反应较慢;伯卤代烷与AgNO 3作用需要加热条件下才能有AgX 沉淀生成;对乙烯基卤代烃及卤代芳烃,加热也不能发生反应。
因此,从反应进行的难易程度,可以鉴别不同烃基结构的卤代烃。
如果烃基结构相同,卤原子不同,反应活性也不同。
其活性顺序为: 碘代烃>溴代烃>氯代烃。
而且不同卤原子的卤代烃与AgNO 3反应生成的 AgX 沉淀的颜色也不同。
由此鉴别不同卤原子的卤代烃。
5.3.2 消除反应具有β-H 原子的卤代烃,在碱的醇溶液中加热,能从卤代烃分子中脱出一分子卤化氢而形成烯烃。
这种由一个分子中脱出一些小分子,例H 2O 、HX 等,同时产生C =C 双键化合物的反应叫消除反应,又称消去反应(Elimination ,简写为E)。
H C CX + CH 3CH 2ONaCH CH OH+CH 3CH 3OH+NaX卤代烃的脱卤代氢反应是在分子中引入C =C 双键的方法之一。
对于卤代烃的消除反应要注意如下几点:(1)仲或叔卤代烃脱卤化氢反应时,主要是脱去X 及含氢较少的β-C 原子上的H 。
主要产物是双键碳上含支链最多的烯烃,这叫做查依采夫(Saytzeff )规则。
(2)不同结构的卤代烃, 脱卤化氢的难易程度为:三级卤代烃 > 二级卤代烃 > 一级卤代烃 (3)消除反应与亲核取代反应为竞争反应, 前者得到碱进攻β-H 原子后的产物, 后者得到亲核试剂进攻α-C 原子,取代卤原子的产物。
反应物结构特征,试剂碱性大小,试剂亲核性强弱,溶剂极性,反应温度等都对竞争反应有影响。
有些二卤代烃在碱的醇溶液中消去二分子卤化氢生成炔烃。
这是分子引入C ≡C 化合物的方法之一。
5.3.3 还原反应卤代烃可由LiAlH 4或NaBH 4还原成烷烃。
RX[H]RHLiAlH 4反应活性高,选择性低,能还原许多基团,但NaBH 4有较高的选择性,不能还原COOH ,CN ,COOR 等。
反应中LiAlH 4或NaBH 4提供氢负离子H -,它以游离或不完全游离的形式作为亲核试剂进攻卤代烃中α-C 原子,卤素原子带着一对电子离去。
伯卤代烷反应速度最大,仲卤代烷次之,叔卤代烷最小。
对于相同烃基结构的卤代烃,碘代烷反应速度最大,溴代烷次之,氯代烷较小。
卤代烃也能被锌和盐酸、钠和液氨等活性氢还原剂还原为烃,还能被 Pd 等催化氢解为烃。
5.4卤代烃亲核取代反应反应机理——SN1和SN25.4.1 卤代烃亲核取代反应动力学研究我们首先通过一溴甲烷 CH 3Br 和叔丁基溴(CH 3)3CBr 的水解反应来研究卤代烃亲核取代反应的速率。
CH 3Br+OH 2CH 3CH 2OHCH 3OH+BrH根据实验测得,此反应的反应速率ν=k[CH 3Br][OH -],证明该反应动力学上是二级反应,其反应速率同时与两种反应物溴甲烷和水的浓度有关,我们称此种反应机理为双分子亲核取代机理即S N 2反应机制。
(CH 3)3CBr+OH 2CH 3CH 2OH(CH 3)3COH+BrH根据实验测得,此反应的反应速率ν=k[(CH 3)3CBr],证明该反应动力学是一级反应,其反应速率只与一种反应物即叔丁基溴的浓度有关,我们称此种反应机理为单分子亲核取代机理即 S N 1 反应机制。
5.4.2 S N 2反应机制的历程和特点S N 2 反应是同步过程,即亲核试剂 OH - 从反应物离去基团 Br - 的背面,向与它相连的碳原子进攻,先与碳原子形成比较弱的键,同时离去基团 Br - 与碳原子的键有一定减弱,两者与碳原子成一直线形,碳原子上另外三个键逐渐由伞形变为平面,这需要能量,即活化能。
当反应进行达到能量最高状态即过度态后,碳原子与离去基团Br -之间的键断裂,碳原子上三个键由平面向另一边偏转,整个过程犹如大风将雨伞由里向外翻转一样,这时就要释放能量,形成产物。
S N 2的反应机制用一般式表示为:S N 2 反应机制的特点a.亲核试剂先沿C-X 键轴背面进攻,然后再断裂 C-X 键,即典型的“先进攻,再断键”;b.过渡态有五个基团,中心碳原子由sp3杂化转化为sp2杂化;排斥力加大,空阻效应影 响显著;c.反应后原手性碳构型发生翻转;d.亲核试剂的亲核性强对反应有利。
S N 2 反应立体化学: 构型翻转5.4.3 S N1反应机制的历程和特点S N1反应机制是分步进行的,反应物首先离解为碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,也是慢的一步。