第5章卤代烃
- 格式:doc
- 大小:156.00 KB
- 文档页数:14

第五章卤代烷卤代烷可以看作是烃分子中一个或多个氢取代后所生成的化合物。
其中卤原子就是卤代烃的官能团。
R-X, X=Cl.、Br、I 、F。
卤代烃的性质比烃活泼得多,能发生多种化学反应,转化成各种其他类型的化合物。
所以,引入卤原子,往往是改造分子性能的第一步加工,在有机合成中起着桥梁的作用。
自然界极少含有卤素的化合物,绝大多数是人工合成的。
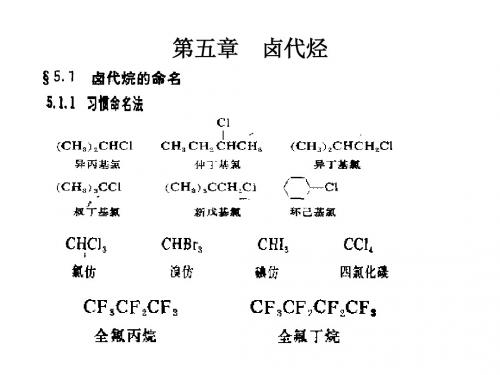
§1.卤代烷的命名1.结构简单的卤代烃可以按卤原子相连的烃基的名称来命名,称为卤代某烃或某基卤。
(CH3)2CHBr,溴代异丙烷(异丙基溴); C6H5CH2Cl,氯代苄(苄基氯)2.较复杂的卤代烃按系统命名法命名:以含有卤原子的最长碳链作为主链,将卤原子或其他支链作为取代基。
命名时,取代基按“顺序规则”较优基团在后列出。
[烷烃为母体]卤代环烷则一般以脂环烃为母体命名,卤原子及支链都看作是它的取代基。
[卤代环烷命名]较小的(原子序数小的)基团,编号最小§2 一卤代烷的结构和物理性质1.一卤代烷的结构卤代烷的同分异构体数目比相应的烷烃的异构体数多。
如一卤代烷除了具有碳干异构体外,卤原子在碳链上的位置不同,也会引起同分异构现象。
2.偶极矩在卤代烷分子中,由于卤原子的电负性大于碳,使C-X键的电子云偏向卤原子,使C-X键成为一个极性共价键。
3.物理性质(自学)§3.一卤代烷的化学反应卤代烷的化学性质活泼,这是由于官能团卤原子引起的。
卤代烷分子中的碳卤键是极性共价键,当极性试剂与它作用时,C-X键在试剂电场的诱导下极化,由于C-X键的键能(除C-F键外)都比C-H键小(C-I 218KJ/mol; C-Br 285;C-Cl 339; C-H 414)。
因此,C-X键比C-H键容易异裂而发生各种化学反应。
1.亲核反应Nu:OH,RO- ,HS- ,RS-,-CN ,R-COO-, NH3这些进攻的离子或分子都能供给一对电子与缺电子的碳形成共价键,它们具有亲核的性质,称为亲核试剂。

第五章卤代烃一、学习要求1、理解卤代烃的概念、分类,掌握卤代烃的命名。
2、掌握卤代烃的结构和化学性质。
3、了解卤代烃亲核取代反应、消除反应的机制和两种反应的关系。
4、了解有机氟化物的基本特点和一些氟代烷在医药及其它方面的应用。
二、本章要点(一)卤代烃的定义、分类卤代烃(halohydrocarbon)是烃分子中一个或多个氢原子被卤原子取代所生成的化合物,用通式RX(X=F、Cl、Br、I)表示。
(二)卤代烃的命名卤代烃常用系统命名法命名,即以X作取代基,相应的烃作母体,书写形式与烃相同。
简单卤代烃也可采取普通命名法,即卤素名+ 烃的名称或烃基名+ 卤素名。
(三)卤代烃的结构卤代烃的结构特点是碳卤键具有极性Cδ+-Xδ-,α-C带部分正电荷。
(四)卤代烃的化学性质1、卤代烷的化学性质带部分正电荷的α-C易受亲核试剂的进攻而发生亲核取代反应;X的-I效应使β-H酸性增强,可与强碱发生消除反应。
(1)亲核取代反应:α-C受亲核试剂的进攻,X带着一对电子离去,亲核试剂取代X的位置,生成各种取代物。
常见的亲核试剂有-OH、-OR、-CN、NH3、-ONO2等。
亲核取代反应的机制有S N1、S N2两种,反应按何种机制进行,影响因素有烷基的结构、试剂的亲核性、溶剂的极性、离去基团的离去能力等。
(2)消除反应:卤代烷的β-H与碱作用,最终X和β-H从分子中脱去,发生消除反应。
当仲卤代烷或叔卤代烷有不同类型的β-H时,产物取向遵循Saytzeff(查依切夫)规则,即消除反应的主产物是双键碳原子上连烃基最多的烯烃或对称性最好的烯烃。
消除反应也有两种机制,即E 1、E 2。
反应机制同样受反应条件的影响。
(3)亲核取代反应和消除反应的关系:亲核取代反应和消除反应往往同时发生,相互竞争。
发生S N 1的条件也有利于E 1发生;发生S N 2的条件也有利于E 2发生。
同一卤代烷按不同机制进行反应生成产物的比例由烷基的结构、溶剂的极性、试剂的亲核性和碱性、反应的温度所决定。

医用有机化学课后习题答案(2009)第1章 绪 论习 题7 指出下列结构中各碳原子的杂化轨道类型(1)CH 3CH 2OCH 3 (2)CH 3CH=CH 2 (3)CH 3CH 2≡CH (4)CH 3CH=CH-OH解:第2章 链 烃习 题1 用IUPAC 法命名下列化合物或取代基。
解:(1)3,3-二乙基戊烷 (2)2,6,6-三甲基-5-丙基辛烷 (3)2,2-二甲基-3-己烯 (4)3-甲基-4-乙基-3-己烯 (5)4-甲基-3-丙基-1-己烯 (6)丙烯基 (8)2,2,6-三甲基-5-乙基癸烷 (9)3-甲基丁炔3 化合物2,2,4-三甲基己烷分子中的碳原子,各属于哪一类型(伯、仲、叔、季)碳原子? 解:CH 3CCH 3CH 3CH 2CHCH 3CH 2CH 31°4°1°2°1°3°2°1°1°4 命名下列多烯烃,指出分子中的π—π共轭部分。
解:(1) 2–乙基–1,3–丁二烯(2) 2–乙烯基–1,4–戊二烯(3) 3–亚甲基环戊烯(4) 2.4.6–辛三烯spsp2sp 3sp 2sp 2spsp 2CH 3CH=CH 2sp 2(1) (2)(3)CH 3CH 2≡CH (4)CH 3CH=CH-OH CH 3CH 2OCH 3sp 3sp3sp 3sp 3(5)5–甲基–1.3–环己二烯(6)4–甲基–2.4–辛二烯9 将下列自由基按稳定性从大到小的次序排列: 解:(3)>(2)>(1)>(4)10 按稳定性增加的顺序排列下列物质,指出最稳定者分子中所含的共轭体系。
解:(1)d >b >c >a (2)d >c >b >a12下列化合物有无顺反异构现象?若有,写出它们的顺反异构体。
解:(1)无 (2)有C=CCH 3HH 2H 5C =CCH 3HHC 2H 5(3)有C =CHC =CH BrCl C 4H 9Br ClC 4H 9(4)有3C =CBrCl HCH 3C =CBr ClH(6)有C =CC 2H 5CH 3C 2H 5CHCH 3CH 3C =CC 2H 5CH 32H 5CHCH 3CH 314 经高锰酸钾氧化后得到下列产物,试写出原烯烃的结构式。


5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。
第5章 卤代烃5.1基本要求● 掌握卤代烃的分类和命名方法。
● 掌握卤代烃的化学性质。
● 掌握卤代烃的亲核取代反应和β-消除反应的机理及其影响因素。
● 掌握不同种类卤代烯烃的亲核取代活性。
● 掌握卤代烃与金属的反应及Grignard 试剂的应用。
5.2基本知识点5.2.1 卤代烃的分类根据分子中卤原子数目的不同分为单卤代烃和多卤代烃;还可以根据不同卤原子又分为氟代烃、氯代烃、溴代烃和碘代烃;根据烃基不同分为卤代烷烃、卤代烯烃和卤代芳烃;根据卤原子所连接的碳原子类型又分为叔卤代烃、仲卤代烃和伯卤代烃。
5.2.2 卤代烃的命名简单的卤代烃的命名,通常根据烃基和卤素的名称将其称为“卤(代)某烃”或称为“某基卤”。
例如:CH 2==CH —Cl CH 3CH 2CH 2CH 2Cl氯乙烯 正丁基氯比较复杂的卤代烃,一般采用系统命名法。
卤代烃的系统命名法是以烃为母体,卤原子为取代基,将卤原子与烃基一起按次序规则顺序排列在母体烃之前。
例如:CH 3 CH CH 2 CH CH 3— — — — |CH 3|BrC H 3 C H C H C H C H 3— — — — |B r —2-甲基-4-溴戊烷 4-溴-2-戊烯5.2.3卤代烃的性质卤代烃的化学性质主要是亲核取代反应、消除反应,此外,卤代烃与活泼金属生成Grignard 试剂。
1. 亲核取代反应:卤代烃能与许多亲核试剂作用,生成各种取代产物。
H 2OR O H + N aX — N aO HR O R' + N aX — N aO — C N + N aX — N aC NC 2H 5O H2 + HX — N H3 R O N O 2 + A gX ↓ — A gN O 3R X — +卤代烃的亲核取代反应根据卤代烃的结构及反应条件不同可分为单分子亲核取代反应(S N1)和双分子亲核取代反应(S N2)。
叔卤代烷主要发生S N1反应,伯卤代烷主要发生S N2反应,仲卤代烷既可发生S N1反应也可发生S N2反应。
S N1机理的特点可总结为:①反应是分步进行的;②决定反应速率的步骤为单分子反应,是动力学上的一级反应;③有活泼碳正离子中间体生成,并且可能发生分子重排;④产物的构型保持和转变,即取代产物部分外消旋化。
不同卤代烃发生S N1反应的活泼性顺序为:叔卤代烃> 仲卤代烃> 伯卤代烃。
S N2反应的特点可总结如下:①取代反应不分阶段地一步连续完成,即旧键的断裂和新键的形成同时进行;②反应速率与卤代烷及亲核试剂的浓度都有关系,即双分子反应,是动力学的二级反应;③手性中心碳原子在反应过程中构型发生了完全转化。
不同卤代烃发生S N2反应的活泼性顺序为:伯卤代烃> 仲卤代烃> 叔卤代烃。
2. 消除反应由于C-X键的极性较大,可以影响到β-碳的氢原子,使其具有一定活泼性,容易受碱性试剂进攻而脱去卤化氢,在卤原子所在的中心碳原子与β-碳原子之间形成碳-碳双键,生成消除产物——烯烃。
因此反应消除的是β-碳上的氢,所以称为β-消除反应。
β-消除反应主要也按照两种不同的机理进行的,即单分子消除(E1)和双分子消除(E2)。
E1与S N1的机理相似,也是分为两步完成,卤代烷的碳卤键首先解离,生成碳正离子中间体,接着再脱去β-碳上的氢生成消除产物。
E2与S N2的机理相似,反应也是一步完成的,但消除反应是碱性试剂进攻β-碳原子上的氢并与氢结合,X带着一对电子离去,并在α碳与β碳之间形成一新的π键。
不同卤代烃发生E1和E2的活泼性顺序均为:叔卤代烃> 仲卤代烃> 伯卤代烃。
当仲卤代烃和叔卤代烃进行消除反应时,由于结构中通常有两个或两个以上β碳上的氢可供消除,实验证明,主要生成双键碳上取代基较多、结构较对称的烯烃。
这个经验规律称为Saytzeff(扎衣采夫)规律。
消除反应和亲核取代反应往往同时发生,是互相竞争性的反应,究竟哪种产物占主导,取决于卤代烷的结构和反应条件。
有些结构特殊的卤代烃进行E1或S N1反应时,其碳骨架与原来不同,分子发生重排。
3. 卤代烯烃的取代反应根据卤素与双键的位置可将卤代烯烃分为卤代乙烯型(R-CH=CH-X)、卤代烯丙基型(R -CH=CH-CH2-X)和孤立型卤代烯烃[RCH=CH(CH2)n-X,n≥2]三类。
卤代乙烯型最不活泼,加热也不和硝酸银醇溶液反应;卤代烯丙基型最活泼,室温下即可与硝酸银醇溶液反应生成卤化银沉淀;孤立型卤代烯烃与卤代烷烃的性质相似,在加热的条件下可以和硝酸银醇溶液反应生成卤化银沉淀。
硝酸银醇溶液常用来鉴别不同结构的卤代烯烃。
4. Grignard试剂的生成卤代烃能与Li、Na、K、Mg等金属反应,生成有机金属化合物。
最常见的是卤代烃与镁在无水乙醚中反应,生成的烃基卤化镁,又称Grignard试剂,是有机合成中很常用的试剂。
R X + M g — 无水乙醚RM gX5.3 典型例题分析5.3.1 解释下列不同反应条件下的不同主产物 (1)CH 3CH 2CH 2CH 2Br CH 3CH 2CH 2CH 2O CH 3-醇(2)CH 3CH 2CH 2CH 2Br CH 3CH 2CH=CH 2(3)CH 3CH 2CH 2CH 2BrCH 3CH 2CH 2CH 2OH H 2O解:(1)与(2)比较,试剂的亲核性CH 3O -> OH -,强亲核性有利于取代产物的生成,弱亲核性和高温有利于消除产物生成,故(1)的主产物是取代,(2)的主产物是消除。
另外,(2)与(3)比较,水的极性大于醇,较大极性的溶剂有利于取代反应,较小的极性有利于消除。
5.3.2 卤代烃与醇钠反应可以制备混合醚,但制备 CH 3CH 2CH 2OC (CH 3)3却不能用CH 3CH 2CH 2ONa 和(CH 3)3CCl 的反应,为什么?制备CH 3CH 2CH 2OC (CH 3)3用什么合适?解:叔卤代烃在醇钠的作用下容易发生消除反应,故不能叔卤代烃与醇钠反应来制备混合醚,而应采用伯卤代烃与醇钠之间的反应来制备混合醚。
因此,制备CH 3CH 2CH 2OC (CH 3)3要用CH 3CH 2CH 2Cl 和(CH 3)3CONa 之间的反应。
5.3.3 按所给定的反应机理,判断并说明下列各化合物中哪个卤素最容易被取代?(1)BrC H 3CH 2Br发生S N 1反应 (2)BrBr发生S N 1反应 解:(1)BrCH 32Br (a)(b)中的(a )比(b )更容易被取代,因为(a )生成叔碳正离子比,而(b )生成伯碳正离子。
(2)Br Br (b)(a)中(b )比(a )更容易发生S N 1取代反应。
这是因为(a )的溴解离不能生成平面结构的叔碳正离子,因此,不容易解离。
而(b )可以生成较为稳定的平面结构的仲碳正离子,5.3.4 新戊基卤代烷进行S N 1和S N 2反应的活性都很低,为什么?解:新戊基卤代烷CH 3 C CH 2X ——|CH 3|CH 3按S N 1机理进行反应时,所生成的碳正离子中间体为伯碳正离子CH 3 C CH 2——|CH 3|CH 3+,其稳定性较差,形成较难,故进行S N 1机理的反应活性较低;如果按照S N 2机理进行反应,亲核试剂进攻中心碳原子受到相邻碳原子甲基的空间位阻较大,也不易进行。
5.3.5 写出下列反应的机理: (1)(CH 3)3CCH 2Br + Ag 225(CH 3)2CCH 2CH 3 + + (CH 3)2C=CH CH 3|O H (CH 3)2CCH 2CH 3|O C 2H 5(2)CH 2BrH H 2OH+O H +解: (1)(CH 3)3CCH 2Br + Ag CH 3 C CH 2——|CH 3|CH 3++ AgBr↓C H 3H 2—3|C H 3+重排C H 3 C C H 2——C H 3|C H 3+C H 3 C C H 2——C H|C H 3+C H 3 C C H 2——C H |C H 3O H 2|C H 3 C C H 2——CH 3|C H 3O H |+C H 3 C C H 2——C H |C H 3H O C2H 5|C H 3 C C H 2——C H 3|C H 3|-H+O C 2H 5++3 C C H —C H 3|C H 3——(2)CH 2H H+2++H 2O H++-H+注释 以上反应中,碳骨架都发生了变化,因此,都是经过碳正离子中间体的过程,反应过程中碳正离子重排成更稳定的结构,然后分别生成取代和消除产物。
5.4 问题5.4.1 写出 2-甲基戊烷发生单溴代的所有产物,并用系统命名法命名。
解:CH 3CHCH 2CH 2CH 3CH 2Br |2-甲基-1-溴戊烷 C H 3C H C H C H 2C H 3C H 3|B r |CH 3CCH 2CH 2CH 3CH 3|Br |2-甲基-3-溴戊烷 2-甲基-2-溴戊烷5.4.2 完成下列反应式: (1) CH 3CH 2I + NaOCH 2CH 3(2) H +/H 2OCH 3CH 2Br + NaCNC 2H 5OH解:(1) C H 3C H 2I + N aO C H 2C H 3C H 3C H 2O C H 2C H 3 (2) CH 3CH 2Br + NaCNH +/H 2OC 2H 5OHCH 3CH 2CNCH 3CH 2COOH5.4.3 将下列各组化合物发生S N 2反应的速率排序。
(1)溴乙烷、2-甲基-1-溴丙烷、2-甲基-3-溴丁烷、2,2-甲基-3-溴丁烷 (2)环己基溴、2-溴甲基环己烷、1,3-二甲基-2-溴环己烷解: (1)溴乙烷 > 2-甲基-1-溴丙烷 > 2-甲基-3-溴丁烷 > 2,2-甲基-3-溴丁烷(2)环己基溴 > 2-溴甲基环己烷 > 1,3-二甲基-2-溴环己烷注释: S N 2取代时,空间效应起主导作用,中心碳原子周围的取代基越多,越大则反应越困难。
5.4.4 写出下列卤代烷发生消去反应的主产物。
(1)2,3-二甲基-2-溴丁烷 (2)3-乙基-2-溴戊烷 (3)2-氯-1-甲基环己烷 (4)4-溴环己烯 (5)2-溴-1-苯基丁烷 解:(1)(CH 3)2C=C (CH 3)2 (2)CH 3C=C (C 2H 5)2 (3)C H 3(4) (5)C H 3注释:(1)、(2)、(3)生成双键上取代基多的烯烃(Saytzeff 烯烃);(4)、(5)生成更稳定共轭烯烃。
C H 3CHC H 2CH 2C H 2BrC H 34-甲基-1-溴戊烷5.4.5 将下列各组化合物按和硝酸银醇溶液反应的活性次序排列顺序。