2018 一轮复习沉淀溶解平衡【精】
- 格式:pptx
- 大小:2.24 MB
- 文档页数:79



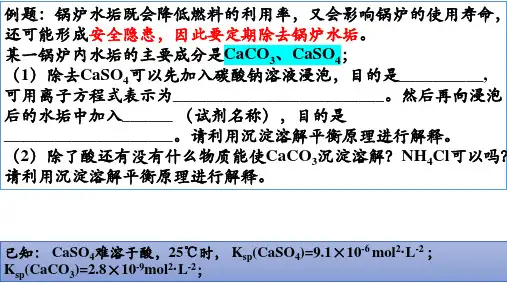
2018山东科技版化学高考第一轮复习——沉淀溶解平衡(学案含答案)2、沉淀的转化。
3、利用沉淀溶解平衡理论解释实验室及生活中的现象。
五. 知识要点:1、沉淀溶解平衡(1)沉淀溶解平衡是指______________,它的平衡常数叫______________,它是一个______________。
(2)难溶电解质与易溶电解质之间并无严格的界限,习惯上将溶解度______________的电解质称为难溶电解质,在一般情况下,相当量的离子互相反应生成______________时,可以认为反应完全了。
2、溶度积(1)在难溶电解质达到______________时,溶液中______________的乘积为一常数,叫做______________常数,简称______________,通常用______________表示。
(2)表达式)s(BAnm)aq(nB)aq(mA mn-++SPK______________(3)SPK反映了难溶电解质在水中的______________,同类型物质,SP K数值______________,难溶电解质在水中______________。
(4)SPK只与难溶电解质的______________和______________有关,而与______________无关。
3、沉淀溶解平衡应用(1)Q______________SP K有沉淀析出CQ______________SP K处于平衡状态CQ______________SP K有固体可继续溶解C(2)在难溶电解质溶液中,当______________时,就会有沉淀生成,如沉淀溶液中 2Cu,可以加入的沉淀剂是______________。
(3)当______________时,就会使沉淀溶解。
常用的方法有______________,如要使CaCO沉淀3溶解,可以加入______________降低______________的浓度,使平衡向溶解的方向移动。