高考一轮复习沉淀溶解平衡
- 格式:ppt
- 大小:859.00 KB
- 文档页数:10

2025届高三一轮化学复习---沉淀溶解平衡一、单选题1.下列实验操作正确且能达到相应实验目的的是选项实验目的实验操作A比较室温下、溶度积的大小向溶液中滴加少量NaOH 溶液,振荡充分后,再滴加几滴溶液B证明具有氧化性将一定浓度的双氧水与溶液混合C 除去乙烷中混有的乙烯一定条件下向混合气体中通入一定量的D 证明葡萄糖具有还原性在试管中加入2mL5%的溶液,再加5滴稀NaOH 溶液,混匀后加入0.5mL 葡萄糖溶液,加热A .AB .BC .CD .D 2.下列过程对应的离子方程式正确的是A .用氢氟酸刻蚀玻璃:B .用三氯化铁溶液刻制覆铜电路板:C .用硫代硫酸钠溶液脱氯:D .用碳酸钠溶液浸泡锅炉水垢中的硫酸钙:3.下列实验操作及现象与对应结论不匹配的是实验操作现象结论A加热麦芽糖和稀硫酸的混合溶液,冷却后加入NaOH 溶液至碱性,再加入银氨溶液,加热有银镜产生水解产物中一定含有还原糖B 将TiCl 4液体和FeCl 3固体分别暴露在潮湿空气中只有前者会冒“白烟”水解程度:TiCl 4>FeCl 3()2Cu OH ()2Mg OH 25mL0.2mol /LMgCl 20.2mol /LCuCl 22H O 3NaHSO 2H 4CuSO 2--+342SiO +4F +6H =SiF +3H O↑3+2+2Fe +3Cu=3Cu +2Fe2-2--+23223S O +2Cl +3H O=2SO +4Cl +6H2-2-4334CaSO +CO =CaCO +SOC向0.1mol/LNaOH 溶液滴入MgSO 4溶液至不再有沉淀产生,再滴加0.1mol/LCuSO 4溶液先有白色沉淀生成,后变为浅蓝色沉淀D在硬质试管中对石蜡油加强热,将产生的气体通入酸性KMnO 4溶液中酸性KMnO 4溶液褪色气体中含有不饱和烃A .AB .BC .CD .D4.许多过渡金属离子能形成种类繁多的配合物。

第30讲沉淀溶解平衡【考纲要求】了解难溶电解质的沉淀溶解平衡及沉淀转化的本质。
【教学重点及难点】1.理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积K SP的概念。
2.学会分析沉淀的溶解、生成和沉淀的转化。
3.掌握简单的利用K SP的表达式,计算溶液中相关离子的浓度【课前预习区】一、沉淀溶解平衡及溶度积常数1、沉淀溶解平衡方程式:请写出Cu(OH)2、BaSO4、Ag2S的沉淀溶解平衡方程式与溶度积K SP表达式【思考】前面学过哪些平衡常数?如何书写表达式?2、溶度积常数Ksp①意义:。
②影响因素:。
3、溶度积规则:判断在一定条件下沉淀能否生成或溶解(K SP与Q C的关系)Qc>K SP时,溶液为过饱和溶液,沉淀。
Qc=K SP时,溶液为饱和溶液,处于状态。
Qc<K SP时,溶液为未饱和溶液,沉淀。
4、影响沉淀溶解平衡的因素①温度:一般,升温向方向移动。
②同离子效应:在难溶电解质达沉淀溶解平衡的溶液中加入与其含有相同离子的易溶强电解质,向方向移动。
二、沉淀溶解平衡的应用1、沉淀的生成(用离子方程式表示下列过程)(1)用氨水除NH4Cl中的FeCl3(2)用Na2S沉淀Cu2+(3)用H2S沉淀Hg2+2、沉淀的溶解(用离子方程式表示)(1)酸碱溶解法:例如CaCO3溶于盐酸(2)生成配合物溶解法:例如向AgCl沉淀中滴加氨水3、沉淀的转化(1)实质:。
(2)特点:一般,溶解能力相对较的物质易转化为溶解能力相对较的物质。
(3)应用:常用FeS除去工业废水的Hg2+等重金属离子(用离子方程式表示)[自主练习]1.将AgNO3溶液依次加入氯化钠溶液、溴化钠溶液、碘化钾溶液中都会出现不同颜色的沉淀,沉淀的颜色变化是 ____ 色→ ____色_ → ___ 色_。
2.BaSO4(Ksp=1.1×10-10)比BaCO3(Ksp=5.1×10-9)的溶解度小,为什么在饱和Na2CO3溶液中,能发生BaSO4→BaCO3的转化?在工业上该转化有什么意义?3.你认为的天然水中的Ca(HCO3)2和Mg(HCO3)2在加热时是如何反应的?天然水加热形成的水垢的成分是。

高考化学一轮总复习教师用书:
沉淀溶解平衡图像及分析
必备知识·梳理夯实
知识梳理
1.两类沉淀溶解平衡图像
(1)沉淀溶解平衡——浓度图像
①典型示例(以某温度下AgBr在水中的沉淀溶解平衡曲线为例)
②图中点的变化及分析
a →c曲线上变化,增大c(Br-)
d→c加入AgNO3(忽略溶液体积变化)
c→a曲线上变化,增大c(Ag+)
曲线上方的点表示有沉淀生成,曲线下方的点表示不饱和溶液,曲线上的点处于平衡状态
(2)沉淀溶解平衡——对数图像
图像分析
pM=-lg c(M) (M:Mg2+、Ca2+、Mn2+),p c(CO2-3)=-lg c(CO2-3)
横坐标数值越大,c(CO2-3)越小
纵坐标数值越大,c(M)越小
线上方的点为相应物质的不饱和溶液线下方的点表示有相应物质的沉淀生成
线上的点为相应物质的饱和溶液
根据线上任意一点的坐标,可计算相应物质的K sp
沉淀滴定曲线是沉淀滴定过程中构成难溶电解质的离子浓度与沉淀剂加入量之间的关
系曲线。
T℃,分别向10.00 mL 0.1 mol·L-1的KCl和K2CrO4溶液中滴加0.1 mol·L-1AgNO3溶液,滴定过程中-lg c(M)(M为Cl-或CrO2-4)与AgNO3溶液体积(V)的变化关系如图所示。
(1)曲线L1代表与-lg c(Cl-) 与V(AgNO3溶液)的变化关系。
(2)T℃时,溶度积K sp(Ag2CrO4)= 4.0×10-12。
(3)相同实验条件下,若改为0.05 mol·L-1的KCl和K2CrO4溶液,则曲线L2中N点向点Q上方移动。


主题23:沉淀溶解平衡命题一沉淀溶解平衡图像12022年全国Ⅲ卷,13在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。
可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。
根据溶液中平衡时相关离子浓度的关系图,下列说法错误..的是。
CuCl的数量级为10-7Cu22Cl-2CuCl越多,Cu浓度越高,除Cl-效果越好Cu2Cu平衡常数很大,反应趋于完全【解析】当-lg c(Cl-)mol·L-1=0时,lg c(Cu+)mol·L-1约为-7,即cCl-=1mol·L-1,cCu=10-7mol·L-1,因此K s c(Cu2+)c2(Cu+)ol·L-1代入平衡常数的表达式中计算,即K=1×10-6(1×10-6)2=1×106,因此平衡常数很大,反应趋于完全,D项正确。
【答案】C22022年全国Ⅰ卷,11溴酸银AgBrO3溶解度随温度变化曲线如下图所示。
下列说法错误..的是。
A溴酸银的溶解是放热过程B温度升高时溴酸银溶解速度加快℃时溴酸银的K s O3-O32−O32−O32−O32−O3-O32−H4+O42−ol·L-1时,溶液中cAg为mol·L-1,此时溶液中cCr O42−等于mol·L-1。
已知Ag2CrO4、ol·L-1。
AgCl的K s c(I-)c(Cl-)②某溶液含·L-1Mn2、·L-1H2S,当溶液ol·L-1,需调节溶液ol·L-1时,即可认为该离子沉淀完全;继续加碱至ol·L-1,=×10-5mol·L-1。
结合溶液中可求出溶液中cAg=K sp(AgCl)c(Cl-)cAg=×10-5mol·L-1和K s O42−K sp(Ag2CrO4)ol·L-1。


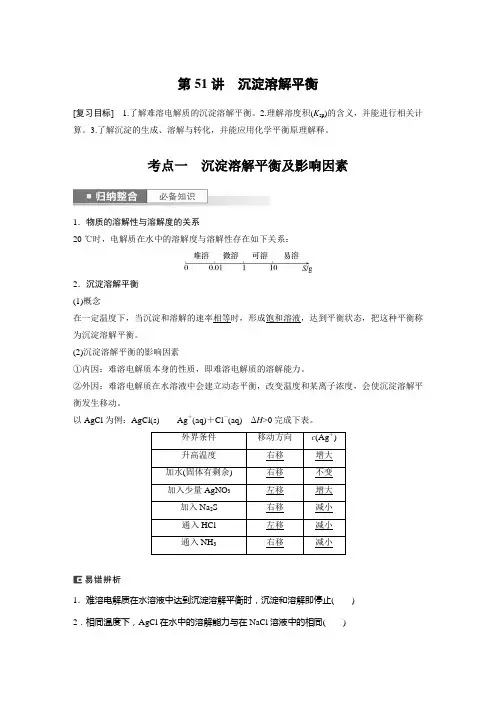
第51讲沉淀溶解平衡[复习目标] 1.了解难溶电解质的沉淀溶解平衡。
2.理解溶度积(K sp)的含义,并能进行相关计算。
3.了解沉淀的生成、溶解与转化,并能应用化学平衡原理解释。
考点一沉淀溶解平衡及影响因素1.物质的溶解性与溶解度的关系20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:2.沉淀溶解平衡(1)概念在一定温度下,当沉淀和溶解的速率相等时,形成饱和溶液,达到平衡状态,把这种平衡称为沉淀溶解平衡。
(2)沉淀溶解平衡的影响因素①内因:难溶电解质本身的性质,即难溶电解质的溶解能力。
②外因:难溶电解质在水溶液中会建立动态平衡,改变温度和某离子浓度,会使沉淀溶解平衡发生移动。
以AgCl为例:AgCl(s)Ag+(aq)+Cl-(aq)ΔH>0完成下表。
外界条件移动方向c(Ag+)升高温度右移增大加水(固体有剩余) 右移不变加入少量AgNO3左移增大加入Na2S 右移减小通入HCl 左移减小通入NH3右移减小1.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止()2.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同()3.难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动()答案 1.× 2.× 3.×1.将足量BaCO3固体分别加入:①30 mL水;②10 mL 0.2 mol·L-1Na2CO3溶液;③50 mL 0.01 mol·L-1 BaCl2溶液;④100 mL0.01 mol·L-1盐酸中溶解至溶液饱和。
所得溶液中c(Ba2+)由大到小的顺序为____________________________。
答案③>④>①>②2.已知溶液中存在平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)ΔH<0,下列有关该平衡体系的说法正确的是()①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下,向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥B.①⑥⑦C.②③④⑥D.①②⑥⑦答案 A解析加入碳酸钠粉末会生成CaCO3,使Ca2+浓度减小,②错;加入氢氧化钠溶液会使平衡左移,有Ca(OH)2沉淀生成,但Ca(OH)2的溶度积较大,要除去Ca2+,应把Ca2+转化为更难溶的CaCO3,③错;恒温下K sp不变,加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH 不变,④错;加热,Ca(OH)2的溶解度减小,溶液的pH降低,⑤错;加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,⑥正确;加入NaOH 固体,沉淀溶解平衡向左移动,Ca(OH)2固体质量增加,⑦错。

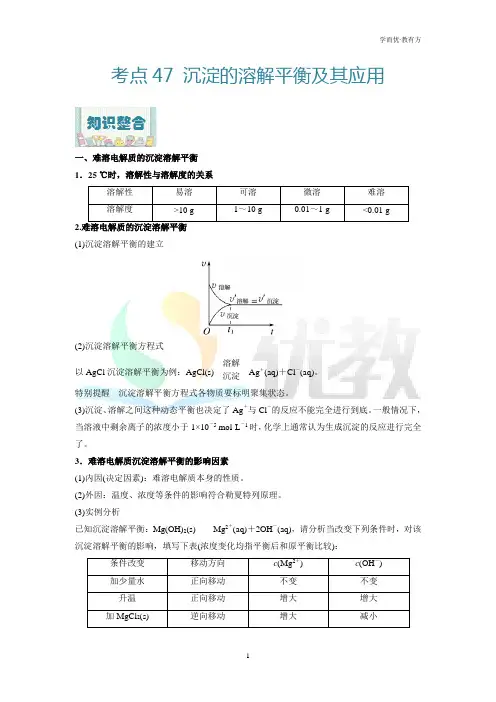
考点47 沉淀的溶解平衡及其应用一、难溶电解质的沉淀溶解平衡1.25 ℃时,溶解性与溶解度的关系溶解性易溶可溶微溶难溶溶解度>10 g 1~10 g 0.01~1 g <0.01 g 2.难溶电解质的沉淀溶解平衡(1)沉淀溶解平衡的建立(2)沉淀溶解平衡方程式以AgCl沉淀溶解平衡为例:AgCl(s)溶解沉淀Ag+(aq)+Cl-(aq)。
特别提醒沉淀溶解平衡方程式各物质要标明聚集状态。
(3)沉淀、溶解之间这种动态平衡也决定了Ag+与Cl-的反应不能完全进行到底。
一般情况下,当溶液中剩余离子的浓度小于1×10-5 mol·L-1时,化学上通常认为生成沉淀的反应进行完全了。
3.难溶电解质沉淀溶解平衡的影响因素(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒夏特列原理。
(3)实例分析已知沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较):条件改变移动方向c(Mg2+) c(OH-)加少量水正向移动不变不变升温正向移动增大增大加MgCl2(s) 逆向移动增大减小加盐酸正向移动增大减小加NaOH(s) 逆向移动减小增大特别提醒大多数电解质溶解度随温度的升高而增大,但有许多例外,如Ca(OH)2,温度越高,溶解度越小。
二、溶度积常数1.概念难溶电解质的沉淀溶解平衡常数称为溶度积常数,简称溶度积,符号为K sp,K sp的大小反映难溶电解质在水中的溶解能力。
2.表达式A mB n(s)m A n+(aq)+n B m-(aq)K sp=c m(A n+)·c n(B m-)。
如:Fe(OH)3(s)Fe3+(aq)+3OH-(aq)K sp=c(Fe3+)·c3(OH-)。
3.影响因素溶度积K sp值的大小只与难溶电解质本身的性质和温度有关。

考点七十三沉淀溶解平衡聚焦与凝萃1.了解难溶电解质的沉淀溶解平衡;2.了解难溶电解质的沉淀转化的本质。
解读与打通常规考点一、难溶电解质溶解平衡1.难溶电解质溶解平衡的概念:在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
2.溶解平衡的建立:在AgCl的溶液中,一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面溶于水中AgCl= Ag++ Cl-;另一方面,溶液中的Ag+和Cl-受AgCl表面正、负离子的吸引,回到AgCl的表面析出沉淀,Ag++Cl-=AgCl↓。
在一定温度下,当沉淀溶解和生成的速率相等时,便得到了AgCl的饱和溶液,即建立如下动态平衡:AgCl(s)Cl-(aq)+Ag+(aq)难溶电解质的溶解平衡也是有条件的,条件变化,平衡破坏。
如上述的沉淀和溶解平衡就受温度、浓度等的影响,通过条件的变化可以使沉淀生成、沉淀溶解,也可以使沉淀转化。
固体溶质溶液中的溶质①v溶解>v沉淀,固体溶解②v溶解=v沉淀,溶解平衡③v溶解<v沉淀,析出晶体3.溶解平衡的特点:4.影响沉淀溶解平衡的因素(1)内因:难溶电解质本身的性质,这是决定因素。
(2)外因:①浓度:加水,平衡向溶解方向移动,但K sp不变。
②温度:升温,多数平衡向溶解方向移动,多数难溶电解质的溶解度随温度的升高而增大,升高温度,平衡向溶解方向移动,K sp增大。
③其他:向平衡体系中加入可与体系中的某些离子反应的更难溶解或更难电离或气体的离子时,平衡向溶解方向移动,但K sp不变。
以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例外界条件移动方向平衡后c(Ag+) 平衡后c(Cl-) K sp升高温度正向增大增大增大加水稀释正向减小减小不变加入少量AgNO3逆向增大减小不变通入HCl 逆向减小增大不变通入H2S 正向减小增大不变520 ℃时,电解质在水中的溶解度与溶解性存在如下关系:物质溶解性的大小是相对的,AgCl、BaSO4等的难溶也不是绝对的不溶。