酶促反应动力学 碱性磷酸酶Km值测定
- 格式:ppt
- 大小:2.12 MB
- 文档页数:25

碱性磷酸酶km值的测定实验报告篇一:碱性磷酸酶Km值得测定(1)碱性磷酸酶Km值得测定原理在适宜条件下,酶促反应的初速度随底物浓度【S】增大而增大,当底物浓度达一定时则反应趋于稳定,反应速度最大。
关系可用米氏方程表示Km是酶的特征性常数。
将米氏方程变形为双倒数方程对1/S作图可算出Km步骤,以1/V结果由y=+算出当y=0时x=,继而算出Km值=L讨论计算出来的Km值与查资料所得到的值有一定的差距。
1实验是粗测,本身存在实验误差,我们在操作过程中也造成误差,所以导致与实际值差距较大。
尿蛋白定性检测原理加热可以使蛋白质变性,溶液pH等于pI时溶解度最小。
步骤1.取大试管一支,加入5ml澄清尿液。
2.用试管夹持试管上端,酒精灯加热尿液斜面至沸。
3.滴加5%乙酸2~3滴于尿液表面,轻轻混匀局部,加热。
结果未加热部分是澄清,加热部分浑浊明显讨论正常尿液中不会出现浑浊,本实验尿液加入了蛋白质。
尿液中如果出现沉淀则说明出现了病症。
分子筛层析(凝胶过滤法)原理多孔凝胶对不同大小分子的排阻效应,使不同分子分离。
大分子先出,小分子后出。
步骤1.取5~8滴4mg/ml蓝色葡萄聚糖液和4滴2mg/ml重铬酸钾液混匀。
2.将层析柱出水口打开,缓放柱内液体至凝胶柱表面加入2混匀的待层析液。
3.从上口缓加蒸馏水,成2~3cm高水柱,出水口用小试管接水。
4.在上口加洗脱液洗脱。
每支小试管接1cm液体,并编号。
5.观察不同小试管的液体颜色的变化。
结果讨论分子筛层析能够大致的分离分子量不同的物质,但是分离的物质不纯有杂质,实验时间也相对较长,操作复杂。
篇二:碱性磷酸酶的Km测定篇三:酶工程实验报告五(纤维素酶米氏常数—Km的测定)本科学生实验报告学号 0姓名孙永升学院实验课程名称酶工程 < 实验 >教师及职称开课学期至学年填报时间年月日云南师范大学教务处编印13234km操作流程:A稀释:原酶液底物B预热 : 各预热10minC取液 :稀释到10000倍的纤维素酶液不同浓度的底物溶液D反应50 水浴中保温30minF 测定3mLDNS反应终止沸水浴5min 定容至25ml 测定OD540吸光值G 作双倒数图求Km实验注意事项本实验是一个定量测定方法,为获得准确的实验结果,应尽量减少实验操作中带来的误差。


碱性磷酸酶米氏常数的测定实验报告实验目的:1、学习和掌握米氏常数(Km)及最大反应速度(Vm)的测定原理。
2、测定牡蛎碱性磷酸酶水解对硝基苯磷酸钠盐时的Km和Vm值u。
实验原理:1、米氏方程:V=Vm[S]/Km+[S]其中[S]为底物浓度;v为初速度;Vm为最大反应速度;Km为米氏常数.Vm/2=Vm[S]/Km+[S]Km=[S]Km值等于酶促反应速度为最大反应速度一半时的底物浓度,单位是浓度单位。
米氏常数K是酶的一个基本特征常数。
2、动力学参数的测定:测定Km和Vm,可通过作图法求得。
最常用的Lineweaver-Burk双倒数作图法米氏方程转化为倒数形式,即:1/v=Km/Vm*1/[S]+1/Vm3、本实验测定碱性磷酸酶催化对硝基苯磷酸钠盐(pNPP)水解的Km和Vm反应式:产物对硝基苯酚pNP在405nm波长有吸收可通过分光光度法测定产物pNP的含量测定并制作产物pNP的标准曲线根据催化反应产生的产物OD值从标准曲线求出产物浓度,换算成反应速度v。
实验试剂与器材:试剂:0.5μmol/mL pNP 溶液、10 mmol/L pNPP溶液、20 mmol/L MgCl2,溶液、0.1 mol/L 碳酸钠-碳酸氢钠 pH 10.1缓冲液、0.1 mol/L NaOH、碱性磷酸酶。
器材:恒温水浴锅、722分光光度计实验操作流程:1.对硝基苯酚标准曲线的制作取15支试管编号,0号一支,1-7号各二支,按下表操作:以对硝基苯酚的绝对量(μmol数)为横坐标,OD405nnm值为纵坐标,绘制标准曲线。
求出PNP的摩尔消光系数(s)值。
2.反应速度测定15支试管,1-5做两组平行测定管,01-05作为空白对照分别以01-05调零点,测定对应样品管ODq0s。
3.数据处理各管在722分光光度计测定波长405nm的OD值(OD405nm)。
从对硝基苯酚标准曲线上查出OD405nm。
相当于产物对硝基苯酚的μmol数。

碱性磷酸酶km值测定实验报告碱性磷酸酶(alkaline phosphatase)是一种重要的酶类物质,在生物体内发挥着关键的生物学功能。
为了更好地了解碱性磷酸酶的性质和功能,我们进行了碱性磷酸酶的KM值测定实验。
实验中,我们首先准备了一系列不同底物浓度的反应液,并添加了一定浓度的碱性磷酸酶。
然后,通过测定一定时间内底物浓度的变化,我们可以得到不同底物浓度下反应速率的数据。
在实验中,我们选择了两种常用的底物——对硝基苯磷酸钠(p-NPP)和酚酞磷酸钠(BTP)来进行测定。
p-NPP是一种无色底物,在碱性条件下可以被碱性磷酸酶催化水解生成对硝基苯酚,其产物可以通过测定吸光度来确定反应速率。
而BTP是一种红色底物,在碱性条件下可以被碱性磷酸酶催化水解生成酚酞,其产物可以通过测定吸光度来确定反应速率。
通过实验数据的处理和分析,我们得到了不同底物浓度下的反应速率和底物浓度的关系。
通过拟合实验数据,我们可以得到反应速率与底物浓度之间的动力学关系。
根据麦克斯韦-玛尔蒙方程,我们可以得到碱性磷酸酶的KM值。
KM值是一个重要的酶学参数,它反映了底物与酶结合的亲和力。
KM值越小,表示底物与酶结合的亲和力越强,底物浓度较低时就能够达到较高的反应速率。
而KM值越大,表示底物与酶结合的亲和力较弱,需要较高的底物浓度才能达到较高的反应速率。
通过实验测定,我们可以得到碱性磷酸酶的KM值,进而了解其底物结合特性。
这对于研究碱性磷酸酶的功能和调控机制具有重要意义。
同时,通过比较不同底物的KM值,我们还可以了解底物对于碱性磷酸酶的亲和力差异,进一步揭示酶底物特异性的原理。
除了测定KM值,我们还可以通过其他实验方法来研究碱性磷酸酶的功能和特性。
例如,可以通过测定酶的最适温度和最适pH值来了解酶的适应范围。
此外,还可以通过测定酶的抑制剂对酶活性的影响来研究酶的抑制机制。
这些实验方法的综合应用可以更全面地了解碱性磷酸酶的生物学功能。
综上所述,碱性磷酸酶KM值的测定是研究酶特性和功能的重要手段之一。

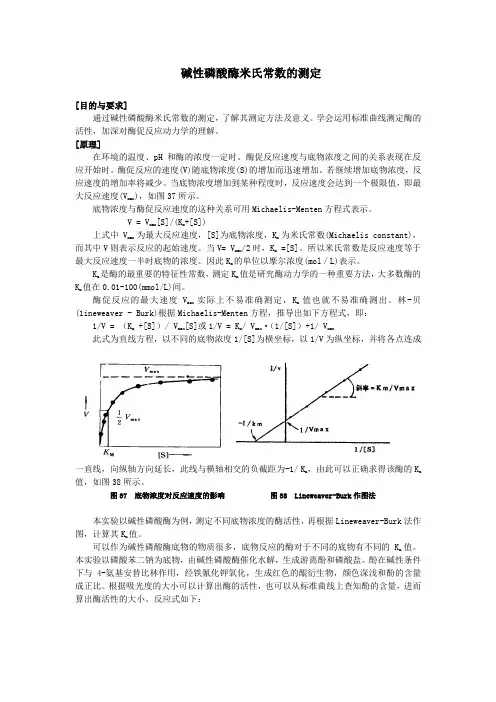
碱性磷酸酶米氏常数的测定[目的与要求]通过碱性磷酸酶米氏常数的测定,了解其测定方法及意义。
学会运用标准曲线测定酶的活性,加深对酶促反应动力学的理解。
[原理]在环境的温度、pH和酶的浓度一定时。
酶促反应速度与底物浓度之间的关系表现在反应开始时。
酶促反应的速度(V)随底物浓度(S)的增加而迅速增加。
若继续增加底物浓度,反应速度的增加率将减少。
当底物浓度增加到某种程度时,反应速度会达到一个极限值,即最大反应速度(V max),如图37所示。
底物浓度与酶促反应速度的这种关系可用Michaelis-Menten方程式表示。
V = V max[S]/(K m+[S])上式中V max为最大反应速度,[S]为底物浓度,K m为米氏常数(Michaelis constant),而其中V则表示反应的起始速度。
当V= V max/2时,K m =[S]。
所以米氏常数是反应速度等于最大反应速度一半时底物的浓度。
因此K m的单位以摩尔浓度(mol/L)表示。
K m是酶的最重要的特征性常数,测定K m值是研究酶动力学的一种重要方法,大多数酶的K m值在0.01-100(mmol/L)间。
酶促反应的最大速度V max实际上不易准确测定,K m值也就不易准确测出。
林-贝(1ineweaver - Burk)根据Michaelis-Menten方程,推导出如下方程式,即:1/V = (K m +[S])/ V max[S]或1/V = K m/ V max·(1/[S])+1/ V max此式为直线方程,以不同的底物浓度1/[S]为横坐标,以1/V为纵坐标,并将各点连成一直线,向纵轴方向延长,此线与横轴相交的负截距为-1/ K m,由此可以正确求得该酶的K m 值,如图38所示。
图37 底物浓度对反应速度的影响图38 Lineweaver-Burk作图法本实验以碱性磷酸酶为例,测定不同底物浓度的酶活性,再根据Lineweaver-Burk法作图,计算其K m值。


竭诚为您提供优质文档/双击可除碱性磷酸酶km值测定实验报告篇一:酶促反应动力学实验报告酶促反应动力学实验报告14301050154杨恩原实验目的:1.观察底物浓度对酶促反应速度的影响2.观察抑制剂对酶促反应速度的影响3.掌握用双倒数作图法测定碱性磷酸酶的Km值实验原理:一、底物浓度对酶促反应速度的影响在温度、ph及酶浓度恒定的条件下,底物浓度对酶的催化作用有很大的影响。
在一般情况下,当底物浓度很低时,酶促反应的速度(v)随底物浓度[s]的增加而迅速增加,但当底物浓度继续增加时,反应速度的增加率就比较小,当底物浓度增加到某种程度时反应速度达到一个极限值(即最大速度Vmax)。
底物浓度和反应速度的这种关系可用米氏方程式来表示(michaelis-menten方程)即:式中Vmax为最大反应速度,Km为米氏常数,[s]为底物浓度当v=Vmax/2时,则Km=[s],Km是酶的特征性常数,测定Km是研究酶的一种重要方法。
但是在一般情况下,根据实验结果绘制成的是直角双曲线,难以准确求得Km和Vmax。
若将米氏方程变形为双倒数方程(Lineweaver-burk方程),则此方程为直角方程,即:以1/V和1/[s]分别为横坐标和纵坐标。
将各点连线,在横轴截距为-1/Km,据此可算出Km值。
本实验以碱性磷酸酶为例,测定不同浓度底物时的酶活性,再根据1/v和1/[s]的倒数作图,计算出其Km值。
二、抑制剂对酶促反映的影响凡能降低酶的活性,甚至使酶完全丧失活性的物质,成为酶的抑制剂。
酶的特异性抑制剂大致上分为可逆性和不可逆性两类。
可逆性抑制又可分为竞争性抑制和非竞争性抑制等。
竞争性抑制剂的作用特点是使该酶的Km值增大,但对酶促反映的最大速度Vmax值无影响。
非竞争性抑制剂的作用特点是不影响[s]与酶的结合,故其Km值不变,然而却能降低其最大速度Vmax。
本实验选取na2hpo4作为碱性磷酸酶的抑制物,确定其抑制作用属于哪种类型。



碱性磷酸酶Km值的测定实验报告引言碱性磷酸酶(Alkaline Phosphatase, ALP)是一种常见的酶类,广泛存在于生物体内。
测定其底物浓度与酶反应速率之间的关系可以得到酶的Km值,Km值是酶对底物的亲和力的指标。
本实验旨在通过逐渐增加底物浓度,测定酶反应速率的变化,并通过绘制酶反应速率与底物浓度的曲线来确定碱性磷酸酶的Km值。
材料与方法材料•碱性磷酸酶溶液•5% Na2CO3溶液•磷酸盐缓冲液(pH 10.0)•对硝基酚磷酸盐(PNPP)底物溶液方法1.准备一系列不同浓度的PNPP底物溶液,如0.01 mM、0.02 mM、0.03 mM等。
确保每个浓度的底物溶液均经过严格配制和标定。
2.在试管中分别取一定体积的磷酸盐缓冲液(pH 10.0)、Na2CO3溶液、碱性磷酸酶溶液和不同浓度的PNPP底物溶液,使得试管中各组分的最终浓度符合实验设计的要求。
3.将试管放置在恒温水浴中,保持温度在37°C。
4.开始计时后,每隔一定时间(如30秒)取出一个试管,加入适量的5% Na2CO3溶液停止反应。
5.使用分光光度计测定反应液中产生的黄色对硝基酚的吸光度,记录每个试管的吸光度数值。
6.通过绘制吸光度与反应时间的曲线,确定酶反应速率的变化。
结果与讨论根据实验所得数据,我们可以绘制酶反应速率与底物浓度的曲线。
理论上,当底物浓度较低时,酶反应速率随着底物浓度的增加呈现线性增加的趋势。
而当底物浓度达到一定水平时,酶反应速率趋于饱和,不再随着底物浓度的增加而增加。
通过观察曲线的斜率,我们可以确定酶的Km值,即底物浓度达到一半时的反应速率。
在实际操作中,我们可以使用线性回归等方法对实验数据进行分析,从而确定酶的Km值。
Km值的确定对于研究酶的底物亲和力以及酶催化机制具有重要意义。
此外,该实验还可用于研究碱性磷酸酶在不同条件下的催化特性,如温度、pH值等的影响。
结论通过本实验的研究,我们成功测定了碱性磷酸酶的Km值,并绘制了酶反应速率与底物浓度的曲线。
碱性磷酸酶km实验报告碱性磷酸酶 (alkaline phosphatase) 是一种广泛存在于生物体中的酶类,它在生物体的代谢过程中发挥着重要的角色。
了解碱性磷酸酶在不同底物和反应条件下的运作特性对于深入理解生物化学过程至关重要。
在本篇实验报告中,我们将讨论碱性磷酸酶的酶动力学参数 - Km 值以及对 Km 值的影响因素。
实验一:测定不同底物对碱性磷酸酶的 Km 值首先,我们选取了五种底物:苹果酸、β-甘油磷酸、乙酸盐、5'-AMP和DNA。
我们对每种底物进行了酶反应,反应体系中包含了一定浓度的碱性磷酸酶以及各自底物。
通过测定碱性磷酸酶催化下底物的氢氧化物离子生成量的速率变化,我们可以得到不同浓度下的速率和底物浓度对数的关系曲线。
然后,我们采用双倒数法 (double reciprocal plot) 对数据进行处理,求得每种底物的 Km 值。
实验结果显示,不同底物对碱性磷酸酶的 Km 值有明显影响。
苹果酸对酶的作用最弱,需要较高浓度的底物才能够达到稳定的酶反应速率。
β-甘油磷酸和乙酸盐对酶的作用较为类似,需要较低浓度的底物即可达到稳态反应速率。
而5'-AMP和DNA则需要较高浓度的底物才能够达到稳态反应速率。
实验二:影响碱性磷酸酶 Km 值的因素在第二部分的实验中,我们研究了影响碱性磷酸酶 Km 值的两个主要因素:温度和 pH 值。
温度的影响:我们分别选取了四个温度条件:0°C、20°C、37°C和60°C下的酶反应体系,测定了在不同温度条件下底物浓度以及酶反应速率的变化。
结果显示,随着温度的升高,底物浓度较低时酶反应速率逐渐增加,直至达到某一最高点后开始下降。
这表明温度对碱性磷酸酶的催化效率有一定影响,其最佳反应温度在37°C左右。
pH 值的影响:我们选取了五个 pH 条件:pH 5、pH 7、pH 8、pH 9和pH 10下的酶反应体系,同样测定了底物浓度以及酶反应速率的变化。
酶动力学综合实验实验(一)——碱性磷酸酶Km值的测定【目的要求】1.了解底物浓度对酶促反应速度的影响2.了解米氏方程、Km值的物理意义及双倒数作图求Km值的方法。
【实验原理】1、碱性磷酸酶:碱性磷酸酶是广泛分布于人体各脏器器官中,其中以肝脏为最多。
其次为肾脏、骨骼、肠和胎盘等组织。
但它不是单一的酶,而是一组同功酶。
本实验用的碱性磷酸酶是从大肠杆菌中提取的。
2、米氏方程:Michaelis-Menten 在研究底物浓度与酶促反应速度的定量关系时,导出了酶促反应动力学的基本公式,即:(1)式中:v表示酶促反应速度,表示酶促反应最大速度,[S]表示底物浓度,表示米氏常数。
3、值的测定主要采用图解法,有以下四种:①双曲线作图法(图1-1,a)根据公式(1),以v对[s]作图,此时1/2时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。
这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。
实测一个近似值,因而1/2不精确。
此外由于v对[S]的关系呈双曲线,实验数据要求较多,且不易绘制。
②Lineweaver- Burk作图法双倒数作图法(图1-1,b)实际工作中,常将米氏方程(式(1))作数学变换,使之成为直线形式,测定要方便、精确得多。
其中之一即取(1)式的倒数,变换为Lineweaver- Burk方程式:(2)以对作图,即为y=ax+b形式。
此时斜率为,纵截距为。
把直线外推与横轴相交,其截距相交,其截距即为—。
③Hofstee作图法(略)把(2)式等号两边乘以,得:(3)以v对作图,这时斜率为,纵截距为,横截距为。
④Hanas作图法(略)把(2)式等号两边乘以[S],得:(4)以对[s]作图,这时斜率为,纵截距为。
(a)(b)本实验主要以双倒数法,即Lineweaver- Burk作图法来测定碱性磷酸酶Km值。
具体原理如下:本实验以碱性磷酸酶为例,用磷酸苯二钠为其作用物,碱性磷酸酶能分解磷酸苯二钠产生酚和磷酸,在适宜条件下(PH10.0,和60℃),准确反应13分钟。