第2课时质量守恒定律及应用
- 格式:pptx
- 大小:2.82 MB
- 文档页数:35

《质量守恒定律》教案设计一、教学目标:1. 让学生了解质量守恒定律的定义和意义。
2. 让学生掌握质量守恒定律的实验方法和步骤。
3. 培养学生运用质量守恒定律分析和解决问题的能力。
4. 引导学生树立科学的世界观,培养学生的创新精神和实践能力。
二、教学内容:1. 质量守恒定律的定义和意义。
2. 质量守恒定律的实验方法和步骤。
3. 质量守恒定律在化学反应中的应用。
4. 质量守恒定律在生活中的实例。
三、教学重点与难点:1. 教学重点:质量守恒定律的定义、实验方法和步骤,以及质量守恒定律在化学反应中的应用。
2. 教学难点:质量守恒定律的微观解释,以及如何运用质量守恒定律解决实际问题。
四、教学方法:1. 采用问题驱动法,引导学生探究质量守恒定律。
2. 运用实验教学法,让学生亲身体验质量守恒定律。
3. 采用案例分析法,让学生了解质量守恒定律在生活中的应用。
4. 运用讨论法,促进学生对质量守恒定律的理解和运用。
五、教学过程:1. 导入新课:通过讲解质量守恒定律的发现历程,引发学生兴趣,导入新课。
2. 讲解质量守恒定律:详细讲解质量守恒定律的定义、意义和实验方法。
3. 实验演示:进行质量守恒定律的实验,让学生亲身体验并理解质量守恒定律。
4. 案例分析:分析生活中常见的质量守恒现象,让学生体会质量守恒定律的应用。
5. 练习与讨论:布置相关练习题,让学生运用质量守恒定律解决问题,并进行讨论。
6. 总结与拓展:对本节课内容进行总结,引导学生进一步探究质量守恒定律的微观机制。
7. 课后作业:布置作业,巩固所学知识,培养学生的实践能力。
六、教学评价:1. 通过课堂提问、回答问题的情况,评价学生对质量守恒定律的理解程度。
2. 通过实验操作、观察实验现象,评价学生对质量守恒定律的实验方法和步骤的掌握情况。
3. 通过作业、练习题的完成情况,评价学生对质量守恒定律的应用能力。
4. 通过课堂讨论、小组合作的情况,评价学生的团队合作能力和创新精神。


质量守恒定律第2课时教案第2课时教案:质量守恒定律【教学目标】1.知识目标:学习质量守恒定律的概念和原理,了解质量守恒定律在实际生活中的应用;2.技能目标:学生能够运用质量守恒定律解决实际问题,培养学生的观察、分析和实验设计能力;3.情感目标:培养学生的实践能力和创新精神,通过实验探究培养学生的科学思维。
【教学重点】质量守恒定律的概念和原理【教学难点】运用质量守恒定律解决实际问题【教具准备】实验器材:天平、容器、水、砝码、纸张等;教学PPT【教学过程】一、导入(10分钟)1.引入问题:小明把一块蜡烛放在天平的左托盘上,并加上一块和蜡烛重量相等的铁块放在右托盘上,天平平衡。
小明点燃了蜡烛,问天平是否会失去平衡?为什么?2.引导学生讨论,得出结论:天平不会失去平衡。
原因是:燃烧蜡烛时,蜡烛物质发生变化,释放出的气体会与空气发生一系列物质变化,但整个物质系统的质量仍然保持不变。
二、知识讲解(20分钟)1.通过PPT展示质量守恒定律的概念和原理,引导学生理解质量守恒定律的意义。
2.通过实验展示质量守恒定律的实验现象和实验操作,说明质量守恒定律在实验中的应用。
三、小组讨论(15分钟)1.将学生分为小组,每个小组讨论一个质量守恒定律相关的实验问题。
2.要求学生自行设计实验步骤和记录实验数据,然后进行小组展示和讨论。
四、实验操作(30分钟)1.学生按照分组的实验设计进行实验操作。
2.教师巡视指导学生进行实验,解决实验中出现的问题。
五、展示和分析(20分钟)1.学生展示实验结果并分析数据。
2.教师从理论角度指导学生对实验结果进行分析和解释。
六、解答疑惑(15分钟)教师解答学生在实验过程中遇到的问题,引导学生思考并解答相关问题。
【巩固拓展】1.原子核能反应是质量守恒定律的实际应用之一,请就此进行讲解。
2.让学生设计一个能应用质量守恒定律解决实际问题的实验。
【课堂反思】通过本节课的学习,学生们对质量守恒定律有了初步的认识,并通过实验加深了对质量守恒定律的理解。



质量守恒定律第2课时(教学设计)2023-2024学年九年级化学上册同步备课系列(人教版)一、教学目标1.理解质量守恒定律的概念和基本原理;2.掌握质量守恒定律的应用方法;3.培养学生的实验操作和观察分析能力;4.提高学生的问题解决能力。
二、教学重点1.质量守恒定律的内容和应用方法;2.通过实验验证质量守恒定律。
三、教学难点1.如何灵活应用质量守恒定律解决实际问题。
四、教学准备1.教师准备:教案、实验器材、化学试剂;2.学生准备:教材、笔记本、实验记录本。
五、教学过程第一步:导入(5分钟)引入上节课所学的质量守恒定律的概念和基本原理,复习学生的基础知识。
第二步:实验操作(20分钟)1.分组进行实验,每组3-4人;2.实验材料包括:锌粉、硫磺粉、天平、试管、点火器;3.操作步骤:–步骤一:将锌粉和硫磺粉分别称取一定质量放入两个试管中;–步骤二:用点火器分别将两个试管中的物质点燃;–步骤三:观察试管中物质的变化和质量的变化;–步骤四:记录实验现象和实验数据。
第三步:实验讨论(15分钟)1.学生根据实验结果讨论试管中物质的变化和质量的变化;2.引导学生思考质量守恒定律在实验中的应用;3.指导学生总结实验结果和结论,并与质量守恒定律进行对比。
第四步:知识讲解(15分钟)1.通过比较实验结果和结论,介绍质量守恒定律的定义和基本原理;2.解释质量守恒定律在实验中的应用方法;3.引导学生理解质量守恒定律的重要性和普遍性。
第五步:练习与巩固(15分钟)1.布置练习题,让学生运用质量守恒定律解答问题;2.指导学生互相交流、讨论答案;3.针对性地解答学生的疑惑和困惑。
第六步:作业布置(5分钟)留下课后作业,要求学生进一步思考质量守恒定律在实际生活中的应用,并撰写一篇300字左右的小论文。
六、课堂总结本节课主要学习了质量守恒定律的概念、基本原理和应用方法。
通过实验操作、讨论和练习,提高了学生的实验操作能力和问题解决能力。

第二课时:质量守恒定律的解释及应用[学生讨论]你能用微粒的观点对质量守恒定律作出解释吗?课堂练习题:质量守恒定律的应用一、用微粒的观点解释质量守恒定律1、在化学变化前后,下列各项中肯定没有发生变化的是,肯定发生变化的是,可能发生变化的是。
①原子的数目②分子的数目③元素的种类④物质的总质量⑤物质种类⑥原子的种类⑦分子种类⑧原子的质量二、判断元素的存在2、2003年10月16日,“神舟五号”安全返航,标志着我国载人航天技术取得历史性突破。
火箭所用的燃料为偏二甲肼[(CH3)2N2H2],其主要反应为:(CH3)2N2H2+ N2O4→X+ CO2+ H2O,由此可知X中一定含有的元素是()A、碳B、氢C、氧D、氮三、解释生活现象,揭示伪科学3、成语点石成金本意为古代方士的一种法术,即能使石头变成黄金;现比喻能化腐朽为神奇。
有人说他能把石灰石变成黄金,请你用化学知识说明石灰石(主要成分是碳酸钙CaCO3)不能变成黄金(主要成分是金Au)的道理。
四、根据质量守恒定律的计算4、1.6g甲烷在氧气中燃烧后,生成4.4g二氧化碳和3.6g水,则参加反应的氧气的质量为。
5、15.8g高锰酸钾加热后剩余物的质量为14.2g,则生成氧气的质量为。
五、判断化学式6、在X+2O2CO2+2H2O的反应中,根据质量守恒定律可判断X的化学式为A.CH4B.C2H5OH C.C D.CO六、综合推理、判断反应类型7、在一密闭容器中有A、B、C、D四种物质,一定条件下使之反应,一段时间后,物质 A B C D反应前质量/g 90 10 8 2反应后质量/g 11 59.25 29.75 10则该密闭容器中发生的化学反应类型为反应(填“化合”或“分解”)。
[提高题]1、下列各项中,在化学反应前后肯定没有发生变化的是①分子的数目②元素的种类③原子的数目④原子的种类⑤物质的种类⑥物质的总质量A、①③④⑥B、①②③⑤C、②③④⑥D、②④⑤⑥2、把金属钠放入水中,钠的表面产生大量的气泡。

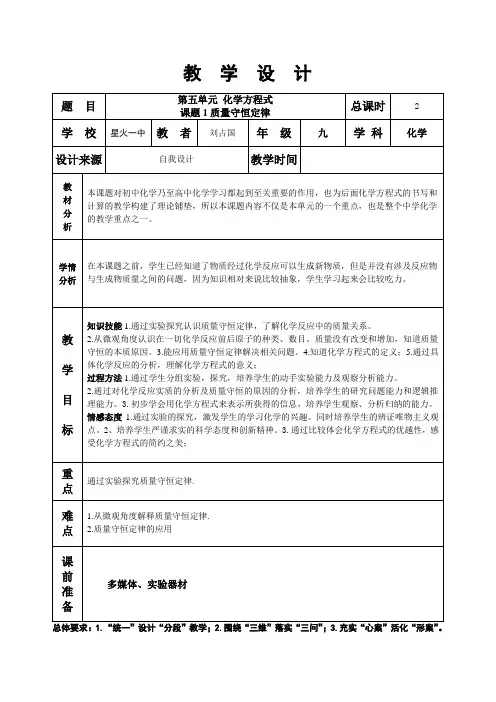
课题1 质量守恒定律一、教材分析本课的主要内容是质量守恒定律,是九年级化学第五单元课题1的内容。
本节课包括质量守恒定律的涵义、质重守恒的原因及其应用。
通过一系列探究活动,引导学生从量的方面去研究并得出化学反应的客观规律。
并从微观角度使学生充分理解化学反应中质量守恒的原因。
因此,质量守恒定律是初中化学的一个重要化学规律,是分析物质在化学反应中的质量关系的理论依据,是学生对化学反应的认识从“质”到“量”的过渡前提,也为化学方程式的书写和计算的教学做好理论准备,它的应用贯穿于整个中学化学。
所以本节内容在初中化学里有着承上启下的作用。
因此,本课内容不仅是本单元的一个重点,也是整个中学化学的教学重点之一。
二、学情分析初三刚开设化学课,学生情绪和心理都处于比较兴奋、好奇状态,学习化学的兴趣较高。
通过一阶段的学习,学生对分子和原子、元素、化学式,及对化学反应中物质发生了质的变化已经有了一定的认识,并初步掌握了一些简单的化学反应和简单的化学实验基本操作技能,而对化学反应的实质和化学探究学习的方法尚处于启蒙阶段。
针对这些情况,我采用小组实验探究的方法,鼓励学生动手、动脑,让每个学生参与到学习中来。
因此,在实验中观察,在观察中讨论,在讨论中形成共识,不仅使学生学到新的化学知识,也可使学生对化学知识的内在联系及化学反应的本质有更深的理解。
因为初中学生抽象思维能力较弱,特别是从分子原子角度去解释质量变化的能力还很有限,因此从微观角度解释质量守恒定律并能初步运用质量守恒定律确定为教学难点。
三、课时安排本课程共分为两课时:课时1 质量守恒定律课时2 化学方程式课时2 化学方程式一、教学目标1.知道化学方程式的定义,了解化学方程式表示的意义;2.会从质、量、数等方面读化学方程式,并能利用化学方程式求出化学反应中各物质的质量比。
二、教学重难点教学重点:化学方程式表示的意义。
教学难点:化学方程式表示的意义。
三、教学过程【提问】同学们还记得在化学反应中体现出来的“六不变、两改变、两可能变”吗?【展示】“六不变”指:反应前后物质的总质量、元素种类、元素总质量、原子种类、原子个数、原子质量一定不变;“两改变”指:反应前后物质种类、分子种类一定改变。


课题1 质量守恒定律(第2课时)一、教学目标知识技能:了解什么是化学方程式,知道化学方程式所提供的信息过程与方法:运用模型模拟分子和原子,表示化学变化的微观过程,帮助学生从微观的模拟理解化学方程式的含义。
情感态度与价值观通过对化学方程式的学习,培养学生由具体---抽象----具体的思维方法,并初步形成定量思维。
奠定学生从微观到宏观过程理解化学方程式所蕴涵的含义。
二、教学重点与难点教学重点:化学方程式的涵义和读法,理解化学方程式的“质”的含义和“量”的含义。
教学难点:化学方程式的微观涵义的理解三、教学过程教师活动学生活动设计意图一`复习提问1 化学式CO2中获得哪些信息2` 质量守恒定律的内容及其微观解释【动画展示】木炭燃烧的微观过程教师小结:化学变化中的“变”与“不变”二`导入新课用文字表达式表示“碳在氧气中燃烧生成二氧化碳”分析它的含义,引入化学方程式。
要求学生用分子和原子的符号表示以下的粒子,从而写出木炭燃烧的化学方程式,强调分子或原子都有质学生思考、讨论、交流观看动画并交流,各自动手书写木炭燃烧的文字表达式;并依据微观图解得出木炭燃烧时,每1个碳原子和1个氧分子在点燃的条件下反应生成了1个二氧化碳分子。
动手写文字表达式等回忆为讲述化学方程式的含义做准备。
通过具体化学反应的文字表达式的书写引出化学方程式让学生通过微观的化学变化的图解理解化学变化的微观实量,用各自的相对质量表示。
三`新授知识出示“C+O2=点燃CO2”化学方程式提出问题:1`化学方程式表示的读法2`化学方程式表示的含义讨论它表示的含义带着问题自己学习p93-94有关化学方程式的内容。
质,更直观而且更具有说服力。
通过化学式及相对分子(或原子)质量等知识的复习导出化学方程式的意义,自己阅读并学习化学方程式的含义,培养学生自主学习的能力。
教师小结:化学方程式的读法及含义并板书反馈练习1:H2+Cl2===2HCl 反馈练习2:学生讨论左边的化学方程式表示的含义“质”的含义,“量”的含义“微观粒子”的含义。
《质量守恒定律》教案教材分析:在以前知识的学习中,学生对化学反应中物质发生质的变化已经有了一定的理解,但对反应前后物质量的关系却不清楚,本节课就是带着这个问题共同研究适合于任何化学反应的定律--质量守恒定律。
一、教学目标1.知识与技能(1)通过实验探究理解质量守恒定律,理解常见化学反应中的质量关系。
(2)从微观角度理解在一切化学反应中,反应前后原子的种类和原子的数目没有增减。
(1)增加学生探究性实验,充分调动学生的积极性,通过操作、观察,组织讨论,总结规律。
(2)增强实验中的各个环节的教学,从而拓展学生的思路。
3.情感态度与价值观(1)培养学生定量研究和分析推理的水平及解决问题的水平。
(2)通过对化学反应的定量研究、推理,协助学生理解永恒运动和变化着的物质,既不能凭空产生也不能凭空消失的道理,实行辩证唯物主义观点的教育和自然科学方法的教育。
二、教学重点:质量守恒定律的含义及应用;化学方程式的意义。
三、教学难点:1.质量守恒定律的理解。
2.从微观角度理解在一切化学反应中,反应前后原子的种类和原子的数目没有增减。
四、课时安排 2课时五、教学思路:增加学生探索性实验,充分调动学生的积极性,边操作边观察、组织讨论、总结规律。
六、教学过程:介绍:在以前知识的学习中,我们对化学反应中物质质的变化已经有了一定理解,但对反应前后物质量的关系却不清楚,今天我们就共同来研究一个适合任何化学反应的定律:质量守恒定律。
为接受新知识做好思想准备。
物质发生化学变化时一定有新物质生成,那么参加反应的物质和生成的新物质的质量之间有什么关系呢?反应后各物质的质量总和是增加了、减少了还是不变呢?1、通过教师设疑,激发兴趣和求知欲2、预习演示实验演示课本实验观察实验现象,注意观察反应前后天平是否平衡,汇报后果。
是不是所有的反应都具备相同的实验结果呢?指导学生分组实验分组实验并观察结果:第一组:CuSO4和NaOH第二组:FeCl3和 NaOH第三组:NaCl和AgNO3人们经过很多年,选用不同的化学反应,做了无数次的实验发现得到的结论都是一样的,所以把它作为了一条定律叫质量守恒定律。