thbs1蛋白结构
- 格式:docx
- 大小:11.15 KB
- 文档页数:1

miR-19a调控血小板反应蛋白在结肠癌淋巴转移中的机制殷茜;王佩佩;彭睿;周航【摘要】目的探讨miR-19a调控血小板反应蛋白(THBS1)在结肠癌淋巴转移中的机制.方法采用实时定量聚合酶链反应(qRT-PCR)的方法检测不同结肠癌细胞株(LOVO、HT116、SW480、HT29)中的miR-19a的表达水平;蛋白免疫印迹法(Western blot)/免疫共沉淀(CO-IP)技术检测LOVO与HT29细胞中THBS1及血管内皮生长因子C/D(VEGF-C/D)蛋白结合及表达情况;Western blot法检测转染后细胞中THBS1、VEGF-C/D的表达情况;细胞划痕法检测转染后细胞的迁移能力.取shRNA、shRNA-NC转染后的LOVO细胞以及正常LOVO细胞分别接种于裸鼠皮下,建立裸鼠移植瘤模型观察成瘤情况,免疫组化法检测肿瘤组织中CD34的表达,Western blot法检测瘤体中THBS1、VEGF-C、VEGF-D蛋白的表达.结果细胞株LOVO和HT29的miR-19a的表达量分别为最高和最低;THBS1蛋白在HT29细胞中高表达,VEGF-C/D蛋白在LOVO细胞中高表达;LOVO和HT29细胞中THBS1和VEGF-C免疫共沉淀反应为阳性;转染miR-19a后,LOVO细胞的迁移能力显著下降,而HT29细胞迁移能力有显著上升.注射了miRNA抑制物组的裸鼠瘤块明显变小;瘤块组织中THBS1的蛋白表达显著上升,VEGF-C的蛋白表达显著下降,CD34的阳性表达降低.结论 miR-19a能够通过下调THBS1促进VEGF-C的表达,从而促进结肠癌淋巴结转移.【期刊名称】《华中科技大学学报(医学版)》【年(卷),期】2019(048)001【总页数】6页(P42-47)【关键词】miR-19a;THBS1;结肠癌淋巴转移;VEGF-C/D【作者】殷茜;王佩佩;彭睿;周航【作者单位】遵义医科大学附属医院腹部肿瘤科,遵义 563003;遵义医科大学附属医院腹部肿瘤科,遵义 563003;遵义医科大学附属医院腹部肿瘤科,遵义 563003;遵义医科大学附属医院腹部肿瘤科,遵义 563003【正文语种】中文【中图分类】R735.3结肠癌在全球恶性肿瘤的发病率为第3位,死亡率为第2位,严重威胁人类健康[1-2]。

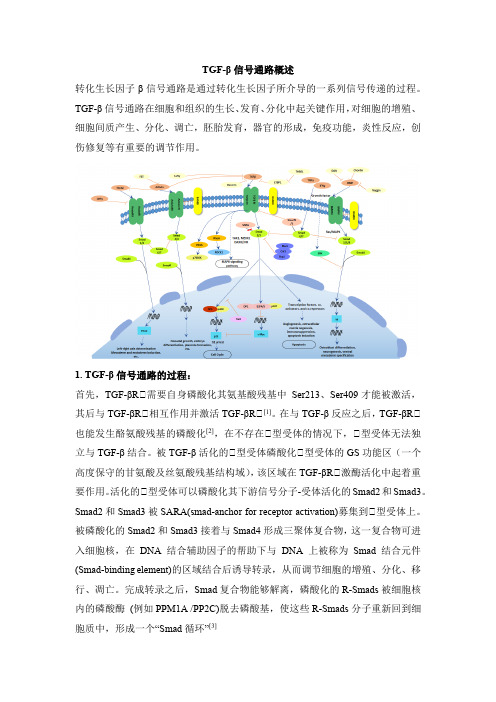
TGF-β信号通路概述转化生长因子β信号通路是通过转化生长因子所介导的一系列信号传递的过程。
TGF-β信号通路在细胞和组织的生长、发育、分化中起关键作用,对细胞的增殖、细胞间质产生、分化、调亡,胚胎发育,器官的形成,免疫功能,炎性反应,创伤修复等有重要的调节作用。
1. TGF-β信号通路的过程:首先,TGF-βRⅡ需要自身磷酸化其氨基酸残基中Ser213、Ser409才能被激活,其后与TGF-βRⅡ相互作用并激活TGF-βRⅡ[1]。
在与TGF-β反应之后,TGF-βRⅡ也能发生酪氨酸残基的磷酸化[2],在不存在Ⅱ型受体的情况下,Ⅱ型受体无法独立与TGF-β结合。
被TGF-β活化的Ⅱ型受体磷酸化Ⅱ型受体的GS功能区(一个高度保守的甘氨酸及丝氨酸残基结构域),该区域在TGF-βRⅡ激酶活化中起着重要作用。
活化的Ⅱ型受体可以磷酸化其下游信号分子-受体活化的Smad2和Smad3。
Smad2和Smad3被SARA(smad-anchor for receptor activation)募集到Ⅱ型受体上。
被磷酸化的Smad2和Smad3接着与Smad4形成三聚体复合物,这一复合物可进入细胞核,在DNA结合辅助因子的帮助下与DNA上被称为Smad结合元件(Smad-binding element)的区域结合后诱导转录,从而调节细胞的增殖、分化、移行、凋亡。
完成转录之后,Smad复合物能够解离,磷酸化的R-Smads被细胞核内的磷酸酶(例如PPM1A /PP2C)脱去磷酸基,使这些R-Smads分子重新回到细胞质中,形成一个“Smad循环”[3]2.TGF-β1/Smads信号通路的影响因子:在生物体中,TGF-β信号通路受多种因素控制,如微环境条件[4] [5]、激素[6]、细胞因子和生长因子[7]、microRNAs(MiRNAs) [8]、长的非编码RNA[9]、磷酸化和去磷酸化激酶[3],泛素连接酶和去泛素酶[10]以及其他因子。

卵母细胞及其胚胎发育潜能相关的生物标记物邵丽;崔毓桂【摘要】卵母细胞发育潜能是在卵泡发育过程中逐步获得的,卵丘细胞(CCs)与卵母细胞紧密接触,卵泡液(FF)为卵母细胞提供良好的微环境.因此,CCs功能及FF成分组成可以反映卵母细胞的发育潜能.CCs为卵母细胞提供代谢所需的营养物质如丙酮酸、丙氨酸、胆固醇等,并在卵母细胞的成熟、排卵、受精过程中发挥重要的作用.FF作为卵巢体壁细胞与血浆之间的媒介,其内的代谢相关分子、激素类分子、活性氧分子及一些细胞因子与卵母细胞的成熟及发育潜能密切相关.综述与卵母细胞及其胚胎发育潜能相关的生物标记物,主要是CCs、FF中的相关因子,两者结合为胚胎学家选择最佳的卵子提供参考.【期刊名称】《国际生殖健康/计划生育杂志》【年(卷),期】2014(033)005【总页数】6页(P379-383,395)【关键词】卵母细胞;生物学标记;卵丘细胞;卵泡液;胚胎发育【作者】邵丽;崔毓桂【作者单位】210029 南京医科大学第一附属医院生殖医学中心;210029 南京医科大学第一附属医院生殖医学中心【正文语种】中文欧洲人类生殖医学和胚胎学会(ESHRE)第13次调查统计显示,欧洲2009年体外受精(IVF)临床妊娠率为32.9%[1]。
为了提高临床妊娠率,临床上常在一个周期植入多个胚胎,使多胎妊娠率高,后者则可引起流产、难产、产后出血、胎儿生长受限等并发症增多。
单胚胎移植(singleembryo transfer,SET)可以有效地降低多胎妊娠率,SET达到满意临床妊娠率的关键是获得优质胚胎。
目前评价卵母细胞和胚胎质量主要依赖于相应的形态学参数,如卵子直径、卵丘扩张程度、胚叶个数及胚胎碎片率等,然而这些形态学检查方法缺乏客观性及准确性[2]。
因此,缺乏准确、敏感的评价卵子及其胚胎质量的方法,是SET尚未被临床广泛接受的原因之一。
因而,植入前通过无创性手段预测卵母细胞的发育潜能以获得优质卵子及其高质量的胚胎,是胚胎学家面临的挑战。

百泰派克生物科技
外泌体蛋白质谱分析
外泌体蛋白质谱分析,是指利用质谱技术对外泌体蛋白进行分析。
外泌体蛋白质谱分析可以帮助检测鉴定外泌体以及研究外泌体的生理功能等。
百泰派克生物科技提供基于质谱技术的外泌体蛋白分析服务。
外泌体蛋白,可以指外泌体膜上的蛋白质,也可以指外泌体中包含的蛋白质。
检测和鉴定外泌体的膜蛋白,可以帮助我们检测和鉴定外泌体;检测和鉴定外泌体中含有的蛋白质,可以帮助我们进一步了解和研究外泌体的生理功能。
目前,通过研究外泌体中的蛋白质,人们发现外泌体中的蛋白质不仅参与细胞生理状态的调控,还与多种疾病的发生和发展有关。
例如,肝细胞癌细胞外泌体中的SMADS蛋白通过增强癌细胞粘附促进肿瘤转移,口腔鳞状细胞癌细胞外泌体中THBS1蛋白通过改变巨噬细胞促进肿瘤转移。
此外,与直接在体液中检测到的蛋白质相比,外泌体蛋白更适合作为生物标志物用于疾病的检测诊断中。
外泌体蛋白质谱分析,是指利用质谱技术对外泌体蛋白进行分析。
质谱分析技术有着高灵敏度,高精准度等特点,能够快速准确地分析外泌体蛋白,适用于外泌体蛋白组学的研究。
与其他蛋白质分析相同,外泌体蛋白质谱分析包括分析蛋白的分子量、相对含量、氨基酸序列等信息。
![Thbs1及其抑制剂在制备抗肿瘤药物中的应用[发明专利]](https://img.taocdn.com/s1/m/12fc5e469a6648d7c1c708a1284ac850ad02041f.png)
专利名称:Thbs1及其抑制剂在制备抗肿瘤药物中的应用专利类型:发明专利
发明人:何伟,夏元铮,肖青青,李晓彤
申请号:CN202110356071.5
申请日:20210401
公开号:CN113041350B
公开日:
20220617
专利内容由知识产权出版社提供
摘要:本发明涉及生物医药领域,公开了Thbs1及其抑制剂在制备抗肿瘤药物中的应用。
本发明提供了一种以Thbs1为靶点,激活机体免疫发挥抗肿瘤作用的治疗策略。
实验证明,通过抑制Thbs1在肿瘤部位的表达,可以促进机体免疫,有效抑制肿瘤生长。
通过联合使用Thbs1抑制剂和免疫检查点抑制剂,可以抑制Thbs1蛋白的分泌,从而强化化学免疫治疗,有效抑制肿瘤生长。
因此,本发明公开Thbs1抑制剂可以作为抗肿瘤药物,且可以发挥激活肿瘤免疫治疗的作用,具有重要的应用价值。
申请人:中国药科大学
地址:210009 江苏省南京市鼓楼区童家巷24号
国籍:CN
代理机构:南京经纬专利商标代理有限公司
代理人:唐循文
更多信息请下载全文后查看。

T H B S 1在肿瘤中作用的研究进展包楠丁,贾永峰(内蒙古医科大学基础医学院,内蒙古呼和浩特010110)D O I :10.11748/b j m y .i s s n .1006-1703.2021.04.036收稿日期:2021G03G20;修回日期:2021G03G29基金项目:内蒙古自治区自然科学基金项目(编号:2019M S 08118)作者简介:包楠丁,女,硕士.通讯作者:贾永峰.摘要:近年来,在多种类型的肿瘤中均发现了血小板凝血酶蛋白G1(t h r o m b o s p o n d i n G1,T H B S 1)的异常表达,其是近年来肿瘤领域研究的热门靶点基因.T H B S 1作为一种多功能蛋白,在肿瘤中的作用较为复杂,对肿瘤的影响机制尚不完全明确,功能及调控机制有待进一步深入研究.现对T H B S 1在肿瘤中作用的研究进展作一综述,以期为肿瘤的临床研究提供参考.关键词:血小板凝血酶蛋白G1;㊀调控机制;㊀肿瘤中图分类号:R 446.6㊀㊀文献标识码:AT h eR e s e a r c hP r o gr e s s o fT H B S 1i nT u m o r s B A O N a n d i n g ,J I A Y o n g f e n g(S c h o o l o fB a s i cM e d i c i n e ,I n n e rM o n g o l i aM e d i c a lU n i v e r s i t y,H o h h o t 010110,C h i n a )A b s t r a c t :I n r e c e n t y e a r s ,a na b n o r m a l e x p r e s s i o no f p l a t e l e t h r o m b o s p o n d i n G1(t h r o m b o s po n d i n G1,T H B S 1)h a s b e e no b s e r v e d i nm a n y t y p e s o f t u m o r s ,w h i c h i s b e c o m i n g ah o t t a r g e t ge n e i n t h ef i e l d o f t u m o r r e s e a r c h .A s am u l t i Gf u n c t i o n a l p r o t e i n ,t h e r o l eo fT H B S 1i nt u m o r s i s v e r y c o m pl e xa n d t h em e c h a n i s mo f i t s e f f e c t o n t u m o r i s n o t c o m p l e t e l y c l e a r .T h e f u n c t i o na n d r e g u l a t o r y me c h a n i s m of t h i sg e n e n e e d t ob e f u r th e r s t u di e d .T h i s p a p e r r e v i e w s t h e r e s e a r c h p r o g r e s s o fT H B S 1i n t u m o r s ,s oa s t o p r o v i d ea r e f e r e n c e f o r t h e c l i n i c a l r e s e a r c h .K e y w o r d s :T h r o m b o s p o n d i n G1;㊀R e g u l a t o r y me c h a n i s m ;㊀T u m o r ㊀㊀血小板凝血酶蛋白家族(t h r o m b o s p o n d i n ,T H B S )又称血小板反应蛋白,是最初在血小板中发现的一种多结构和多功能的钙结合性糖蛋白,可以由许多细胞合成和分泌,包括血小板㊁白细胞与内皮细胞等.T H B S 家族由五个编码蛋白质的基因组成:T H B S 1至T H B S 5,分为2个亚型:A 亚型为三聚体蛋白,包括T H B S 1和T H B S 2,含有转录调控序列(t r a n s c r i p t i o n r e g u l a t i n g s e q u e n c e ,T S R s )序列;B 亚型为五聚体蛋白,包括T H B S 3㊁T H B S 4㊁T H B S 5,不含T S R s 序列[1].在人体中,T H B S 1和T H B S 2常表达于多个器官,而T H B S 3至T H B S 5主要表达于软骨和骨组织中.T H B S 家族是组织发生和重塑期间调节细胞表型和细胞外结构的同源蛋白家族,对胚胎发育㊁血管生成㊁创伤修复和肿瘤的发生发展起重要的调控作用.T H B S 1是该家族第一个被发现并确定的成员.目前,国内外已经开展大量关于T H B S 1的相关研究,但T H B S 1在肿瘤中的作用较为复杂,其对肿瘤的影响机制尚不完全明确.㊀㊀1㊀T H B S 1的结构及生物学功能㊀㊀T H B S 1是于1971年被发现的第一个T H B S 成员,被认为是由血小板在凝血酶的刺激下而产生的糖蛋白,因此而得名,但后续的研究证明T H B S 1可由多种细胞合成分泌.T H B S 1是一种相对分子质量约为450k D a 的三聚体同源复合物,由186个氨基酸残基组成,包括N 端球状结构域㊁原胶原同源区㊁备解区重复序列㊁表皮生长因子样重复序列㊁钙离子结合域及C 端球状结构域等.T H B S 1可与纤维蛋白原㊁纤维连接蛋白㊁层粘连蛋白㊁V 型胶原㊁整合素㊁C D 47及C D 36等结合,介导细胞与细胞㊁细胞与基质之间的相互作用[2];T H B S 1已被证明在血小板聚集㊁血管生成和肿瘤发生中发挥作用[3];T H B S 1是首次报道的内源性抗血管生成因子,可抑制血管307标记免疫分析与临床㊀2021年4月第28卷第4期生成和肿瘤发生[4G5],但最近的研究[6G7]发现T H B S1也有促进血管新生的作用,T H B S1还可通过抑制性调节血小板内c AM P信号来促进血小板活化,促进血栓形成,促进止血.T H B S1中的T S R s序列通过与内皮细胞膜蛋白C D36㊁C D47相互作用抑制内皮细胞迁移并促进细胞凋亡,进而抑制血管生成[8]. T H B S1可与粘多糖结合,在肿瘤的发展中可能支持肿瘤细胞与内皮细胞的黏附和侵袭.T H B S1与转化生长因子(t r a n s f o r m i n gg r o w t h f a c t o r b e t a,T G FGβ)相互作用,在某些肿瘤中可以诱发凋亡,也可以通过刺激血管生成而促进肿瘤生长和转移[9G11]. T H B S1还参与创伤修复,组织再生[12G13].由于T H B S1是具有一系列不同的结构域和功能域的复杂的大分子糖蛋白,每个特定的结构域和功能域与不同种类的细胞因子结合而发挥不同的生物学效应,T H B S1对肿瘤的影响机制尚不完全明确,仍需进一步研究证实.㊀㊀2㊀T H B S1在肿瘤中作用的研究进展㊀㊀2.1㊀T H B S1与黑色素瘤㊀㊀黑色素瘤是一类高转移㊁高复发及预后差的恶性肿瘤[14],可通过淋巴和血行转移扩散至肝脏㊁肺㊁大脑等其他器官.上皮G间质转化(e p i t h e l i a lGm e s e n c h y m a l t r a n s i t i o n,E MT)是黑色素瘤转移的一个决定性因素.B O R S O T T I等[15]发现,原发性黑色素瘤和转移瘤中T H B S1的表达高于普通痣和发育异常痣,亚细胞定位主要为细胞质,且间质样细胞中T H B S1m R N A表达水平较高,而上皮样细胞几乎不表达.T S U C H I D A等[16]的研究发现,沉默T H B S1可降低间质样黑色素瘤细胞的侵袭性.分子水平上,T H B S1被认为是T G FGβ1在体内和体外的主要生理激活因子[10,17],T G FGβ1在E MT进展中具有关键作用,T G FGβ1以一种生物学上不活跃的潜伏形式分泌,三聚体形式的T H B S1在接触T G FGβ1后可诱导上皮样表型.G A O等[19]的研究显示, T H B S1和T G FGβ1均可由黑色素瘤细胞表达和分泌,T H B S1与T G FGβ1的表达呈正相关,且呈时间依赖性表达.以上研究提示,T H B S1的表达与黑色素瘤细胞的T G FGβ1信号有关,T H B S1可能是通过激活潜伏的T G FGβ1来促进E MT,进而促进黑色素瘤的进展.㊀㊀另外,N A T H等[20]研究发现,在人类黑色素瘤中,C D47m R N A与T H B S1m R N A的表达均上调, T H B S1作为C D47的配体,两者结合后可抑制N K 细胞增殖,从而抑制了N K细胞抗肿瘤活性,进而促进了黑色素瘤的进展.㊀㊀2.2㊀T H B S1与胃癌㊀㊀成纤维细胞生长因子7(f i b r o b l a s t g r o w t h f a c t o r 7,F G F7)是一种间质特异性肝素结合生长因子,它结合成纤维细胞生长因子受体2(f i b r o b l a s t g r o w t h f a c t o r r e c e p t o r2,F G F R2)调节许多细胞和生理过程,包括增殖㊁侵袭㊁迁移和血管生成[21].先前已有研究表明F G F7/F G F R2信号可能与胃癌的进展有关[22].H U A N G等[23]的研究发现,F G F R2主要表达于细胞质,而T H B S1主要表达于细胞质和细胞外基质.与癌旁正常组织相比,肿瘤组织中F G F R2和T H B S1的表达显著升高,且两者的表达量呈正相关.随后,周潇等[24]的研究显示,F G F R2可上调胃癌细胞系T H B S1m R N A和蛋白质的表达.敲除T H B S1后,降低了胃癌细胞的侵袭和迁移能力.这提示,F G F7/ F G F R2可能通过T H B S1介导的途径来促进胃癌细胞的侵袭和迁移.随后,L I N等[25]的研究发现,使用P I3K抑制剂(L Y294002)和m T O R抑制剂(R A D00)对胃癌细胞T H B S1蛋白和m R N A的表达有明显的抑制作用,提示F G F7/F G F R2介导的T H B S1上调可能通过P I3K/A k t/m T O R途径发生,进而促进胃癌细胞的侵袭和迁移,进一步揭示了T H B S1对胃癌潜在的调控模式.另外,有研究[26]报道在非癌组织中T H B S1的表达与胃癌发生之间存在相关性,特别是在多种癌前疾病㊁黏膜萎缩和幽门螺杆菌感染的状态下,T H B S1信号通路被激活.因此T H B S1有望成为肿瘤生物标志物,用于提高胃癌检测率.㊀㊀2.3㊀T H B S1与口腔鳞状细胞癌㊀㊀X I A O等[27]的研究发现,与癌前和正常上皮细胞相比,口腔鳞状细胞癌细胞中T H B S1的m R N A表达和分泌水平更高.P A L等[28]的研究发现,T H B S1特异性表达于细胞外基质中,并且在平滑肌肌动蛋白(s m o o t hm u s c l e a c t i n,S M A)阳性肿瘤间质细胞中上调,S M A是已知的癌相关成纤维细胞的标志物.细胞实验结果显示,T H B S1显著促进了人口腔鳞状细胞癌H S C3和H O1N1细胞的迁移,T H B S1可下调两种细胞系EG钙黏附蛋白(EGc a d h e r i n,EGc a)的表达,而上调波形蛋白(v i m e n t i n)的表达.EGc a是一类介导细胞间粘连作用的糖蛋白,EGc a表达下调或缺失,细胞间粘附力降低,造成细胞分散外向浸润性生长,而获得转移的条件.㊀㊀P A L等[28]进一步研究发现T H B S1上调两种细胞系MM P3㊁MM P11和MM P13的表达,并上调成纤维S T2细胞MM P3㊁MM P9㊁MM P11和MM P13的表407L a b e l e d I mm u n o a s s a y s&C l i n M e d,A p r.2021,V o l.28,N o.4达.基质金属蛋白酶(m a t r i x m e t a l l o p r o t e i n a s e, MM P)是一类能够降解细胞外基质和基底膜的蛋白酶,MM P s的失调能破坏肿瘤侵袭的组织屏障,通过促进基质的降解从而促进肿瘤细胞突破基底膜和细胞外基质,侵袭至周围组织和转移至远处,或间接通过释放与基质相关的生长因子来促进肿瘤的生长㊁侵袭和转移.利用R G D肽(整合素受体功能抑制剂)可明显抑制T H B S1对H O1N1细胞MM P11和MM P13的刺激作用.T G FGβ1可促进H S C3㊁H O1N1细胞T H B S1和S M A的表达,且呈剂量依赖性增加. T H B S1已被证实是整合素I T G A3㊁I T G A V和I T G B1的配体,并且I T G A3和I T G B1在口腔鳞状细胞癌H S C3和H O1N1细胞中均有表达.以上研究提示,在口腔鳞状细胞癌细胞和成纤维S T2细胞中T H B S1介导T G FGβ1活化,可能是通过整合素信号刺激MM P s表达,既作用于口腔鳞状细胞癌的细胞,也作用于基质细胞,进而促进组织重构和肿瘤的侵袭生长.另有研究[29]发现,下调c i r c R N AG0004674通过m i RG377G3p/T H B S1轴延缓口腔鳞状细胞癌的进展.这提示T H B S1参与调控口腔鳞状细胞癌的机制并非单一,而是由多种通路共同调控而产生的效应.㊀㊀2.4㊀T H B S1与结直肠癌㊀㊀L I U等[30]的研究发现,与非癌组织相比,结直肠癌组织中T H B S1表达明显上调,T H B S1表达上调与结直肠癌肝转移和预后不良显著相关.与口腔鳞状细胞癌一样,L I U等的体外细胞实验结果显示,敲除T H B S1基因上调了人结直肠癌S W480和L O V O细胞中EGc a的表达水平,而抑制了V i m e n t i n的表达,敲除T H B S1基因后两种细胞迁移和侵袭能力比对照组细胞明显减弱.此外, G E P I A数据库[31]的共表达分析结果显示,T H B S1与上皮细胞标志物C l a u d i nG1呈负相关,与NGc a d h e r i n㊁V i m e n t i n㊁S n a i l1与T w i s t1等E MT标志物表达水平呈正相关.这些结果可以提示,T H B S1可能通过促进结直肠癌细胞的E MT,进而促进结直肠癌肝转移.另有研究[32G35]报道,某些小分子核糖核酸能够调节T H B S1,例如m i RG182㊁m i RG205㊁m i RG407㊁m i RG19a和m i RG7等可结合T H B S13 U T R区的相应位点,下调T H B S1的表达.一方面直接削弱了T H B S1抗血管生成的作用,另一方面减少了T H B S1与血管内皮生长因子(v a s c u l a r e n d o t h e l i a l g r o w t h f a c t o r,V E G F)的结合反应,游离V E G F相对增加,增强了V E G F的淋巴管和血管生成作用,进而促进了结直肠肿瘤的生长,并促进癌细胞通过新生淋巴管和血管的转移.㊀㊀2.5㊀T H B S1与乳腺癌㊀㊀乳腺癌是影响女性健康的最主要的恶性肿瘤之一,位居女性恶性肿瘤发病率及死亡率首位,转移是导致癌症致死的主要原因[36].局灶性粘附(f o c a l a d h e s i o n,F A)是细胞迁移的重要决定因素,粘着斑激酶(f o c a l a d h e s i o nk i n a s e,F A K)作为F A的关键调节因子,在促进肿瘤细胞侵袭方面起着重要作用[37G38].Y A P蛋白(y e sa s s o c i a t e d p r o t e i n,Y A P)是H i p p o途径的主要效应者[39],Y A P的过表达被证明是上皮G间质转化和肌动蛋白动力学的触发因素,Y A P与T E A D家族成员(T E A D)相互作用是肿瘤细胞侵袭性和局灶性粘附形成的关键[40].L I U 等[41]的研究发现,T H B S1与Y A P的表达在乳腺癌标本中呈正相关,Y A P可以上调T H B S1的表达.此外,先前已有报道提到T H B S1是F A KGT y r397磷酸化的主要激活剂[42],并被认为是H i p p o信号的直接转录靶点.以上研究提示,在乳腺癌中可能存在Y A PGT E A DGT H B S1这一途径,调控F A KGT y r397磷酸化,并诱导乳腺癌局灶性粘附,促进乳腺癌细胞的浸润及侵袭,进而促进乳腺癌的发展进程.另外,C E N等[43]的研究提示,T H B S1可能通过下调细胞间连接蛋白的表达和破坏内皮细胞的完整性,进而促进了乳腺癌细胞的跨内皮迁移.免疫组织化学法证实T H B S1在乳腺癌组织中的表达较正常乳腺组织异常增高[44].T H B S1在正常乳腺组织或乳腺良性病变中低表达甚至不表达,在原位癌中仅表达于癌周基质细胞,而在浸润性小叶癌和浸润性导管癌的癌细胞胞质及间质中高表达,可以认为随着肿瘤侵袭性增加,早期T H B S1呈现抑制血管生成的作用,而当肿瘤细胞长时间暴露于大量T H B S1的环境中,T H B S1激活T G FGβ1促进肿瘤E MT进展,并且促进肿瘤细胞分泌V E G F进而促进血管生成,覆盖了T H B S1本身抑制肿瘤血管生成的作用,进而促进乳腺癌细胞的侵袭过程.㊀㊀2.6㊀T H B S1与其他肿瘤㊀㊀T H B S1在高级别胶质瘤中的表达高于低级别胶质瘤,并且与预后不良有关,表达受T G FGβ1通过S MA D3转录激活诱导[45];在前列腺癌中T H B S1低表达,果蝇z e s t e基因增强子的人类同源物2(e n h a n c e r o f z e s t e h o m o l o g2,E Z H2)高表达,E Z H2由内皮细胞中的V E G F诱导,从而促进血管生成,促进前列腺癌生长及转移,T H B S1可能是前列腺癌细胞中E Z H2抑制的靶点,进而抑制前列腺癌的进507标记免疫分析与临床㊀2021年4月第28卷第4期展[46];β肾上腺素能信号通过组蛋白去乙酰化酶2(H D A C2)介导的T H B S1抑制,进而促进肿瘤血管生成和前列腺癌细胞异种移植瘤的生长[47];T H B S1的表达降低与膀胱癌患者的高恶性潜能和低生存率有关,T H B S1的某些结构域和衍生肽可能对膀胱癌组织具有促血管生成作用,而另一些结构域可能具有抗癌作用[48];T H B S1通过F A K依赖途径促进骨肉瘤细胞迁移㊁侵袭和肺转移[49];在胶质母细胞瘤中T H B S1是一项预后的生物标志物,并且与胶质母细胞瘤的免疫微环境相关[50].㊀㊀3㊀小结㊀㊀综上所述,T H B S1与多种肿瘤的发生发展密切相关,且在不同肿瘤中所发挥的生物学功能也不同,目前其对肿瘤的调控机制也不是十分清楚,甚至存在较多争议.基于T H B S1在肿瘤进展中的重要调控作用,其在肿瘤预测及靶向治疗方面可能具有非常广阔的应用前景,应对其进行更加深入的研究探索.参考文献[1]刁长英,王晓慧,谢艺林,等.上调T H B S1蛋白的表达对肺腺癌H1975细胞迁移能力的影响[J].郑州大学学报(医学版),2019,54(3):382G385.[2]B I S S I N G E RR O S I,P E T K O V AGK I R O V A P O L I N A,M Y K H A I L O V A O L G A,e t a l.T h r o m b o s p o n d i nG1/C D47s i g n a l i n g m o d u l a t e s t r a n s m e m b r a n e c a t i o nc o n d u c t a n c e,s u r v i v a l,a n dd e f o r m a b i l i t y o fh u m a nr e d b l o o dc e l l s[J].C e l lC o mm u n S i g n a l,2020,18(1):155.[3]P A T S O U R A S M,T S I K I E,K A R A G I A N N I P,e t a l.T h e r o l e o ft h r o m b o s p o n d i nG1i nt h e p a t h o g e n e s i so fa n t i p h o s p h o l i p i d s y n d r o m e[J].J A u t o i mm u n,2020,115:102527.[4]J U Y A HA N,T A N G Z H I M I N,D A I X I A O C H A N,e t a l.P r o t e c t i o na g a i n s tl i g h tGi n d u c e dr e t i n a ld e g e n e r a t i o n v i a d u a l a n t iGi n f l a mm a t o r y a n d a n t iGa n g i o g e n i c f u n c t i o n s o f t h r o m b o s p o n d i nG1[J].B rJP h a r m a c o l,2020,d o i:10.1111/ b p h.15303.[5]C H I B A T A K U T O,C E R Q U E I R A DÉB O R A M,L IY A O,e t a l.m i RG17~92e n d o t h e l i a lGd e r i v e d p r o m o t e sa n g i o g e n e s i st o p r o t e c t a g a i n s t r e n a l i s c h e m i aGr e p e r f u s i o ni n j u r y[J].JA m S o c N e p h r o l,2021,32:553G562.[6]A B U R I M AA H M E D,B E R G E R M A R T I N,S P U R G E O NB E N J A M I N EJ,e ta l.T h r o m b o s p o n d i nG1p r o m o t e sh a e m o s t a s i st h r o u g h m o d u l a t i o no fc AM P s i g n a l l i n g i n b l o o d p l a t e l e t s[J].B l o o d,2020,d o i:10.1182/b l o o d.2020005382.[7]J E A N N E A L B I N,S A R A Z I N T H O M A S,C H A R LÉM A G A L I E, e ta l.T o w a r d s t h et h e r a p e u t i c u s e o ft h r o m b o s p o n d i n1/C D47t a r g e t i n g T A X2p e p t i d e a s a na n t i t h r o m b o t i c a g e n t[J].A r t e r i o s c l e r T h r o m bV a s c B i o l,2021,41:e1Ge17.[8]C O U R A G E O T M A R I EGP I E R R E,D U C A L A U R E N T,M A R T I N YL A U R E N T,e ta l.T h r o m b o s p o n d i nG1r e c e p t o rC D47o v e r e x p r e s s i o nc o n t r i b u t e st oPGg l y c o p r o t e i nGm ed i a te d m u l t i d r u g r e s i s t a n c ea g a i n s td o x o r u b i c i n i nt h y r o i dc a r c i n o m aF T CG133ce l l s[J].F r o n t O n c o l,2020,10:551228.[9]HU A N G T,S U N L,Y U A N X,e t a l.T h r o m b o s p o n d i nG1i s a m u l t i f a c e t e d p l a y e r i n t u m o r p r o g r e s s i o n[J].O n c o t a r g e t,2017,8(48):84546G84558.[10]J I E M I M I,MA H E,Z H O U LI,e t a l.O r e o c h r o m i sn i l o t i c u s R e g u l a t i o no f F e m a l eF o l l i c u l o g e n e s i sb y T s p1a i n N i l eT i l a p i a (O r e o c h r o m i s n i l o t i c u s)[J].I n t JM o l S c i,2020,21(16):5893.[11]A N A S T A S I C Y R I L,R O U S S E L L E P A T R I C I A,T A L A N T I K I T E M A Y A,e t a l.B M PG1d i s r u p t sc e l l a d h e s i o na n de n h a n c e sT G FGβa c t i v a t i o n t h r o u g h c l e a v a g e o f t h e m a t r i c e l l u l a r p r o t e i n t h r o m b o s p o n d i nG1[J].S c i S i g n a l,2020,13(639):e a b a3880.[12]J I A N G D,G U O B,L I N F,e ta l.E f f e c to f T H B S1o nt h eB i o l o g i c a l F u n c t i o n o fH y p e r t r o p h i c S c a r F i b r o b l a s t s[J].B i o m e dR e s I n t,2020,2020:8605407.[13]L A IY UGH U N G,L E EP OGY E N,L UC H IGY U,e t a l.T h r o m b o s p o n d i n1Gi n d u c e de x o s o m a l p r o t e i n sa t t e n u a t eh y p o x i aGi n d u c e d p a r a p t o s i si n c o r n e a l e p i t h e l i a l c e l l s a n d p r o m o t e w o u n d h e a l i n g[J].F A S E B J,2021,35:e21200.[14]F I S C H E R G M,V A S H I S H T G O P A LY N,M C Q U A D EJL, e ta l.M e t a b o l i cs t r a t e g i e s o f m e l a n o m ac e l l s:M e c h a n i s m s, i n t e r a c t i o n sw i t h t h e t u m o rm i c r o e n v i r o n m e n t,a n d t h e r a p e u t i c i m p l i c a t i o n s[J].P i g m e n t C e l l M e l a n o m a R e s,2018,31(1):11G30.[15]B O R S O T T I P,G H I L A R D I C,O S T A N O P,e t a l.T h r o m b o s p o n d i nG1i s p a r to fa S l u gGi n d e p e n d e n t m o t i l i t y a n d m e t a s t a t i c p r o g r a m i n c u t a n e o u sm e l a n o m a,i na s s o c i a t i o nw i t hV E G F RG1a n dF G FG2[J].P i g m e n t C e l lM e l a n o m aR e s,2015,28(1):73G81.[16]T S U C H I D A R,O S AWA T,WA N G F,e t a l.B M P4/ T h r o m b o s p o n d i nG1l o o p p a r a c r i n i c a l l y i n h iGb i t s t u m o r a n g i o g e n e s i sa n ds u p p r e s s e st h e g r o w t h o fs o l i dt u m o r s[J].O n c o g e n e,2014,33(29):3803G3811.[17]MU R P H YGU L L R I C HJE,S U T O M J.T h r o m b o s p o n d i nG1r e g u l a t i o no f l a t e n tT G FGβa c t i v a t i o n:A t h e r a p e u t i ct a r g e tf o r f i b r o t i c d i s e a s e[J].M a t r i xB i o l,2018,68G69:28G43.[18]A K A S A K AE I J I R O,K L E I S E RS V E N J A,S E N G L EG E R H A R D, e t a l.D i v e r s i t y o fm e c h a n i s m s u n d e r l y i n g l a t e n tT G FGβA c t i v a t i o n i n r e c e s s i v ed y s t r o p h i ce p i d e r m o l y s i sb u l l o s a[J].JI n v e s tD e r m a t o l,2020,d o i:10.1016/j.j i d.2020.10.024.[19]G A OJ,A K S O Y B A,D O G R U S O Z U,e t a l.I n t e g r a t i v e a n a l y s i s o f c o m p l e xc a n c e r g e n o m i c sa n dc l i n i c a l p r o f i l e su s i n g t h e c B i oP o r t a l[J].S c i S i g n a l,2013,6(269):p l1.[20]N A T H PR,P A LGN A T H D,MA N D A L A,e ta l.N a t u r a l k i l l e rc e l lr e c r u i t m e n ta n d a c t i v a t i o n a r er e g u l a t e d b y C D47e x p r e s s i o n i n t h e t u m o rm i c r o e n v i r o n m e n t[J].C a n c e r I mm u n o lR e s,2019,7(9):1547G1561.[21]C H E N W,WU L,HU Y,e ta l.M i c r o R N AG107a m e l i o r a t e s d a m a g e i na c e l lm o d e l o fA l z h e i m e r s d i s e a s e b y m e d i a t i n g t h eF G F7/F G F R2/P I3K/A k t p a t h w a y[J].J M o l N e u r o s c i,2020,70(10):1589G1597.607L a b e l e d I mm u n o a s s a y s&C l i n M e d,A p r.2021,V o l.28,N o.4[22]Z HA N GJ,WO N GCC,L E U N G K T,e t a l.F G F18GF G F R2s i g n a l i n g t r i g g e r s t h e a c t i v a t i o no f cGJ u nGY A P1a x i s t o p r o m o t e c a r c i n o g e n e s i si n a s u b g r o u p o f g a s t r i c c a n c e r p a t i e n t s a n d i n d i c a t e s t r a n s l a t i o n a l p o t e n t i a l[J].O n c o g e n e,2020,39(43):6647G6663.[23]HU A N G T,WA N G L,L I U D,e ta l.F G F7/F G F R2s i g n a l p r o m o t e si n v a s i o n a n d m i g r a t i o n i n h u m a n g a s t r i c c a n c e r t h r o u g hu p r e g u l a t i o n o ft h r o m b o s p o n d i nG1[J].I n tJ O n c o l,2017,50(5):1501G1512.[24]周潇,黄婷婷,邱红.F G F R2㊁T H B S1和T H B S4在胃癌组织中的表达及临床意义[J].中国癌症防治杂志,2017,9(5):368G372.[25]L I N XD,C H E N S Q,Q I Y L,e ta l.O v e r e x p r e s s i o n o f t h r o m b o s p o n d i nG1i ns t r o m a lm y o f i b r o b l a s t s i sa s s o c i a t e dw i t h t u m o r g r o w t ha n dn o d a lm e t a s t a s i s i n g a s t r i cc a r c i n o m a[J].J S u r g O n c o l,2012,106(1):94G100.[26]K A S H I H A R A H,S H I MA D A M,Y O S H I K AWA K,e ta l.C o r r e l a t i o n b e t w e e n t h r o m b o s p o n d i nG1e x p r e s s i o n i n n o nGc a n c e r t i s s u ea n d g a s t r i cc a r c i n o g e n e s i s[J].A n t i c a n c e r R e s,2017,37(7):3547G3552.[27]X I A O M,Z H A N G J,C H E N W,e t a l.M1Gl i k e t u m o rGa s s o c i a t e d m a c r o p h a g e s a c t i v a t e d b y e x o s o m eGt r a n s f e r r e dT H B S1p r o m o t e m a l i g n a n t m i g r a t i o ni n o r a ls q u a m o u s c e l l c a r c i n o m a[J].J E x p C l i nC a n c e rR e s,2018,37(1):143.[28]P A LSK,N G U Y E N C T,MO R I T A K I,e ta l.T H B S1i s i n d u c e db y T G F B1i n t h e c a n c e r s t r o m aa n d p r o m o t e s i n v a s i o n o f o r a l s q u a m o u s c e l l c a r c i n o m a[J].O r a lP a t h o lM e d,2016,45(10):730G739.[29]Z HA N G X U E,C H E N GJ U N Y I N G,L I U S I R U I,e t a l.D o w nGr e g u l a t i n g c i r c u l a rR N A_0004674d e l a y s t h e p r o g r e s s i o no f o r a l s q u a m o u sc e l lc a r c i n o m at h r o u g h m i c r o R N AG377G3p/T H B S1a x i s[J].L i f eS c i,2021,119236.[30]L I U X,X U D,L I U Z,e ta l.T H B S1f a c i l i t a t e sc o l o r e c t a l l i v e r m e t a s t a s i s t h r o u g h e n h a n c i n g e p i t h e l i a lGm e s e n c h y m a l t r a n s i t i o n[J].JC l i nT r a n s lO n c o l,2020,22(10):1730G1740.[31]T A N GZ,L IC,K A N G B,e ta l.G E P I A:A w e bs e r v e rf o r c a n c e ra n d n o r m a l g e n e e x p r e s s i o n p r o f i l i n g a n di n t e r a c t i v e a n a l y s e s[J].N u c l e i cA c i d sR e s,2017,45(1):98G102.[32]殷茜,王佩佩,彭睿,等.m i RG19a调控血小板反应蛋白在结肠癌淋巴转移中的机制[J].华中科技大学学报(医学版),2019,48(1):42G47.[33]F A N X,L I U M,T A N G H,e t a l.M i c r o R N AG7e x e r t s a n t i a n g i o g e n i c e f f e c t o n c o l o r e c t a l c a n c e r v i aE R Ks i g n a l i n g[J].J S u r g R e s,2019,240:48G59.[34]J I A N G D O N GW E N,G U OB I N G Y U,L I NF E N G,e t a l.m i RG205i n h i b i t s t h e d e v e l o p m e n t o f h y p e r t r o p h i c s c a r sb y t a r g e t i n g T H B S1[J].A g i n g(A l b a n y N Y),2020,12:22046G22058.[35]G A J E T O NJ A S M I N E,K R U K O V E T S I R E N E,Y E N D A M U R I R E V A N T H,e ta l.m i RG467r e g u l a t e si n f l a mm a t i o na n db l o o d i n s u l i n a n d g l u c o s e[J].J C e l lM o lM e d,2021,25(5):2549G2562.[36]S H E NJ,C A O B,WA N G Y,e ta l.H i p p oc o m p o n e n t Y A Pp r o m o t e s f o c a l a d h e s i o n a n d t u m o u r a g g r e s s i v e n e s s v i a t r a n s c r i p t i o n a l l y a c t i v a t i n g T H B S1/F A K s i g n a l l i n g i n b r e a s t c a n c e r[J].J E x p C l i nC a n c e rR e s,2018,7(1):175.[37]B U R R I D G EK.F o c a la d h e s i o n s:a p e r s o n a l p e r s p e c t i v eo na h a l f c e n t u r y o f p r o g r e s s[J].F E B SJ,2017,284(20):3355G3361.[38]Z H O UJ,Y IQ,T A N G L,e ta l.T h er o l e so fn u c l e a rf o c a l a d h e s i o nk i n a s e(F A K)o n C a n c e r:af o c u s e dr e v i e w[J].JE x pC l i nC a n c e rR e s,2019;38(1):250.[39]P F L E G E RC M.T h eh i p p o p a t h w a y:am a s t e r r e g u l a t o r y n e t w o r k i m p o r t a n t i nd e v e l o p m e n t a n dd y s r e g u l a t e d i nd i s e a s e[J].C u r rT o pD e vB i o l,2017,123:181G228.[40]Z A N C O N A T OF,C O R D E N O N S I M,P I C C O L O S,e t a l.Y A P/T A Za t t h e r o o t s o f c a n c e r[J].C a n c e rC e l l,2016,29(6):783G803.[41]L I U Y,H EK,HU Y,e t a l.Y A Pm o d u l a t e sT G FGβ1Gi n d u c e d s i m u l t a n e o u sa p o p t o s i sa n d E MTt h r o u g hu p r e g u l a t i o no ft h eE G Fr e c e p t o r[J].S c i R e p,2017,7:45523.[42]HU C,W E NJ,G O N G L,e t a l.T h r o m b o s p o n d i nG1p r o m o t e s c e l l m i g r a t i o n,i n v a s i o n a n d l u n g m e t a s t a s i s o f o s t e o s a r c o m a t h r o u g hF A Kd e p e n d e n t p a t h w a y[J].O n c o t a r g e t,2017,8(44):75881G75892.[43]C E NJ,F E N G L,K E H,e ta l.E x o s o m a l t h r o m b o s p o n d i nG1d i s r u p t st h ei n t e g r i t y o fe n d o t h e l i a li n t e r c e l l u l a r j u n c t i o n st o f a c i l i t a t eb r e a s t c a n c e r c e l lm e t a s t a s i s[J].C a n c e r s(B a s e l),2019,11(12):1946.[44]廖雪洪,郑雄伟,朱伟峰.乳腺癌中T H B SG1表达及与E M T的相关性[J].现代肿瘤医学,2016,24(20):3219G3225.[45]D A U B O N T,LÉO N C,C L A R K E K,e ta l.D e c i p h e r i n g t h e c o m p l e x r o l e o f t h r o m b o s p o n d i nG1i n g l i o b l a s t o m ad e v e l o p m e n t[J].N a t C o m m u n,2019,10(1):1146.[46]Z H A N G Y,Z H E N G D,Z HO UT,e t a l.A n d r o g e n d e p r i v a t i o n p r o m o t e s n e u r o e n d o c r i n e d i f f e r e n t i a t i o n a n d a n g i o g e n e s i s t h r o u g hC R E BGE Z H2GT S P1p a t h w a y i n p r o s t a t ec a n c e r s[J].N a tC o mm u n,2018,9(1):4080.[47]HU L S U R K A R M,L IZ,Z H A N G Y,e ta l.B e t aGa d r e n e r g i c s i g n a l i n g p r o m o t e s t u m o r a n g i o g e n e s i s a n d p r o s t a t e c a n c e r p r o g r e s s i o n t h r o u g h H D A C2Gm e d i a t e d s u p p r e s s i o n o f t h r o m b o s p o n d i nG1[J].O n c o g e n e,2017,36(11):1525G1536.[48]N A K A M U R A Y,M I Y A T A Y,T A K E H A R A K,e ta l.T h e p a t h o l o g i c a l s i g n i f i c a n c e a n d p r o g n o s t i c r o l e s o f t h r o m b o s p o n d i nG1, a n dG2,a n d4N1KGp e p t i d ei n b l a d d e rc a n c e r[J].A n t i c a n c e r R e s,2019,39(5):2317G2324.[49]HU C,W E NJ,G O N GL,e t a l.T h r o m b o s p o n d i nG1p r o m o t e s c e l lm i g r a t i o n,i n v a s i o na n dl u n g m e t a s t a s i so fo s t e o s a r c o m a t h r o u g hF A Kd e p e n d e n t p a t h w a y[J].O n c o t a r g e t,2017,8(44):75881G75892.[50]Q I C H U N X I A O,L E I L E I,H UJ I N Q U,e t a l.T h r o m b o s p o n d i nG1i sa p r o g n o s t i cb i o m a r k e ra n di sc o r r e l a t e d w i t ht u m o ri m m u n em i c r o e n v i r o n m e n t i n g l i o b l a s t o m a[J].O n c o l L e t t,2021,21(1):22.707标记免疫分析与临床㊀2021年4月第28卷第4期。

结组织中WWOX、THBS1、FOXO1的表达变化及石慧1,1,吴宜1,周淑如打毛栋梁21江苏大学附属澳洋医院,江苏张家港215600;2上海交通大学医学院附属瑞金医院北院摘要:目的探讨结肠癌组织中氧化还原酶的WW域抗原(WWOX)、血小板凝血酶蛋白1(THBS1)、叉头框蛋白Ol(FOXOl)的表达变化及临床意义。
方法选择结肠癌患者76例,术中取癌组织及其常组织(距肿瘤边缘>5cm)o用荧光定量PCR法检测组织中WWOX、THBS1、FOXO1mRNA表达,用Western blotting法检测组织中WWOX、THBS1、FOXO1蛋白表达,分析癌组织中WWOX、THBS1、FOXO1mRNA表达与患者临床病理特征的关系,用Pearson线性相关分析癌组织中WWOX、THBS1及FOXO1mRNA表达的相关性。
结果与癌旁正常组织比较,癌组织中WWOX、FOXO1mRNA及蛋白相对表达量均低(P均<0.05),THBS1mRNA及蛋白相对表达量均高(P均<0.05)。
癌组织中WWOX、THBS1、FOXO1mRNA表达与肿瘤分期有关(P均<0.05),而与患者性别、年龄、肿瘤直径、组织分化、淋巴结转移无关(P均>0.05)。
癌组织中WWOX与THBS1mRNA表达呈关(r=-0.612,P=0.000)与FOXO1mRNA表达呈正相关(r=0.582,P=0.000);癌组织中THBS1与FOXO1mRNA表达无相关性(r=0.213,P=0.452)o结论结肠癌组织中WWOX、FOXO1低表达,而THBS1高表达;三者表达变化均与肿瘤分关。
关键词:结肠癌;氧化还原酶的WW域抗原;血小板凝血酶蛋白1;叉头框蛋白O1doi:10.3969/j.issn.1002-266X.2020.28.005中图分类号:R735.3文献标志码:A文章编号:1002-266X(2020)284017-04Expression changes and significance of WWOX,THBS1,and FOXO1in colon cancer tissuesSHI Hui,ZHOU Yun,WU Yi,ZHOU Shuru,MAO Dongliang1Aoyang Hospital Affiliated to Jiangsu University,Zhangjiagang215600,ChinaAbstract:Objective To investigate the changes and clinical significance of WW domain containing oxidoreductase (WWOX),thrombospondin1(THBS1),and forkhead box protein O1(FOXO1)expression in the colon cancer tissues.Methods Seventy-six patients with colon cancer were selected.The cancer tissues and its adjacent normal tissues(more than5cm away from the tumor edge)were taken during the operation.The WWOX,THBS1and FOXO1mRNA expression levels were detected by fluorescence quantitative PCR,and the WWOX,THBS1,and FOXO1protein expression levels were detected by Western blotting.The relationship between the WWOX,THBS1,FOXO1mRNA expression and clinicopatho-logical characteristics was analyzed.The correlation of WWOX,THBS1and FOXO1mRNA in the cancer tissues was analyzed by Pearson linear correlation.Results Compared with the adjacent normal tissues,the WWOX and FOXO1mRNA and protein relative expression levels were lower in the cancer tissues(all P<0.05),while the THBS1mRNA and protein relative expression levels were higher(all P<0.05).The WWOX,THBS1and FOXO1mRNA expression in the cancer tissue was related to tumor stage(all P<0.05),but not related to gender,age,tumor size,tumor differentiation,or lymph node metastasis(all P>0.05).WWOX in the cancer tissues was negatively correlated with THBS1mRNA expression(r=-0.612,P=0.000),and was positively correlated with FOXO1mRNA expression(r=0.582,P=0.000).There was no correlation between THBS1and FOXO1mRNA expression(r=0.213,P=0.452).Conclusion The expression of WWOX and FOXO1in the colon cancer tissues decreases,while the expression of THBS1increases,and all of them are related to tumor stage.Key words:colon carcinoma;WW domain containing oxidoreductase;thrombospondin1;forkhead box protein O1基金项目:江苏大学临床医学科技发展基金项目(JLY20180150)。

HSKVmiRNAs的生物作用摘要: 小RNA(microRNA,miRNA)是一类长度约为21~25个核苷酸的真核生物小分子单链RNA,通过与靶mRNA特异性的碱基配对引起靶mRNA降解或者抑制其翻译从而对基因进行转录后的表达调控。
Kaposis肉瘤相关疱疹病毒(KSHV)是引起人类Kaposis肉瘤的一种相关病毒。
近年来,科学研究发现KSHV miRNA通过其生物作用及其靶点与KSHV 的致瘤作用密切相关。
对于KSHV miRNA的深入了解,有助于我们对KSHV的致瘤机制愈发清楚。
关键字:小RNA(miRNA),Kaposis肉瘤相关疱疹病毒(KSHV),靶基因前言近年来,人类发现了许多种不同类别的RNA分子,在真核生物中新发现的一种非编码RNA分子——miRNA尤其引起科学家的注意。
人类基因组编码了超过1000个miRNAs,并且数量还在不断增加中[1]。
生物信息学数据表明[2]miRNA几乎参与体内基本的所有信号传导途径,包括许多重要肿瘤相关基因的表达。
研究发现miRNA的表达失调与肿瘤发生密切相关。
卡波西肉瘤(Kaposis sarcoma)是一类由KSHV(HHV-8)引起的一类恶性肿瘤。
对于其致病机制,一直是科学家研究的对象。
2005年Cai[3]等人发现10条KSHV miRNAs茎环并且这些茎环都定位在141kbKSHV基因组的一短片段之内,后一年,他们又发现所有的12条KSHVmiRNAs。
现将结合中外的研究成果,对KSHVmiRNA的致病作用进行综述,为对其如何进行基因治疗开启新思路。
1.miRNA的发现,生物合成及其普遍作用1.1miRNA的发现1993年,Lee[4],Feinbaum和Ambros等人发现在线虫体内存在一种RNA(lin-4),是一种不编码蛋白但可以生成一对小的RNA转录本,每一个转录本能在翻译水平通过抑制一种核蛋白lin-14的表达而调节了线虫的幼虫发育进程。

2022蛋白质组学在甲状腺癌诊断中的应用(全文)目前人们已经从DNA和RNA水平对甲状腺肿瘤开展了广泛研究,但基因的功能最终需要通过相应的蛋白质发挥作用。
蛋白质作为基因的表达产物,生理活动的执行者,有必要从蛋白质整体水平揭示甲状腺癌的发生发展,阐述其癌变本质。
甲状腺癌是内分泌系统最常见的恶性肿瘤,发病率日益增加,现已成为全球第八位最常见癌症。
甲状腺癌按组织学类型分为乳头状甲状腺癌(papillary thyroid carcinoma,PTC)、滤泡型甲状腺癌(follicular thyroid cancer,FTC)、甲状腺髓样癌(medullary thyroid cancer,MTC)和未分化癌(anaplastic thyroid cancer,ATC),其中PTC和FTC又称为分化型甲状腺癌(differentiated thyroid cancer,DTC)。
目前,全球范围内广泛使用的术前诊断甲状腺癌方法为甲状腺超声引导下细针穿刺细胞学(fine needle aspiration cytology,FNAC)检查,但仍有20%~30%甲状腺结节无法得到准确诊断。
因此许多患者最终选择了外科诊断性手术,但术后病理大多数是良性的。
不必要的手术通常造成患者需要终身的甲状腺素替代治疗和承受相应的手术后并发症,也在一定程度上造成了医疗资源的浪费。
近十余年来,分子检测越来越多地被运用到甲状腺癌的诊断中。
从BRAF V600E单基因到基因 panel、多基因分类器虽然诊断的敏感性有所提高,但阳性预测值和特异性较低。
目前人们已经从DNA和RNA水平对甲状腺肿瘤开展了广泛研究,但基因的功能最终需要通过相应的蛋白质发挥作用。
蛋白质作为基因的表达产物,生理活动的执行者,有必要从蛋白质整体水平揭示甲状腺癌的发生发展,阐述其癌变本质。
(一)蛋白质组学在PTC诊断中的应用PTC是最常见的甲状腺癌,国内外学者许多发表的甲状腺蛋白质组学研究着眼于将PTC蛋白质谱与健康或良性甲状腺组织进行比较,从而筛选出特异性分子标志物。
TGF-β信号通路概述转化生长因子β信号通路是通过转化生长因子所介导的一系列信号传递的过程。
TGF-β信号通路在细胞和组织的生长、发育、分化中起关键作用,对细胞的增殖、细胞间质产生、分化、调亡,胚胎发育,器官的形成,免疫功能,炎性反应,创伤修复等有重要的调节作用。
1. TGF-β信号通路的过程:首先,TGF-βRⅡ需要自身磷酸化其氨基酸残基中Ser213、Ser409才能被激活,其后与TGF-βRⅡ相互作用并激活TGF-βRⅡ[1]。
在与TGF-β反应之后,TGF-βRⅡ也能发生酪氨酸残基的磷酸化[2],在不存在Ⅱ型受体的情况下,Ⅱ型受体无法独立与TGF-β结合。
被TGF-β活化的Ⅱ型受体磷酸化Ⅱ型受体的GS功能区(一个高度保守的甘氨酸及丝氨酸残基结构域),该区域在TGF-βRⅡ激酶活化中起着重要作用。
活化的Ⅱ型受体可以磷酸化其下游信号分子-受体活化的Smad2和Smad3。
Smad2和Smad3被SARA(smad-anchor for receptor activation)募集到Ⅱ型受体上。
被磷酸化的Smad2和Smad3接着与Smad4形成三聚体复合物,这一复合物可进入细胞核,在DNA结合辅助因子的帮助下与DNA上被称为Smad结合元件(Smad-binding element)的区域结合后诱导转录,从而调节细胞的增殖、分化、移行、凋亡。
完成转录之后,Smad复合物能够解离,磷酸化的R-Smads被细胞核内的磷酸酶(例如PPM1A /PP2C)脱去磷酸基,使这些R-Smads分子重新回到细胞质中,形成一个“Smad循环”[3]2.TGF-β1/Smads信号通路的影响因子:在生物体中,TGF-β信号通路受多种因素控制,如微环境条件[4] [5]、激素[6]、细胞因子和生长因子[7]、microRNAs(MiRNAs) [8]、长的非编码RNA[9]、磷酸化和去磷酸化激酶[3],泛素连接酶和去泛素酶[10]以及其他因子。

胶原蛋白Ⅳ在肿瘤领域的研究进展发表时间:2019-01-20T20:16:03.860Z 来源:《心理医生》2019年第1期作者:刘永华[导读] 胶原蛋白属于一种生物高分子,为动物结缔组织的重要成分,占到人体内总蛋白质的25%-30%。
(天津市滨海新区中医医院天津 300451)【摘要】胶原蛋白属于一种生物高分子,为动物结缔组织的重要成分,占到人体内总蛋白质的25%-30%。
人体内生成的肿瘤组织,不同阶段下可见不同的胶原蛋白IV(IV-C)组成与分布,这也是临床上肿瘤诊断与分期的关键内容。
恶性肿瘤中的癌细胞会不断侵袭和突破BMs,从而产生附近、远端的癌细胞转移,而IV-C与癌细胞的侵袭、转移息息相关。
本次研究则对IV-C在肿瘤领域的研究进展进行综述。
【关键词】肿瘤;胶原蛋白IV;研究进展【中图分类号】R730.2 【文献标识码】A 【文章编号】1007-8231(2019)01-0005-02 【Abstract】Collagen is a kind of biopolymer, which is an important component of animal connective tissue and accounts for 25-30% of the total protein in human body. The composition and distribution of collagen IV (IV-C) in human tumor tissues are different at different stages, which is also the key content in clinical diagnosis and staging of tumors. Cancer cells in malignant tumors will continue to invade and break through BMs, resulting in nearby, distal metastasis of cancer cells, and IV-C is closely related to the invasion and metastasis of cancer cells. In this study, the progress of IV-C in the field of cancer is reviewed.【Key words】 Tumor; Collagen IV; Research Progress胶原蛋白IV(IV-C)是胶原蛋白的一种,人体内细胞基底膜(BMs)不可缺少的成分,其结构为异源三聚体螺旋链,是以六型α-肽链构成。

利用GEO数据库寻找结直肠癌肝转移生物标志物金鑫亮;王一休;薛清凯;薛伟杰;宫之奇;牛兆建;朱呈瞻【摘要】目的利用生物信息学分析方法寻找结直肠癌(CRC)肝转移生物标志物。
方法在公共基因芯片数据库(GEO)下载CRC数据,获得2个数据集共261个样本,其中包含167个非转移样本和94个转移样本,对两批样本混合后随机拆分成训练集195个样本(75%)和验证集66个样本(25%)。
对两批数据芯片中提供的原始数据进行Robust Multi-chip Average (RMA)归一化处理,然后利用R-package Combat去除批次效应。
筛选在转移组和非转移组 t 检验 P <0.05的基因(426个基因)进行CRC转移相关标志物筛选。
结果利用Lasso回归算法对426个基因进行重要性排序,按重要性排序筛选出了CD163L1、FAM210B、LGR5、LRRC16A、PIK3R3、PLEKHA6、PROSER2、RBBP9、SEMA6D、STOM、THBS1、ZNF544前12个基因作为潜在的CRC转移相关标志物。
结论通过生物信息学对基因芯片数据的分析,筛选出了CRC肝转移的相关生物标志物,可为后续研究提供参考。
【期刊名称】《精准医学杂志》【年(卷),期】2018(033)006【总页数】5页(P546-549)【关键词】计算生物学;数据库,遗传学;结直肠肿瘤;肿瘤转移;肝肿瘤;生物标记,肿瘤【作者】金鑫亮;王一休;薛清凯;薛伟杰;宫之奇;牛兆建;朱呈瞻【作者单位】[1]青岛大学附属医院胃肠外科,山东青岛266003;[1]青岛大学附属医院胃肠外科,山东青岛266003;[1]青岛大学附属医院胃肠外科,山东青岛266003;[1]青岛大学附属医院胃肠外科,山东青岛266003;[1]青岛大学附属医院胃肠外科,山东青岛266003;[1]青岛大学附属医院胃肠外科,山东青岛266003;[1]青岛大学附属医院胃肠外科,山东青岛266003;【正文语种】中文【中图分类】R735.3结直肠癌(CRC)作为最常见的消化道肿瘤之一,近年来在发展中国家的发病率快速增高[1]。

牦牛的进化历程和遗传学研究牦牛是一种原产于青藏高原的典型高原动物,被誉为“青藏高原的真实大王”,其进化历程和遗传学研究引发了广泛的关注。
牦牛的进化历程和遗传学研究为我们揭示了高原动物适应极端环境的进化机制和基因调控网络,对于理解物种适应性进化和保护濒危物种具有重要意义。
牦牛的进化历程可以追溯到3000万年前的中新世,其祖先可能是从低海拔区域迁移到高原地区。
在长期的进化过程中,牦牛逐渐适应了高原的极端环境,形成了独特的生理和形态特征。
例如,牦牛具有较大的心肺功能、高氧携带能力以及耐寒耐饥等特点,这些特征使其能够在缺氧、低温和食物稀缺的高原环境中存活和繁衍。
牦牛的进化过程中,基因在适应性进化中起着重要的作用。
遗传学研究表明,牦牛的基因组中存在一些与高原适应有关的关键基因。
例如,EGLN1基因与血红蛋白水平和心肺功能有关,THBS1基因与血液凝固功能和氧携带能力有关,这些基因的突变或表达水平的变化与牦牛适应高原环境的生理特征密切相关。
在牦牛的遗传学研究中,基因测序技术发挥着重要的作用。
通过对牦牛的基因组进行测序和比较分析,研究人员发现了一些与高原适应相关的基因突变。
例如,HIF2A基因在牦牛中发生了多种功能突变,这些突变使得牦牛在低氧环境下能够更有效地产生红细胞和血红蛋白,提高氧携带能力。
此外,研究还发现牦牛中与红细胞形态和数量相关的基因MYH7B和EPAS1等的突变,这些突变有助于提高牦牛高原适应性。
除了基因突变,表观遗传学也在牦牛的进化过程中发挥了重要的作用。
表观遗传学是指基因表达水平的调控,而不涉及DNA序列的改变。
通过比较牦牛和低海拔物种的调控基因的表达水平,研究人员发现了一些表观遗传修饰因子的差异。
例如,HIF1A和HIF2A等调控因子在牦牛中的表达水平较高,这与牦牛在低氧环境中产生抗缺氧反应的能力密切相关。
牦牛的进化历程和遗传学研究为我们提供了深入理解高原动物适应机制的窗口。
这些研究不仅有助于揭示生物适应性进化的基本规律,还为研究其他高海拔物种的适应性进化提供了借鉴和启示。

doi:10.3969/j.issn.1000-484X.2023.09.016前列腺癌骨转移关键基因的生物信息学分析①田志崇衡立董婧婷李治国②陈飞飞梁鹏王青③曹凤宏张立国④康绍叁④(华北理工大学附属医院泌尿外科,唐山063000)中图分类号R737.25 文献标志码 A 文章编号1000-484X(2023)09-1885-08[摘要]目的:利用生物信息学技术探究前列腺癌骨转移发生发展的分子机制,为前列腺癌骨转移提供新的预防和治疗靶点。
方法:从基因表达数据库(GEO)检索筛选得到包含20例前列腺癌骨转移样本和69例前列腺癌淋巴结转移样本的基因芯片数据集GSE74685。
利用R语言Limma包对原始数据进行预处理并筛选差异表达基因(DEGs)。
通过基因功能注释在线工具DAVID对DEGs进行GO功能富集分析和KEGG通路富集分析。
利用STRING在线检索工具及Cytoscape软件构建DEGs的蛋白质-蛋白质相互作用(PPI)网络,并用MCODE和cytoHubba插件筛选重要模块和关键基因。
通过HCMDB和GEPIA 数据库验证关键基因的表达、生存预后以及诊断价值。
结果:从GSE74685数据集中筛选出2 022个DEGs,包括842个上调基因和1 180个下调基因。
GO功能富集分析显示DEGs主要在细胞外基质组织、胶原分解代谢过程、对机械刺激的反应、中性粒细胞趋化性的正调控方面富集;KEGG通路富集提示黏着斑、细胞外基质受体相互作用是DEGs富集的主要信号通路。
通过PPI网络筛选得到11个关键基因,分别为EZH2、PLG、SRC、CAV1、CHD4、HIST2H2BE、KDM1A、POLR2E、VWF、APOE、THBS1。
对11个关键基因的基因表达验证和生存分析发现APOE和EZH2与前列腺癌骨转移密切相关。
结论:EZH2、APOE可能参与前列腺癌骨转移的发生发展,可以作为潜在的治疗靶点,为前列腺癌骨转移的预防和治疗提供新的研究方向。

·论著·SDC-1调控TGF-β1/THBS1信号通路对肝纤维化进程的影响羊丹田婉婷徐菁【摘要】目的探究多配体蛋白聚糖-1(SDC-1)在肝纤维化进程中的作用机制。
方法选择2021年4月至2023年4月于三二〇一医院住院治疗并行肝穿刺活体组织病理检查的102例慢性乙型肝炎患者作为研究对象。
采集患者的空腹静脉血,采用ELISA法检测患者血清SDC-1的表达水平,并比较不同肝纤维化分期患者血清SDC-1表达水平的差异。
观察经转化生长因子-β1(TGF-β1)诱导活化的LX-2细胞中SDC-1表达水平的变化,以及敲低SDC-1表达对活化的LX-2细胞中α-平滑肌肌动蛋白(α-SMA)、血小板反应蛋白1(THBS1)表达水平及细胞增殖、细胞周期的影响。
结果随着肝纤维化程度逐渐加重,慢性乙型肝炎患者血清SDC-1的表达水平呈升高趋势(P<0.05)。
与阴性对照(NC)组相比,TGF-β1组α-SMA、SDC-1蛋白及其mRNA的相对表达量均显著升高,细胞增殖活性显著增强,G1期细胞占比显著降低,S期和G2期细胞占比显著升高(P均<0.05)。
与NC 小干扰RNA(siRNA)组相比,SDC-1 siRNA组α-SMA、TGF-β1、THBS1蛋白及其mRNA的相对表达量均显著降低,细胞增殖活性显著减弱,G1期细胞占比显著升高,S期和G2期细胞占比显著降低(P均<0.05)。
结论敲低SDC-1表达可能通过调控TGF-β1/THBS1信号通路,抑制肝星状细胞(HSC)的活化及增殖,阻滞HSC由G1期进入S期和G2期,进而发挥抑制肝纤维化进展的作用。
【关键词】慢性乙型肝炎;肝纤维化;多配体蛋白聚糖-1;血小板反应蛋白1;肝星状细胞DOI: 10. 3969/j. issn. 1673-534X. 2023. 06. 007Effect of SDC-1 regulating TGF-β1/THBS1 signaling pathway on progress of liverfibrosis YANG Dan, TIAN Wanting, XU Jing. Department of Gastroenterology, 3201 Hospital, Hanzhong723000, China【Abstract】 Objective This paper intends to explore the role of syndecan-1 (SDC-1) inthe progression of liver fibrosis. Methods From April 2021 to April 2023, a total of 102 patientswith chronic hepatitis B who were hospitalized and underwent liver biopsy in the 3201 Hospital wereselected as the research objects. The fasting venous blood was collected and the expression of serumSDC-1 was measured using the ELISA method. The expression of serum SDC-1 was compared amongpatients with different stages of liver fibrosis. The changes of SDC-1 expression in activated LX-2cells induced by transforming growth factor-β1 (TGF-β1), and the effects of knockdown of SDC-1 on the expression of α-smooth muscle actin (α-SMA), thrombospondin 1(THBS1), cell proliferation and cell cycle in activated LX-2 cells were observed. Results With the aggravation of liver fibrosisstages, the expression level of serum SDC-1 in patients with chronic hepatitis B increases (P<0.05). Compared with the negative control (NC) group, the relative expressions of α-SMA, SDC-1 protein and their mRNA in the TGF-β1 group are increased, the cell proliferation activity is increased, the proportion of 作者单位:723000 陕西汉中,三二〇一医院消化内科通信作者:徐菁,Email:*****************G1 phase cells is decreased, and the proportion of S phase and G2 phase cells are increased, with statistically significant differences (P<0.05). Compared with the NC siRNA group, the relative expressions of α-SMA, TGF-β1, THBS1 protein, and their mRNA in the SDC-1 siRNA group are decreased, the cell proliferation activity is decreased, the proportion of G1 phase cells is increased, and the proportion of S phase and G2 phase cells are decreased, with statistically significant differences (P<0.05). Conclusion Knockdown of SDC-1 expression may inhibit the activation and proliferation of hepatic stellate cells by regulating TGF-β1/ THBS1 signaling pathway, and block the progression of hepatic stellate cells from entering the G1 phase to the S phase and the G2 phase, and then play a role in inhibiting the process of liver fibrosis.【Key words】 Chronic hepatitis B; Liver fibrosis; Syndecan-1; Thrombospondin-1; Hepatic stellate cell乙型肝炎是全球范围内的重要公共卫生问题。

·综述·胃癌诊断生物学标志物的研究进展孟文婷王蔚虹*北京大学第一医院消化内科(100034)摘要早期诊断和治疗对提高胃癌患者的生存率至关重要,但目前胃癌诊断仍依赖胃镜检查,该检查方式有创、费用较高,很难在大规模无症状人群中筛查和普及。
因此,探索无创筛查方式对早期发现胃癌至关重要。
本文概述了胃癌相关生物学标志物的前沿研究,以期早期发现胃癌,提高胃癌患者的生存率。
关键词胃肿瘤;筛查;诊断;生物学标志物Advances in Research on Biomarkers of Gastric Cancer MENG Wenting,WANG Weihong.Department ofGastroenterology,Peking University First Hospital,Beijing (100034)Correspondence to:WANG Weihong,Email:***********************AbstractEarly diagnosis and treatment of gastric cancer may improve the prognosis of the disease.At present,thediagnosis of gastric cancer depends on gastric endoscopy and histopathology,which is invasive and expensive and not suitable for screening in the large population.Non⁃invasive screening method is essential for the early detection of cancer.This article reviewed the advances in research on related biomarkers of gastric cancer so as to increase the early detection of gastric cancer and survival rate of patients.Key wordsStomach Neoplasms;Screening;Diagnosis;BiomarkersDOI :10.3969/j.issn.1008⁃7125.2023.02.007*本文通信作者,Email:***********************胃癌是目前世界上发病率较高的肿瘤之一,2020年全球胃癌新确诊病例数>100万例[1],其中中国胃癌发病例数约占世界病例数的50%[2],而胃癌预后与治疗时机息息相关,早期诊断和治疗对提高胃癌患者的生存率至关重要。

FGFR2、THBS1和THBS4在胃癌组织中的表达及临床意义周潇;黄婷婷;邱红【摘要】目的探讨成纤维细胞生长因子2型受体(fibroblast growth factor receptor 2,FGFR2)、凝血酶敏感蛋白家族(thrombospondins,THBS)成员THBS1和THBS4在胃癌组织中的表达及临床意义,并分析FGFR2与THBS1、THBS4的相关性.方法采用免疫组化SABC法检测胃癌组织中FGFR2、THBS1和THBS4的表达,并分析其与临床病理特征的关系.结果 FGFR2、THBS1和THBS4在胃癌组织中的高表达率分别为68.67%、57.83%和62.65%,三者在胃癌组织中的表达均高于癌旁正常组织(P<0.001).FGFR2表达与肿瘤浸润深度(P=0.003)和临床分期(P=0.009)密切相关,而与患者年龄、性别、肿块大小、分化程度及淋巴结转移无相关性(P>0.05);THBS1表达与患者的临床病理特征均无相关性(P>0.05);THBS4表达与患者肿瘤分化程度相关,高或中分化肿瘤组织THBS4的表达明显高于低分化肿瘤组织(P=0.001).相关性分析显示FGFR2与THBS1表达呈正相关(r=0.229,P=0.037),与THBS4表达呈负相关(r=-0.213,P=0.045).结论 FGFR2、THBS1与THBS4在胃癌组织中高表达,FGFR2可能正向调控THBS1表达,而负向调控THBS4表达,其作用可能是FGFR2信号通路参与胃癌侵袭转移的分子机制之一.【期刊名称】《中国癌症防治杂志》【年(卷),期】2017(009)005【总页数】5页(P368-372)【关键词】胃肿瘤;成纤维细胞生长因子2型受体;THBS1;THBS4【作者】周潇;黄婷婷;邱红【作者单位】430030 武汉华中科技大学同济医学院附属同济医院肿瘤科;430030 武汉华中科技大学同济医学院附属同济医院肿瘤科;430030 武汉华中科技大学同济医学院附属同济医院肿瘤科【正文语种】中文【中图分类】R735.2胃癌是最常见的消化系统恶性肿瘤,近年来发病率明显降低,但患者预后并无明显改善[1]。

信号通路11—TGF-βSmad订阅号APExBIO▲ TGF-β / Smad信号通路图一、TGF-β / Smad调节过程转化生长因子β(Transforming growth factor beta,TGF-β)信号通路参与生物体和胚胎发育的多种细胞过程,包括细胞生长、细胞分化、凋亡、细胞稳态等。
尽管TGF-β信号通路调节的细胞过程范围很广,但是该过程相对简单。
TGF-β超家族配体结合一个II型受体,其募集并磷酸化一个I型受体。
该I型受体然后磷酸化受体调节的SMAD(receptor-regulated SMADs ,R-SMADs),其结合coSMAD SMAD4。
R-SMAD / coSMAD复合物积聚在细胞核中,作为转录因子并参与靶基因表达的调控。
TGF-β配体结合受体TGF-β超家族配体包括:骨形态发生蛋白(Bone morphogenetic proteins,BMPs),生长和分化因子(Growth and differentiation factors,GDFs),抗缪勒氏管激素(Anti-müllerian hormone,AMH),激活素(Activin),Nodal和TGF-β。
配体分为两个分支:(1)TGF-β/激活素分支和(2)BMP/ GDF分支。
TGF-β/激活素分支包括TGF-β,激活素, Nodal。
BMP / GDF分支包括BMP,GDF和AMH 配体。
信号传导从TGF-β超家族配体与TGF-βII型受体的结合开始。
II型受体是丝氨酸/苏氨酸受体激酶,其催化I型受体的磷酸化。
每种类型的配体结合特异性II型受体,在哺乳动物中有七种已知的I型受体和五种II型受体。
II型受体募集I型受体和磷酸化TGF-β配体结合II型受体二聚体,其募集I型受体二聚体,与配体形成杂四聚体复合物。
II型受体磷酸化I型受体的丝氨酸残基。
I型受体磷酸化R-SMAD有5个受体调节的SMAD:SMAD1,SMAD2,SMAD3,SMAD5和SMAD9(有时称为SMAD8)。