碳及其化合物间的转化
- 格式:doc
- 大小:48.50 KB
- 文档页数:4

碳硅及其重要化合物间的转化关系全文共四篇示例,供读者参考第一篇示例:碳硅是一种重要的元素,它们在自然界中广泛存在并且具有许多重要的化合物。
碳和硅是两种非金属元素,它们在化学性质上有一些相似之处,因此在一些化学反应中可以相互转化。
在本文中,我们将探讨碳硅及其重要化合物之间的转化关系。
让我们来看一下碳的化合物。
碳是一种非金属元素,它在自然界中存在于多种形式中,如石墨、金刚石和全新炭等。
碳在化学反应中通常以四价的形式存在,它可以与氧、氢、氮等元素形成许多不同的化合物。
碳酸盐是碳循环中的一个重要环节,它在地壳中有着广泛的存在,并且可以通过各种化学反应转化为其他碳化合物,如石灰石、煤炭等。
硅是一种具有金属性质的元素,它在自然界中存在于硅石、石英和硅酸盐等形式中。
硅与氧形成的硅酸盐是地壳中的主要组成,它们可以通过地球内部的热液作用、熔融作用等过程来形成。
硅也可以与其他元素形成许多重要化合物,如硅烷、硅酸等。
碳硅在化学性质上有一些相似之处,因此它们在一些化学反应中可以相互转化。
碳可以与硅直接反应,生成碳硅化合物,如碳化硅。
碳化硅是一种重要的半导体材料,它具有优良的导电性能和热导率,被广泛应用于电子器件、太阳能电池等领域。
碳硅材料还可以通过不同的方法制备,如化学气相沉积、烧结等。
碳硅及其重要化合物之间存在着多种转化关系,它们在材料科学、化工等领域中有着广泛的应用前景。
通过深入研究碳硅化学性质及其相互转化关系,我们可以更好地利用这些重要元素和化合物,推动科学技术的发展,实现材料的创新和应用。
希望本文能够帮助读者更深入地了解碳硅及其重要化合物之间的转化关系,激发对这一领域的兴趣和热情。
希望碳硅化学的研究能够为人类社会的可持续发展做出更大的贡献。
【2000字】。
第二篇示例:碳硅是一种重要的元素,其在自然界中的存在形式有许多,包括石墨、金刚石等,而碳硅也是一种重要的金属loid,其在化学反应中具有独特的性质和作用。
碳硅及其重要化合物间的转化关系,既包括碳硅之间的相互转化,也包括碳硅与其他元素形成的化合物之间的转化关系。
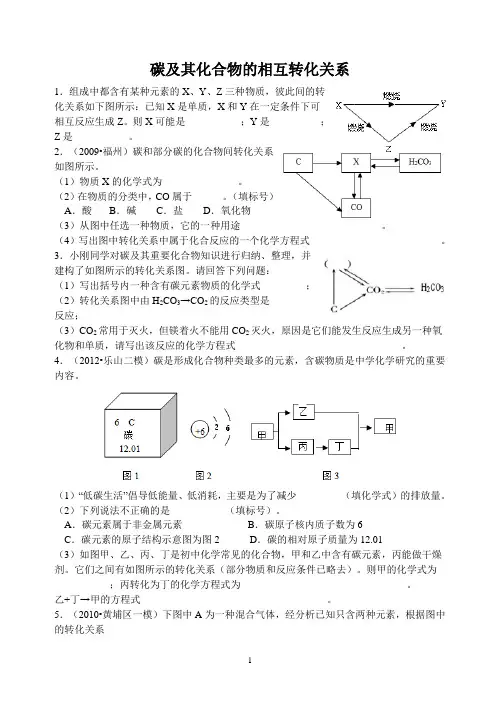
碳及其化合物的相互转化关系1.组成中都含有某种元素的X、Y、Z三种物质,彼此间的转化关系如下图所示:已知X是单质,X和Y在一定条件下可相互反应生成Z。
则X可能是___________;Y是__________;Z是___________。
2.(2009•福州)碳和部分碳的化合物间转化关系如图所示。
(1)物质X的化学式为_______________。
(2)在物质的分类中,CO属于______。
(填标号)A.酸 B.碱 C.盐 D.氧化物(3)从图中任选一种物质,它的一种用途____________________________。
(4)写出图中转化关系中属于化合反应的一个化学方程式__________________________。
3.小刚同学对碳及其重要化合物知识进行归纳、整理,并建构了如图所示的转化关系图。
请回答下列问题:(1)写出括号内一种含有碳元素物质的化学式_________;(2)转化关系图中由H2CO3→CO2的反应类型是________反应;(3)CO2常用于灭火,但镁着火不能用 CO2灭火,原因是它们能发生反应生成另一种氧化物和单质,请写出该反应的化学方程式_________________________________。
4.(2012•乐山二模)碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少________(填化学式)的排放量。
(2)下列说法不正确的是___________(填标号)。
A.碳元素属于非金属元素B.碳原子核内质子数为6C.碳元素的原子结构示意图为图2 D.碳的相对原子质量为12.01(3)如图甲、乙、丙、丁是初中化学常见的化合物,甲和乙中含有碳元素,丙能做干燥剂。
它们之间有如图所示的转化关系(部分物质和反应条件已略去)。
则甲的化学式为___________;丙转化为丁的化学方程式为_________________________________。

碳及碳的化合物间的所有化学方程式1碳在氧气中充分燃烧:C + O2点燃CO22碳在氧气中不充分燃烧:2C + O2点燃2CO3一氧化碳在氧气中燃烧:2CO + O2点燃2CO24甲烷在空气中燃烧:CH4+ 2O2 点燃CO2+ 2H2O5酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2+ 3H2O6碳酸不稳定而分解:H2CO3=== H2O + CO2↑7高温煅烧石灰石:CaCO3高温CaO + CO2↑8木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑9焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑10焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2↑11一氧化碳还原氧化铜:CO+ CuO △Cu + CO2一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO212一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO213苛性钠暴露在空气中变质:2NaOH + CO2==== Na2CO3+ H2O14大理石与稀盐酸反应:CaCO3+ 2HCl ===CaCl2+ H2O + CO2↑15碳酸钠与稀盐酸反应: Na2CO3+ 2HCl===2NaCl + H2O + CO2↑16碳酸镁与稀盐酸反应: MgCO3+ 2HCl ===MgCl2+ H2O + CO2↑17消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O18硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑19二氧化碳溶解于水:CO2 + H2O === H2CO3文案编辑词条B 添加义项?文案,原指放书的桌子,后来指在桌子上写字的人。
现在指的是公司或企业中从事文字工作的职位,就是以文字来表现已经制定的创意策略。
文案它不同于设计师用画面或其他手段的表现手法,它是一个与广告创意先后相继的表现的过程、发展的过程、深化的过程,多存在于广告公司,企业宣传,新闻策划等。


高一化学物质的分类试题1.以下表示的是碳及其化合物的相互转化关系:C CO2H2CO3CaCO3CO2其中涉及的基本反应类型依次为() A.置换、化合、分解、复分解B.置换、化合、复分解、分解C.化合、置换、分解、复分解D.化合、置换、复分解、分解【答案】B【解析】C CO2为置换反应,CO2H2CO3为化合反应,H2CO3CaCO3为复分解反应,CaCO3CO2为分解反应。
【考点】化学反应类型2.下列各组物质中,互称为同分异构体的是( )。
A.水与冰B.O2与O3C.D.【答案】D【解析】A.水与冰是同一物质的不同状态,错误;B.O2与O3是同一元素的不同性质的单质,是同素异形体,错误;C.由于甲烷是正四面体结构,所以其中的2个H原子被甲基取代,结构还是四面体结构,二者是同一物质,错误;D.2-甲基丁烷和2,-二,2甲基丙烷分子式相同,结构不同,是同分异构体,正确。
【考点】考查同分异构体是判断的知识。
3.下列物质属于纯净物的是A.冰水混合物B.无污染的空气C.盐酸D.漂白粉【答案】A【解析】纯净物是只有一种物质组成;A.正确;B.空气本属混合物,无污染条件下也是,错误;C.盐酸是HCl的水溶液,混合物,错误;D.漂白粉的主要成分是氯化钙和次氯酸钙,混合物,错误。
【考点】纯净物和混合物的区别。
4.在下列物质中,化合物类型相同的一组是A.NaCl HCl B.CO2 H2OC.H2CO3KCl D.MgCl2SO2【答案】B【解析】一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答。
A、氯化钠中钠元素和氯元素之间以离子键结合,氯化氢中氯元素和氢元素之间以共价键结合,所以两物质含有的化学键类型不同,故A错误;B、二氧化碳中碳元素和氧元素之间以共价键结合,水分子中氢元素和氧元素之间以共价键结合,所以二氧化碳和水所含的化学键类型相同,故B正确;C、碳酸中碳元素和氧元素之间以及氢元素与氧元素之间以共价键结合,氯化钾中氯元素和钾元素之间以离子键结合,所以两物质含有的化学键类型不同,故C错误;D、氯化镁中氯元素和镁元素之间以离子键结合,二氧化硫中氧元素和硫元素之间以共价键结合,所以两物质含有的化学键类型不同,故D错误;故选B。

第2课时碳及其化合物间的转化一、自然界中碳及其化合物间的转化1.转化形式2.溶洞及钟乳石、石笋的形成(1)溶洞形成的化学方程式为_______________________________________________。
________________________________________________________________________(2)钟乳石、石笋形成的化学方程式为______________________________________________________________________________________________________________。
二、生产和生活中碳及其化合物间的转化1.高炉炼铁(1)原料:______和__________(主要成分是______)。
(2)过程(实际起还原作用的是______)①CO的产生相关反应的化学方程式为:_______________________________________________②铁矿石被还原相关反应的化学方程式为_________________________________________________;________________________________________________________________________;________________________________________________________________________。
2.木炭燃烧(用化学方程式表示)①________________________________________________________________________,②________________________________________________________________________,③________________________________________________________________________,④________________________________________________________________________。

碳的多样性世界上的物质中有机物占相当大的比例,而有机物中都含有碳元素,可以说,碳元素既是构成生物体的基本元素,又是构成地壳岩石和化石燃料的元素。
本节主要分析自然界中的碳单质及典型化合物。
【重点难点】重点:碳的化合物中Na2CO3、NaHCO3的化学性质;碳单质与相应化合物的转化。
难点:碳及其化合物的转化。
【知识讲解】一、多种多样的碳单质知识回顾:初中已讲过碳元素有金刚石、石墨两种单质,氧元素有O2、O3两种单质,磷元素有白磷、红磷两种单质。
一种元素组成几种不同单质的现象叫同素异形现象。
1、同素异形体(1)概念:同种元素组成的性质不同的几种单质互称同素异形体。
(2)与同位素的比较:2、碳元素的同素异形体:金刚石、石墨、C60。
(1)金刚石:正四面体结构。
每个碳原子与另外4个C原子形成正四面体结构。
碳原子都以这种方式一直排列,形成具有空间网状结构的原子晶体。
该方式决定了金刚石的硬度相当大。
(2)石墨:层状结构。
石墨中的碳原子呈片层结构,每一层内碳原子都形成正六边形结构,每个C原子能形成3个正六边形,碳原子一直以这种方式排列,决定了石墨的熔点、沸点相当高,但层与层之间的作用较弱,易被破坏,故石墨的硬度不大。
(3)C60:球形结构,每60个C原子构成一个C60分子,C60分子形似足球,又名“足球烯”或“富勒烯”。
60个C原子位于球的表面,呈正五边形和正六边形排列,C60的式量为720。
总结:金刚石、石墨、C60的结构不同,晶体类型也不同,前两个为原子晶体(石墨结构又稍特殊,有时又叫混合晶体),C60为分子晶体。
可知,它们是由于碳原子排列方式不同,形成了三种性质不同的碳的同素异形体。
碳元素之所以在自然界有稳定存在的碳单质,主要是因为C原子最外层4个电子,得失电子都不容易,在自然界中能稳定存在,不过,碳元素在自然界中还主要是以化合态的形式存在。
二、广泛存在的含碳化合物1、含碳元素的矿石大理石或石灰石或方解石(CaCO3)、菱锌矿(ZnCO3)、菱镁矿(MgCO3)、菱铁矿(FeCO3)、白云石(CaMg(CO3)2) 等,这些矿石是自然界中的典型无机物。

第2课时碳及其化合物间的转化学习目标定位:1.根据生产、生活中的碳元素转化的实例,了解碳单质、一氧化碳、二氧化碳、碳酸盐、碳酸氢盐之间的转化,从而进一步了解它们的性质。
2.能够解释与含碳物质有关的现象和问题,如水垢的形成与消除、木炭燃烧的现象、工业上炼铁的原理等。
知识点一自然界中碳及其化合物间的转化【探究活动】1.自然界中,碳及其化合物间进行着永不停息的转化,这些转化是非常重要的。
观察下图,分析下列问题:(1)二氧化碳有哪些途径进入大气中?(2)水体中的含碳物质是从哪里来的?(3)自然界消耗CO2的过程有哪些?(4)温室效应是怎样产生的?有什么危害?2.碳的化合物在自然界中的转化创造了许多奇迹,请看下面一幅图片。
(1)①溶洞形成的化学方程式为_____________________________________________ ________________。
②钟乳石、石笋形成的化学方程式为_______________________________________ ________________。
1.以下属于自然界中碳及其化合物间转化过程的是( ) ①植物通过光合作用吸收二氧化碳形成葡萄糖②以无机化合物氰酸铵(NH 4CNO)为原料合成尿素[CO(NH 2)2] ③钟乳石、石笋的形成 ④石油、天然气等化石燃料的形成A .①②③④B .只有②③④C .只有①②③D .只有①③④2.A 、B 、C 、D 、E 五种物质的转化关系如下图所示。
已知A 为二元碱,微溶于水且溶解度随温度升高而降低。
(1)写出各物质的化学式:A .________________;B.________________;C.________________;D.________________; E .________________。
(2)写出下列两个变化的离子方程式:BD________________________________________________________________________。
碳的多样性一、碳单质的多样性1.同素异形体(1)同素异形体的概念:由同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体。
(2)常见的同素异形体:碳:金刚石、石墨、C60;氧:氧气、臭氧(O3)。
2.金刚石、石墨、C60(1)结构:①金刚石:每个碳原子与另外4个碳原子以一种较强的相互作用相连接,形成正四面体结构,向空间伸展形成空间网状结构。
②石墨:石墨晶体是层状结构。
在同一层内,碳原子排列成正六边形(碳原子位于正六边形的顶点上),一个个正六边形排列成平面网状结构,每一个碳原子都跟其他3个碳原子相连。
在同一层内,相邻的碳原子以较强的相互作用相结合,但层与层之间以一种较弱的相互作用相结合。
③C60:C60分子是由60个碳原子构成的,它的形状像足球,由12个正五边形和20个正六边形组成。
分子内部,碳原子间以较强的相互作用结合,但分子间的相互作用较弱。
(2)性质1.常见的含碳化合物(1)有机化合物:如蛋白质、淀粉、油脂、以及石油、液化气、天然气等的主要成分;(2)无机化合物:CO、CO2、H2CO3、碳酸钠、碳酸氢钠、大理石、方解石、白云石、菱锌矿、菱镁矿、菱铁矿等。
2.碳酸钠和碳酸氢钠①热稳定性不同。
分别加热少量固体,若发生分解反应,将产生的气体通入澄清的石灰水中,石灰水变浑浊的原试剂是NaHCO3,另一个为Na2CO3。
②和酸反应生成气体的速率不同。
分别取一定量的固体,加入等浓度等体积的盐酸,反应快、产生气体相应多的为碳酸氢钠,另一个为碳酸钠。
③阴离子不同。
分别取其稀溶液,滴加氯化钡稀溶液或CaCl2溶液,产生沉淀的原试剂为碳酸钠,另一个为碳酸氢钠(特别注意:该方法必须取极稀溶液)。
(3)Na2CO3和NaHCO3在一定条件下的相互转化:溶液中:NaHCO3+NaOH=Na2CO3+H2O,Na2CO3+CO2+H2O=2NaHCO3固体中:NaOH+NaHCO3Na2CO3+H2O,2NaHCO3Na2CO3+CO2↑+H2O△△三、碳及其化合物间的转化1.自然界中碳及其化合物的转化溶洞的形成原理石灰岩的主要成分是碳酸钙。
碳及其化合物间的转化
制案:李江凤审:高一化学组
学习目标;
1、了解碳及其化合物之间的转化和性质,并利用所学知识解释社会生
活和自然现象。
2、体会化学在人类生产生活中的应用。
新课讲授:
三.碳及其化合物间的转化
1.自然界中碳及其化合物间的转化
含碳化合物可分为和。
含碳无机物中有两种重要的氧化物CO和CO2。
绿色植物通过作用吸收CO2,通过作用将CO2释放到大气中。
由于人类活动经由多途径增加大气中的CO2,使CO2的含量猛增,从而导致效应。
2.模拟溶洞的形成。
(1)实验目的:探究溶洞的形成原理。
(2)实验方案与记录:
碳的化合物在自然界中的转化创造了许多奇迹,自然界中美妙的石笋、钟乳石和石柱的形成,都与这种转化密切相关。
3.生产和生活中碳及其化合物间的转化
(1)高炉炼铁
原料:焦炭、铁矿石、空气。
还原剂CO生成的方程式
为:。
CO还原铁的氧化物的反应方程式:
;
(2)木炭燃烧
用化学方程式表示下列转化过程:。
(3)水垢的形成
我们使用的自来水中往往含有碳酸氢钙,因此水壶内壁常含有水垢。
写出形成水垢的主要化学方程式,用食醋浸泡,再用水清洗可除之,写出有关的化学方程式。
思考:
1.请以石灰石为原料,设计制备碳酸钙的方案,画出流程图,并写出有关化学方程式。
2.请你设计实验方案证明鸡蛋壳主要成分是碳酸钙,并写出有关化学方程式。
(4)无机化合物与有机化合物之间的转化
1828年,德国化学家用无机物NH4CNO合成出有机物(填化学式)。
课后巩固练习:
1.自然界中形成化合物种类最多的元素是
A.O B.N C.C D.H
2.1828年,德国化学家维勒用无机物NH4CNO合成出的有机物是
A.甲烷B.酒精C.醋酸D.尿素
3.在①植物的光合作用②植物的呼吸作用③岩石的风化④海水的吸收⑤工业上制干冰⑥使熟石灰变石灰石等这些过程中,属于自然界消耗CO2的主要过程是A.仅①B.仅①⑥C.①②③
D.①③④
4.碳的多样性体现在①碳单质的多样性②含碳化合物的多样性③碳转化的多样性④碳及其化合物应用的多样性等方面。
碳有多种同素异形体,所体现的是上述:A.① B.② C.③ D.④5.大理石可以用作墙面、地面和厨房桌面,其主要成份是碳酸钙。
食醋不慎滴在大理石桌面上,会使其失去光泽,变得粗糙,下列能正确解释此现象的是A.食醋中的水使碳酸钙溶解B.食醋中的醋酸将碳酸钙氧化
C.食醋中的醋酸将碳酸钙还原D.食醋中的醋酸与碳酸钙发生了复分解反应
6.纯净的碳酸氢钙试样在高温下分解,当剩余的固体质量为原试样的质量的一半时,碳酸氢钙的分解率为
A.50%B.75%C.92.5%D.100%
7.从某微溶物质A的悬浊液开始,可发生如图(1)所示的一系列变化。
回答下面问题:
(1)A的化学式是______________;
(2)在实验室中收集气体D的方法是_____ ___________;
(3)操作①的名称是______,在操作①中所使用的玻璃仪器的名称是___ _______;
(4)反应②的化学方程式为_____ ;
(5)反应③的离子方程式为_ _;
(6)在实验室中,如要获得干燥纯净的气体D,可以将它通过如图(2)的装置,其中瓶I中盛放的试剂是____________,瓶II中盛放的试剂是____________。
8.(1)高炉炼铁主要反应原理是:。
氧化剂是,氧化产物是,若有2.8gCO 反应,转移电子数为。
(2)将0.25molFe2O3在CO中还原,并把生成的气体通入足量的澄清石灰水中,反应一段时间后,令反应停止,此时得到白色沉淀45g。
此时被还原的Fe2O3的质量分数为。