铝及其化合物的相互转化关系.
- 格式:ppt
- 大小:116.01 KB
- 文档页数:15
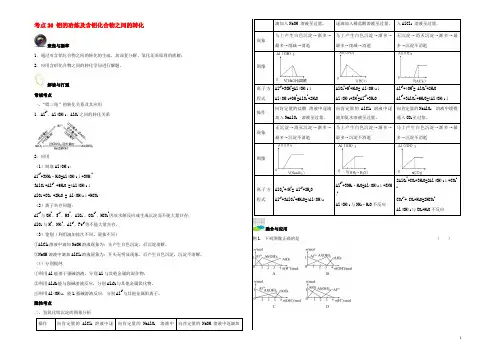
考点26 铝的冶炼及含铝化合物之间的转化聚焦与凝萃1.通过对含铝化合物之间的转化的生疏,加深复分解、氧化还原原理的理解;2.应用含铝化合物之间的转化学问进行解题。
解读与打通常规考点一、“铝三角”的转化关系及其应用1.Al3+、Al(OH)3、AlO-2之间的转化关系2.应用(1)制取Al(OH)3:A13++3NH3·H2O=Al(OH)3↓+3NH4+3AlO-2+Al3+ +6H2O =4Al(OH)3↓AlO-2+CO2 +2H2O = Al(OH)3↓+HCO3-(2)离子共存问题:Al3+与OH-、S2-、HS-、AlO-2、CO32-、HCO3-因双水解反应或生成沉淀而不能大量共存;AlO-2与H+、NH4+、Al3+、Fe3+等不能大量共存。
(3)鉴别(利用滴加挨次不同,现象不同)①AlCl3溶液中滴加NaOH溶液现象为:先产生白色沉淀,后沉淀溶解。
②NaOH溶液中滴加AlCl3溶液现象为:开头无明显现象,后产生白色沉淀,沉淀不溶解。
(4)分别提纯①利用Al能溶于强碱溶液,分别Al与其他金属的混合物。
②利用Al2O3能与强碱溶液反应,分别Al2O3与其他金属氧化物。
⑧利用Al(OH)3,能L强碱溶液反应,分别Al3+与其他金属阳离子。
隐性考点二、氢氧化铝沉淀的图象分析操作向肯定量的AlCl3溶液中逐向肯定量的NaAlO2溶液中向肯定量的NaOH 溶液中逐滴加滴加入NaOH 溶液至过量。
逐滴加入稀盐酸溶液至过量。
入AlCl3溶液至过量。
现象马上产生白色沉淀→渐多→最多→削减→消逝马上产生白色沉淀→渐多→最多→削减→消逝无沉淀→消灭沉淀→渐多→最多→沉淀不消逝图像离子方程式Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2OAlO2-+H++H2O= Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl3++4OH-= AlO2-+2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓操作向肯定量的盐酸溶液中逐滴加入NaAlO2溶液至过量。

第三章化学反应方程式一、钠及其重要化合物之间的转化关系 ① ② ③ ④Na 2O 2←Na →NaOH →Na 2CO 3←NaHCO 3 1、钠的燃烧2Na + O2 == Na 2O 2· 2、钠与水的反应,2Na + 2H 2O == 2 NaOH +H 2↑ 3、氢氧化钠吸收二氧化碳而变质2NaOH + CO 2== Na 2CO 3+ H 2O 4、碳酸氢钠加热分解2NaHCO 3== Na 2CO 3+ H 2O + CO 2↑ 二、铝及其化合物之间的转化关系Al → Al 2O 3 ← Al (OH )3 → AlCl 3⑤⑦ 1、铝表面生成氧化膜的反应4Al +3O 2 ==2 Al 2O 3 2、不溶物氢氧化铝加热分解2Al (OH )3 ==Al 2O 3 + 3H 2O 3、氢氧化物 氢氧化铝与盐酸反应Al (OH )3+ 3HCl== AlCl 3+ 3H 2O 4、铝与盐酸的反应2 Al + 6HCl == 2 AlCl 3+3 H 2↑ 5、三氧化铝与氢氧化钠反应Al 2O 3+ 2NaOH == 2NaAlO 2 + 2H 2O 6、铝与氢氧化钠反应2 Al + 2NaOH + 2H 2O == 2NaAlO 2+3 H 2↑△△△7、氢氧化铝与氢氧化钠溶液反应Al (OH )3 NaOH == NaAlO 2 + 2H 2O 8、偏铝酸根和酸不能共存的原因NaAlO2 + HCl (少量)+ H 2O == Al (OH )3 + NaCl 三、铁及其重要化合物之间的转化关系 ① ② ③ ④ ⑤ Fe 3O 4←FeFe 2O 3 Fe (SCN )31、铁在氧气中燃烧3Fe +2O 2 == Fe 3O 4 2、铁与稀盐酸反应制取氢气 Fe + 2HCl == Fe Cl 2 + H 2↑ 3、氯化亚铁溶液与氢氧化钠:先生成白色沉淀,迅速转化为灰绿色,最后变为红褐色:Fe Cl 2 + 2NaOH == Fe (OH )2↓+ 2NaCl 4Fe (OH )2 + O 2 + 2H 2O == 4 Fe (OH )34、红褐色的氢氧化铁与铁反应生成盐和水 Fe (OH )3+ 3HCl== Fe Cl 3 + 3H 2 O5、棕黄色的氯化铁溶液与氢氧化钠溶液反应生成红褐色的氢氧化铁沉淀 Fe Cl 3 + 2 NaOH== Fe (OH )3↓+ 3NaCl6、常见的还原剂氯化亚铁与强氧化剂氯气反应 2Fe Cl 2 + Cl 2== 2Fe Cl 37、要还原铁离子为亚铁离子需要加入还原剂如:Fe 、Cu 、 2Fe Cl 3 + Fe == 3Fe Cl 28、不溶性碱氢氧化铁加热分解2 Fe (OH )3== Fe 2O3 + 3H 2 O△点燃10、 三价铁离子的检验:溶液变为(血)红色 FeCl 3 + 3KSCN == Fe (SCN )3 +3KCl四、铜及其化合物的转化:2 1、 铜在加热条件下和氧气反应 2Cu +O 2 == 2CuO 2、 氧化铜与硫酸反应CuO + H 2SO 4 == CuSO 4+ H 2 O3、 在蓝色硫酸铜溶液中加入氢氧化钠溶液后生成蓝色氢氧化铜沉淀 CuSO 4 + 2 NaOH == Cu (OH )2↓+Na 2SO 44、 曾清得鉄则化为铜(湿法冶铜) CuSO 4 + Fe == Cu + FeSO 45、 不溶性碱氢氧化铜加热分解 Cu (OH )2 == CuO + H 2 O△△一、写出下列方程式1、Na+ O2= Na+ O2Na+ H2O= Na+ HCl =2、将一小粒钠投入到盛放FeCl3溶液的烧杯中。

铝及其化合物1.化学性质 铝及化合物的相互转化关系①②③④⑤⑥⑦⑧⑨Al Al 2O 3 Al(OH)3 AlCl 3NaAlO 2⑩(1)和氧气反应。
铝极易和氧气发生反应,生成一层致密的氧化膜。
这层氧化膜保护里边的金属不易和氧气反应而被腐蚀。
铝和氧气反应的化学方程式为223432Al O Al O +加热或点燃。
加热铝箔实验时,融化的铝并不滴落,原因是Al 2O 3薄膜将熔化的Al 承接住了,这个实验也说明氧化铝的熔点比铝高。
(2)铝也能和其他非金属反应,写出下列反应方程式:①铝在氯气中燃烧23232Al Cl AlCl +点燃;②铝粉和硫粉混合加热2323Al S Al S +点燃。
(2)和酸反应。
写出下列反应方程式和对应的离子方程式:①HCl 反应:化学反应方程式322623Al HCl AlCl H ++=↑,离子反应方程式322623Al H Al H +++=+↑②H 2SO 4反应:化学反应方程式242432232()3Al H SO Al SO H +=+↑,离子反应方程式322623Al H Al H +++=+↑;(3)和NaOH 溶液反应:化学反应方程式22222223Al NaOH H O NaAlO H ++=+↑,离子反应方程式22222223Al OH H O AlO H --++=+↑。
等质量的铝粉分别和足量的盐酸和氢氧化钠溶液反应,产生的氢气相等,等浓度等体积的盐酸和氢氧化钠溶液和足量的铝粉反应,产生的氢气NaOH 的多。
(4)铝和盐溶液的反应。
写出下列反应方程式和对应的离子方程式:铝投入硫酸铜溶液中:化学反应方程式4243233()Al CuSO Cu Al SO +=+,离子反应方程式232332Al CuCu Al +++=+; (5)铝热剂的反应。
写出下列反应方程式:①铝粉和四氧化三铁粉末混合加热34238349Al Fe O Al O Fe ++高温;②铝粉和三氧化二铬粉末混合加热232322Al Cr O Al O Cr ++高温。


1.铝可以转化为铝离子、氧化铝、偏铝酸根,不能直接转化为Al(OH)3 4Al +3O2 ==2Al2O3 2Al +6HCL=2Al Cl3+3H22Al +3H2SO4=Al 2(SO4)3+3H2 2Al+2NaOH+H2O=2NaAlO2+3H2 2.氧化铝可以转化为铝离子、铝、偏铝酸根,不能直接转化为Al(OH)3Al2O3+6HCl=2AlCl3+3H2O ;Al2O3+2NaOH=2NaAlO2+H2O2Al2O3 =电解=4Al +3O23.铝离子可以转化为偏铝酸根、Al(OH)3,不能直接转化为氧化铝、铝AlCl3+3NaOH=Al(OH)3沉淀+3NaCl ;AlCl3+4NaOH=NaAlO2+2H2OAl2(SO4)3+6NH3.H2O=2Al(OH)3沉淀+3(NH4)2SO44.Al(OH)3可以转化为偏铝酸根、铝离子、氧化铝,不能直接转化为铝Al(OH)3 +NaOH==NaAlO2 +2H2O;Al(OH)3+3HCl=AlCl3+3H2O2Al(OH)3=(加热)=Al2O3+H2O5.偏铝酸根可以转化为Al(OH)3、铝离子,不能直接转化为铝、氧化铝NaAlO2+HCl+H2O=Al(OH)3沉淀+NaCl ;NaAlO2+4HCl=AlCl3+2H2O相关离子方程式:H+ + AIO2- + H2O == AI(OH)3 ==AI3+ + 3OH- (可逆平衡)加酸平衡右移,加碱平衡左移AI3+ + 3OH- = AI(OH)3AI3+ + 4OH- = AIO2- + 2H2OAI(OH)3 + OH- = AIO2- + 2H2OAI(OH)3 +3H+ = AI3+ + 3H2OAIO2- + 4H+ =AI3+ +2H2OAIO2- + H+ + H2O = AI(OH)31.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平,青铜(约6 000年前)、Fe(约2 500年前)、Al(约200年前)之所以有先后,主要取决于( )A.金属的导电性强弱B.金属在地壳中的含量多少C.金属的化合价高低D.金属的活动性强弱2.电解法冶炼铝时,冰晶石的作用是( )A.助熔剂B.催化剂C.还原剂D.氧化剂3.下列说法正确的是( )A.金属氧化物都能与水反应生成碱B.非金属氧化物都能与水反应生成酸C.氧化铝既能与酸反应又能与氨水反应D.氧化铝坩埚不能用于熔融烧碱4.已知4 g由氧化镁和另一种金属氧化物组成的混合物中含有氧元素1.8 g,则另一种金属氧化物是( )A.CuO B.CaO C.Fe2O3 D.Al2O3 5.下列物质中,既能溶于盐酸溶液又能溶于NaOH溶液的氧化物是( )A.MgO B.Al2O3 C.Fe2O3 D.Al(OH)36.下列各组反应中能得到Al(OH)3的是( )A.Al2O3加到热水中B.向NaAlO2溶液中加入过量盐酸C.将Na投入到NaAlO2溶液中D.在AlCl3溶液中滴几滴NaOH溶液7.向KAl(SO4)2溶液中滴加Ba(OH)2溶液,使SO2-4恰好完全沉淀,反应后铝元素的主要存在形式是( )A.Al3+B.Al(OH)3 C.AlO-2 D.Al3+和Al(OH)31.D2.A3.D [多数金属氧化物和非金属氧化物不溶于水,如CuO、Al2O3、CO等,Al2O3是两性氧化物,能与强酸和强碱反应。

课题1铝及其化合物的性质一、铝的性质及实验注意事项1.铝与氧气反应实验的注意事项(1)铝片要薄,使用前用细砂纸轻轻打磨掉氧化膜,可用香烟盒或纸制电容器上的铝箔。
(2)反应放出大量热,生成的固体温度较高,集气瓶瓶底盛有少量水或放入细沙,起隔热作用,防止集气瓶炸裂。
(3)铝箔不易直接点燃,火柴有引燃作用,也可改用镁条引燃。
(4)待火柴快要燃烧完时,将铝条伸入盛有氧气的集气瓶.若插入过早或直接将铝箔插入瓶底,会因火柴燃烧消耗较多的氧气或将部分氧气排出瓶外,使铝箔不能充分燃烧。
2.Al3+、Al(OH)3、Al(OH)错误!间的相互转化由于Al(OH)3具有两性,在不同情况下Al3+、Al(OH)3、Al(OH)错误!间能相互转化,其转化关系如下:此转化有许多重要应用如选择制备Al(OH)3的最佳途径,判断离子共存问题,用于物质的推断、检验,还经常涉及定量计算。
3.铝热反应的实验注意事项注意事项:①Fe2O3粉末与Al粉要选干燥的,Al粉要用未被氧化的,否则,反应难以进行.②Fe2O3与Al的物质的量之比要控制在1∶2,且二者要混合均匀,以保证Fe2O3与Al都完全反应。
③玻璃漏斗内的纸漏斗要厚一些(如四层纸),并要用水润湿,以防损伤玻璃漏斗。
④承接反应物的蒸发皿内要垫适量细沙,一是防止蒸发皿炸裂,二是防止熔融的固体溅出伤人。
⑤实验装置不要距离人群太近,或将实验在玻璃通风橱内操作,防止人体受伤。
【例1】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如下图所示。
反应中镁和铝的( )A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.反应速率之比为2∶3解析:由图像可知,两个反应中生成的氢气一样多,说明两种金属提供的电子数目一样多,则镁、铝的物质的量之比为3∶2,质量之比为4∶3,A项正确,B项错误。
镁、铝的摩尔质量之比为8∶9,C项错误。
由图像可知,镁、铝与硫酸反应需要的时间之比为2∶3,则二者的速率之比为3∶2,D项错误。

△ 点燃△ 铝 及 其 化 合 物一、铝的结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA 族镁原子核外有三个电子,在化学反应中,容易失去最外层的三个电子,显+3价。
二、铝单质的性质1、物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2、化学性质:〔1〕与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3思考:在金属活泼性顺序中铝排在铁的前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝外表,阻止了内部的铝与空气接触。
〔2〕与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3〔3〕与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3铝热剂[现象]:发出耀眼的光辉、放出大量的热、有熔融物生成。
[试一试]:写出Al 分别与MnO 2 、V 2O 5 的反应方程式〔4〕与沸水微弱反应:2Al+6H 2O ========= 2Al 〔OH 〕3 + 3H 2↑〔5〕与酸反应::2Al+6HCl ====== 2AlCl 3+H 2↑2Al+3H 2SO 4 ====== A l 2(SO 4)3+ 3H 2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在外表生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
〔6〕与碱反应:2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑ 反应的实质:分两步进行:(2〕Al(OH)3+NaOH ======== NaAlO 2+2H 2O化合价降低,被复原,得6e —〔1〕化合价升高,被氧化,失6e —+4H 2O—得6×e—三、铝的重要化合物1、氧化铝〔Al2O3〕(1)物理性质:白色固体、熔点高〔2054℃〕 、不溶于水,不与水化合。
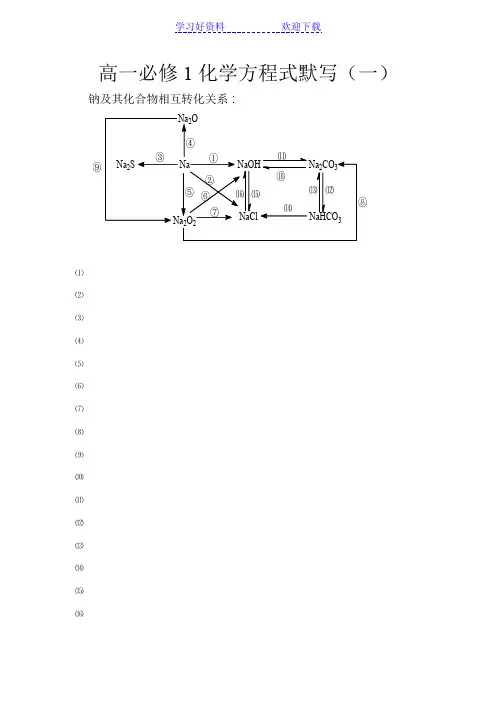
钠及其化合物相互转化关系:⑨⑴⑵⑶⑷⑸⑹⑺⑻⑼⑽⑾⑿⒀⒁⒂⒃铝及其化合物相互转化关系:写出①-⑬步转化的离子方程式(③④⑦写化学反应方程式)。
①。
②。
③。
④。
⑤。
⑥。
⑦。
⑧。
⑨。
⑩。
⑪。
⑫。
⑬。
⑬铁及其化合物相互转化关系:写出①-⑩步转化的离子方程式(①⑤⑧写化学反应方程式)。
①。
②。
③。
④。
⑤。
⑥。
⑦。
⑧。
⑨。
⑩。
硅及其化合物相互转化关系:写出①-⑨步转化的化学方程式(⑥⑦写离子方程式)。
①。
②。
③。
④。
⑤。
⑥。
⑦。
⑧。
⑨。
Na2SiO3SiF4Si SiO2H2SiO3CaSiO3①②③④⑤⑥⑦⑧⑨氯及其化合物相互转化关系:写出①-⑩步转化的化学方程式(其中③⑤⑧⑩写离子方程式)。
①。
②。
③。
④。
⑤。
⑥。
⑦。
⑧。
⑨。
⑩。
CuCl2HClOHCl Cl2FeCl3NaClOCa(ClO)2①②③④⑤⑥⑦⑧⑨⑩硫及其化合物相互转化关系:写出①-⑩步转化的化学方程式。
①。
②。
③。
④。
⑤。
⑥。
⑦。
⑧。
⑨。
⑩。
①S SO②氮及其化合物相互转化关系:写出①-⑩步转化的化学方程式。
①。
②。
③。
④。
⑤。
⑥。
⑦。
⑧。
⑨。
⑩。
①⑨ ⑧⑦⑥ ④ N 2 NH 3 NH 4ClNO NO 3② ③。

铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。


铝及其化合物【学习目标】1.铝及其化合物的性质及用途2.铝三角及图像问题3.铝热反应◆感知高考1. [2020·江苏]下列有关物质的性质与用途具有对应关系的是A. 铝的金属活泼性强,可用于制作铝金属制品B. 氧化铝熔点高,可用作电解冶炼铝的原料C. 氢氧化铝受热分解,可用于中和过多的胃酸D. 明矾溶于水并水解形成胶体,可用于净水【答案】D【解析】A.铝在空气中可以与氧气反应生成致密氧化铝,致密氧化铝包覆在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A错误;B.氧化铝为离子化合物,可用作电解冶炼铝的原料,B错误;C.氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C错误;D.明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,用于净水,D正确;故选D。
2.[2020·浙江1月选考,12]下列关于铝及其化合物说法,不正确的是()A. 明矾可用作净水剂和消毒剂B. 利用铝热反应可冶炼高熔点金属C. 铝可用作包装材料和建筑材料D. 氢氧化铝可用作治疗胃酸过多的药物【答案】A【解析】A.明矾溶于水可生成具有吸附性的氢氧化铝胶体,可以净水但不能消毒,故A错误;B.铝热反应是金属铝和沸点较高的金属氧化物之间反应冶炼高熔点金属的过程,故B正确。
C.铝具有良好的延展性,铝箔可以做包装材料,铝合金硬度大密度小常用做建筑材料,故C正确;D.胃酸主要成分为HCl,氢氧化铝具有弱碱性可中和过多胃酸,故D正确;故答案为A。
◆核心知识1.铝的结构和存在铝位于元素周期表,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
【答案】第3周期ⅢA族,。
2.金属铝及其化合物的化学性质(1)转化关系①理清知识主线Al→Al2O3←Al(OH)3→⎩⎪⎨⎪⎧NaAlO2AlCl3Al2(SO4)3KAl(SO4)2·12H2O②形成网络构建(2)重要反应方程式(用方程式回答下列问题)①用化学方程式表示除去铁粉中的铝粉。
铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。
人教版高中化学必修一第三章篇一:【人教版】高中化学必修1知识点总结:第三章金属及其化合物第三章金属及其化合物三、金属化合物的性质: 1、氧化物2、氢氧化物3、盐四、金属及其化合物之间的相互转化 1、铝及其重要化合物之间的转化关系。
2、铁及其重要化合物之间的转化关系。
3、钠及其化合物之间的相互转化。
附:1、焰色反应:用于在火焰上呈现特殊颜色的金属或它们的化合物的检验。
注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
2、碳酸钠、碳酸氢钠:Na2CO3又叫纯碱,俗称苏打。
无水碳酸钠是白色粉末。
NaHCO3俗称小苏打,也叫酸式碳酸钠。
它是白色粉末,在水中的溶解度比碳酸钠略小,水溶液呈微碱性,固体碳酸氢钠受热即分解。
NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
将碳酸钠溶液或结晶碳酸钠吸收CO2可制得碳酸氢钠。
3、氧化铝、氢氧化铝(1)Al2O3俗名矾土,是一种难熔又不溶于水的白色粉末。
它的熔点、沸点都高于2000度。
(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。
氢氧化铝可用来制备铝盐,作吸附剂等的原料。
氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
10、合金:第四章非金属及其化合物课标要求1.了解氯、氮、硫、硅等非金属及其重要化合物的主要性质2.认识其在生产中的应用和对生态环境的影响。
要点精讲一、本章知识结构框架二、本章知识结构梳理(一)硅及其化合物 1、二氧化硅和二氧化碳比较篇二:化学必修1第三章知识点总结第三章金属及其化合物知识点总结及方程式1.金属钠(1)是一种的固体.它的,钠很,,(2)在自然界中以化合态存在2.钠放置在空气中先,再变是因为氧化3反应,过氧化 4盖风化是化学变化区别碳酸钠与碳酸氢钠可用1. 与CaCl2反应有无沉淀2.与酸反应剧烈程度3碱性强弱4稳定性2. 碳酸钠与盐酸互滴时中刚开始无现象,后有气泡3除杂: Na2CO3固体(NaHCO3)加热; Na2CO3溶液(NaHCO3)适量NaOHNaHCO3溶液(Na2CO3)足量CO21.Al和OH互滴现象不同:OH滴到Al中先沉淀后澄清;Al3+到OH-中先澄清后沉淀---Al3++3 OH=Al(OH)3 ↓Al(OH)3 + OH = AlO2 +2 H2O3+--3+Al3++4OH-= AlO2-+2 H2O2. NaAlO2 和盐酸-互滴现象不同:盐酸滴到NaAlO2中先沉淀后澄清; NaAlO2 滴到盐酸中先澄清后沉淀AlO2-+H++H2O=Al(OH)3 ↓Al(OH)3 + 3H+= Al3++3H2O.AlO2-+4H+ = Al3++ 2H2O 2.实验室制取Al(OH)3碱须用氨水3.铝,氧化铝,氢氧化铝与碱反应,碱必须是强碱4.明矾的化学式KAl(SO4)2·12 H2O,可做净水剂原因是Al3++ 3 H2O = Al(OH)3(胶体)+ 3H+ 5.焰色反应:是元素的性质,是物理变化;钠的焰色是黄色,钾的焰色是紫色(透过蓝色钴玻璃)实验中用盐酸洗铂丝;实验步骤:烧,蘸,烧,洗1制备Fe(OH)2注意:亚铁盐溶液必须新制,保证无氧氛围2铁盐可做净水剂原因是Fe3与水反应形成Fe(OH)胶体:Fe3++ 3 H2O = Fe(OH)3(胶体)+ 3H+ 3.合金的硬度一般高于各成分金属,熔点一般低于各成分金属;铁合金可分为生铁和钢第三章化学反应归纳 1、钠在空气中燃烧 2Na + O2Na2O2 钠块在空气中变暗 4Na+O2=2Na2O2、2Na + 2H2O = 2 NaOH +H2 ↑2Na + 2H2O = 2Na++ 2OH-+H2 ↑3、2Na2O2 + 2H2O = 4NaOH +O2 ↑ 2Na2O2 + 2H2O = 4Na++4OH -+O2↑Na2O+H2O=2NaOH4、2Na2O2 + 2CO2 = 2Na2CO3 + O25、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液 Na2CO3+2HCl = 2NaCl +H2O+CO2↑CO32-+2H+= H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3 + HCl =NaHCO3 + NaClCO32-+ H+= HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+= H2O +CO2↑ 6、2NaHCO3△Na2CO3 + H2O +CO2 ↑7、NaHCO3 + NaOH = Na2CO3 + H2O HCO3-+ OH -=H2O + CO32- 8.Na2CO3+H2O+CO2 = 2NaHCO39.2NaHCO3+Ca(OH)23 + 2H2O+Na2CO3NaHCO3+Ca(OH)23+H2O+NaOH10.2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑ 1、铝箔在氧气中剧烈燃烧 4Al + 3O2点燃2Al2O32. 2Al + 6HCl = 2AlCl3 +3H2↑ 2Al +6H+=2Al3++3H2↑3. 2Al+2NaOH +2H2O = 2NaAlO2 +3H2↑2Al + 2OH -+2H2O = 2AlO2-+3H2↑4. Al2O3 + 2NaOH2NaAlO2 +H2OAl2O3 + 2OH -= 2AlO2-+ H2O5.Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4 Al3++ 3 NH3·H2O =Al(OH)3↓+ 3NH4+6.Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+= Al3++ 3H2O 7.Al(OH)3 + NaOHNaAlO2 +2 H2O Al(OH)3 + OH-= AlO2-+2 H2O8 2Al(OH)32O3+3H2O++9.Al3 + 3 H2O = Al(OH)3(胶体)+ 3H11.Al3++3 OH-=Al(OH)3 ↓ Al(OH)3 + OH-= AlO2-+2 H2OAl3++4OH-= AlO2-+2 H2O12.AlO2-+H++H2O=Al(OH)3 ↓Al(OH)3 + 3H+= Al3++3H2O.AlO2-+4H+ = Al3++ 2H2O 13.2AlO2-+CO2+3H2O=2 Al(OH)3+ CO32-1. 高温下铁与水反应3Fe + 4H2O(g)高温Fe3O4 + 4H22. 铁与盐酸反应 Fe + 2HCl = FeCl2 +H2↑ Fe + 2H+= Fe2++H2↑3. 氧化铁溶于盐酸中Fe2O3 + 6HCl =2FeCl3 + 3H2OFe2O3 + 6H+= 2Fe3++ 3H2O 4.Fe3O4+8H+=Fe2++2Fe3++4H2O5.Fe2O3+3CO=2Fe+3CO26.FeCl3 + 3NaOH =Fe(OH)3 ↓+3NaClFe3++ 3OH -= Fe(OH)3 ↓ 7.FeCl2 + 2NaOH =Fe(OH)2 ↓+2NaClFe2++ 2OH -=Fe(OH)2 ↓ 8. 氢氧化亚铁在空气中被氧化4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)39.Fe(OH)2+2HCl=FeCl2+2H2O 10.Fe(OH)3+3HCl=FeCl3+3H2O11. 氯化亚铁溶液中通入氯气 2FeCl2 + Cl2 = 2FeCl3 12. 氯化铁溶液中加入铁粉 2FeCl3 + Fe = 3FeCl213.2Fe3++ Cu= 2Fe2++ Cu2+14.3SCN- + Fe3+=Fe(SCN)32 Fe2++ Cl2 = 2 Fe3++ 2Cl- 2Fe3++ Fe =3Fe2+篇三:【人教版】高中化学必修1知识点总结:第三章金属及其化合物第三章金属及其化合物课标要求1. 了解钠、铝、铁、铜与氧气、水、盐酸、氢氧化钠溶液的反应情况,了解金属共性,掌握个性。