第8课时 系统归纳——四大平衡常数的相互关系及运算
- 格式:ppt
- 大小:2.23 MB
- 文档页数:32

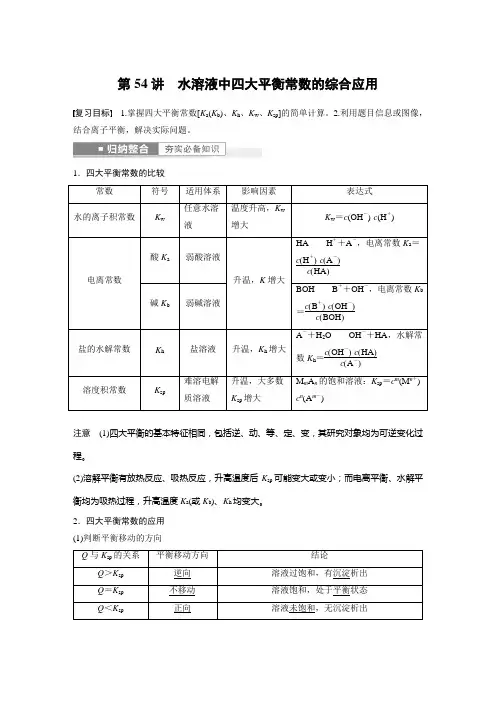
第54讲水溶液中四大平衡常数的综合应用复习目标 1.掌握四大平衡常数[K a(K b)、K h、K w、K sp]的简单计算。
2.利用题目信息或图像,结合离子平衡,解决实际问题。
1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K w 任意水溶液温度升高,K w增大K w=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp 难溶电解质溶液升温,大多数K sp增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)注意(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a(或K b)、K h均变大。
2.四大平衡常数的应用(1)判断平衡移动的方向Q与K sp的关系平衡移动方向结论Q>K sp逆向溶液过饱和,有沉淀析出Q=K sp不移动溶液饱和,处于平衡状态Q<K sp正向溶液未饱和,无沉淀析出(2)常数间的关系 ①强碱弱酸盐:K h =K w K a ;②强酸弱碱盐:K h =K wK b。
(3)判断离子浓度比值的大小变化。
如将NH 3·H 2O 溶液加水稀释,c (OH -)减小,由于电离平衡常数为c (NH +4)·c (OH -)c (NH 3·H 2O ),此值不变,故c (NH +4)c (NH 3·H 2O )的值增大。

高考热点—四大平衡常数自从新课程引人平衡常数以后,化学平衡常数、电离平衡常数、溶度积常数以及水的离子积常数等四大平衡常数就成为高考的热点,倍受命题者的青睐.一、化学平衡常数1.概念:对于一定温度下的可逆反应,无论反应物的起始浓度如何,反应达平衡状态后,生成物浓度的幂之积与反应物浓度幂之积的比值是一个常数,这个常数即该反应的化学平衡常数.用符号K表示. 2.书写: (l)同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数. (2)稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中. (3)非水溶液中的反应,如有水生成或有水参加反应,此时水的浓度不可视为常数,必须表示在平衡关系式中. (的若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商). 3.注意点(l)化学平衡常数K只与温度有关;固体或纯液体的浓度看作“1”,不代人公式. (2)化学平衡常数表示可逆反应进行的程度.K值越大,表示反应进行得越完全;K值越小,表示反应进行得越不完全. (3)反应的平衡常数是指某一指定的反应,若反应方向改变,则K改变.若反...... (专题8·化学平衡常数解题策略化学平衡常数与化学平衡及其影响因素的关系是高考命题的趋势之一。
化学平衡常数的引入,对判断化学平衡移动方向带来了科学的依据。
平衡常数是表征反应限度的一个确定的定量关系,是反应限度的最根本的表现。
平衡常数的使用,从定量的角度解决了平衡的移动。
一、化学平衡常数在一定温度下,可逆反应无论从正反应开始还是从逆反应开始,无论反应混合物的起始浓度是多少,当反应达到平衡状态时,正反应速率等于逆反应速率,反应混合物中各组成成分的含量保持不变,即各物质的浓度保持不变。
生成物浓度的幂次方乘积与反应物浓度的幂次方乘积之比是常数,这个常数叫化学平衡常数,用K表示。
化学平衡常数的计算公式为:对于可逆反应:mA(g)+nB(g)pC(g)+qD(g)二、化学平衡常数意义1、化学平衡常数K表示可逆反应进行的程度。



水溶液中的离子平衡——难溶电解质的溶解平衡知识点一沉淀溶解平衡及其影响因素1.沉淀溶解平衡的含义在一定温度下的水溶液中,当沉淀溶解和生成的速率相等时,即建立了沉淀溶解平衡状态。
2.沉淀溶解平衡的建立固体溶质溶解沉淀溶液中的溶质⎩⎨⎧v溶解>v沉淀,固体溶解v溶解=v沉淀,溶解平衡v溶解<v沉淀,析出晶体3.沉淀溶解平衡的特点4.影响沉淀溶解平衡的因素(1)内因:难溶电解质本身的性质,这是决定因素。
(2)外因:以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例【即时巩固】1.判断正误(正确的打“√”,错误的打“×”)。
(1)沉淀达到溶解平衡时,溶液中溶质离子浓度一定相等,且保持不变(×)(2)AgCl(s)Ag+(aq)+Cl-(aq)表示AgCl的电离平衡(×)(3)升高温度,沉淀溶解平衡一定正向移动(×)(4)碳酸钙在水中的溶解度比在氯化钙溶液中的溶解度大(√)(5)难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动(×)(6)根据AgCl(s)Ag+(aq)+Cl-(aq),CH3COOH CH3COO-+H+,可以判断AgCl、CH3COOH均为弱电解质(×)(7)为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀(√)2.有关AgCl沉淀的溶解平衡的说法中,不正确的是( )A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等B.AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl沉淀的溶解度增大D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低解析:选B 沉淀溶解平衡的实质是v(沉淀)=v(溶解)≠0,A对。
AgCl(s)Ag+(aq)+Cl-(aq)是动态平衡,B错。
溶解过程吸热,C对。
加入NaCl固体,c(Cl-)增大,AgCl溶解平衡左移,D对。




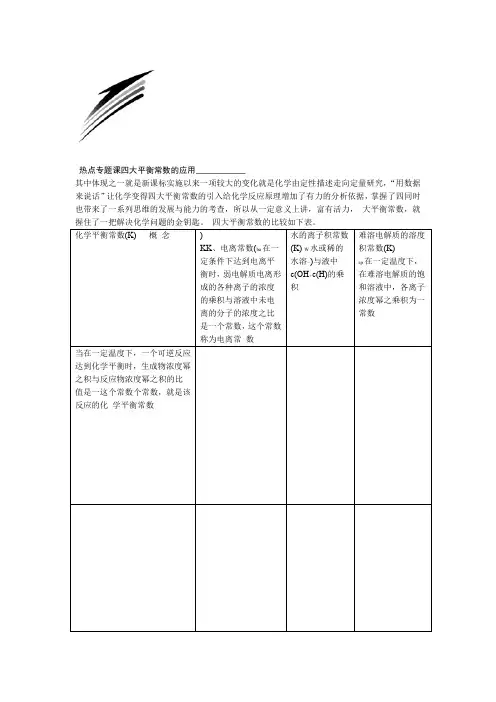
热点专题课四大平衡常数的应用其中体现之一就是新课标实施以来一项较大的变化就是化学由定性描述走向定量研究,“用数据来说话”让化学变得四大平衡常数的引入给化学反应原理增加了有力的分析依据,掌握了四同时也带来了一系列思维的发展与能力的考查,所以从一定意义上讲,富有活力,大平衡常数,就握住了一把解决化学问题的金钥匙。
四大平衡常数的比较如下表。
:(1)HA对于一元弱酸对于一般的可逆+-,电+AHAH+:mA(g)反应离常数K=a的饱和溶AMC(g)pnB(g)nm+-??AH?·cc?表?HAc?液:=Kc(OH ,在一定D(g)+q W达mn+-)(H碱)·c元(2)对于一弱K=c(M温度下达到平衡sp式nm-++)(ABBOH:BOH+c)·=时:K-OH,电离常数K=qp?D?c?C?·c b nm??A?·?Bcc+-??OHcc?B?·??BOHc解质难溶电与只与温度有关,只升温,只与温度有关,影响因素只与温度有关温质的性K温度升高,和度有W K值增大增大关21Fe(s)+CO(g)。
已知O1]高炉炼铁过程中发生的主要反应为Fe(s)+CO(g)[例22333 该反应在不同温度下的平衡常数如下:温度/℃1 300 1 150 1 000平衡常数3.53.74.0请回答下列问题:或“=”);,ΔH________0(填“>”“<”________(1)该反应的平衡常数表达式K=,COO、、CO各1.0 mol℃时加入(2)在一个容积为10 L的密闭容器中,1 000Fe、Fe232CO(CO)=,________10 min反应经过后达到平衡。
求该时间范围内反应的平均反应速率v2;的平衡转化率=________ 的平衡转化率,可采取的措施是________。
欲提高(3)(2)中CO A.减少Fe的量B.增加FeO的量32 C.移出部分CO D .提高反应温度2E.减小容器的容积F.加入合适的催化剂c?CO?2[解析](1)因Fe和FeO都为固体,不能代入平衡常数的表达式,所以K=,由32c?CO?表中数据知,升高温度,平衡常数减小,说明平衡向左移动,故ΔH<0。
专题三十九四大平衡常数的专题K a/K b/K W、K h、k sp【2018年高考考纲解读】了解四大平衡常数【重点、难点剖析】一、四大平衡常数的比较对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),在一定温度下达到平衡时:K=c p(C)·c q(D)c m(A)·c n(B)以一元弱酸HA为例:HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)二、高考题型示例【变式训练1】(2018全国III卷)用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是()A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到aD.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动【解析】A.选取横坐标为50mL的点,此时向50mL 0.05mol/L的Cl-溶液中,加入了50mL 0.1mol/L的AgNO3溶液,所以计算出此时溶液中过量的Ag+浓度为0.025mol/L(按照银离子和氯离子1:1沉淀,同时不要忘记溶液体积变为原来2倍),由图示得到此时Cl-约为1×10-8mol/L(实际稍小),所以K SP(AgCl)约为0.025×10-8=2.5×10-10,所以其数量级为10-10,选项A正确。
B.由于K SP(AgCl)极小,所以向溶液滴加硝酸银就会有沉淀析出,溶液一直是氯化银的饱和溶液,所以c(Ag+)·c(Cl-)=K SP(AgCl),选项B正确。
C.滴定的过程是用硝酸银滴定氯离子,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL 0.05mol/L的Cl-溶液改为50mL 0.04mol/L的Cl-溶液,此时溶液中的氯离子的物质的量是原来的0.8倍,所以滴定终点需要加入的硝酸银的量也是原来的0.8倍,因此应该由c点的25mL变为25×0.8=20mL,而a点对应的是15mL,选项C错误。
四大高考化学平衡常数的相互关系与运算电解质溶液中的电离常数、水的离子积常数、水解常数及溶度积常数是在化学平衡常数基础上的延深和拓展,它是定量研究平衡移动的重要手段。
在复习时就要以化学平衡原理为指导,以判断平衡移动的方向为线索,以勒夏特列原理和相关守恒定律为计算依据,以各平衡常数之间的联系为突破口,联系元素及化合物知识,串点成线,结线成网,形成完整的认识结构体系.1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K W任意水溶液温度升高,K W增大K W=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h值增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp 难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数间的关系(1)CH3COONa、CH3COOH溶液中,K a、K h、K W的关系是K W=K a·K h。
(2)NH4Cl、NH3·H2O溶液中,K b、K h、K W的关系是K W=K b·K h。
(3)M(OH)n悬浊液中K sp、K W、pH间的关系是K sp=c(M n+)·c n(OH-)=c(OH-)n·cn(OH-)=c n+1(OH-)n=1n⎝⎛⎭⎫K W10-pHn+1。
3.四大平衡常数的应用(1)判断平衡移动方向Q c与K的关系平衡移动方向溶解平衡Q c>K逆向沉淀生成Q c=K不移动饱和溶液Q c<K正向不饱和溶液(2)判断离子浓度比值的大小变化如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离常数为c(NH+4)·c(OH-)c(NH3·H2O),此值不变,故c(NH+4)c(NH3·H2O)的值增大。
常考专题讲座(九) 四大平衡常数的应用四大平衡常数是指化学平衡常数、弱电解质的电离平衡常数、水的离子积常数及难溶电解质的溶度积常数,这部分知识为新课标中的新增内容,在高考题中频繁出现,特别是化学平衡常数及溶在25 ℃下,将a mol ·L -1的氨水与0.01 mol·L -1的盐酸等体积混合,反应平衡时溶液中c (NH +4)=c (Cl -),则溶液显______性(填“酸”、“碱”或“中”);用含a 的代数式表示NH 3·H 2O 的电离常数K b =________。
[解析] 所发生反应的化学方程式为NH 3·H 2O +HCl===NH 4Cl +H 2O ,由电荷守恒可知:c (NH +4)+c (H +)=c (Cl -)+c (OH -),因为c (NH +4)=c (Cl -),所以c (OH -)=c (H +),故溶液显中性。
K b =c (NH +4)·c (OH -)c (NH 3·H 2O ),c (NH +4)=c (Cl -)=0.005 mol·L -1,c (OH -)=c (H +)=10-7 mol ·L -1。
c (NH 3·H 2O)=a 2-c (NH +4)=(a 2-0.005)mol·L -1。
所以,K b =0.005×10-7a 2-0.005=10-9a -0.01。
[答案] 中 10-9a -0.01 工业废水中常含有一定量的Cr 2O 2-7和CrO 2-4,它们会对人类及生态系统产生很大损害,必须进行处理。
常用的处理方法有还原沉淀法。
该法的工艺流程如下: CrO 2-4――→H +①转化Cr 2O 2-7――→Fe 2+②还原Cr 3+――→OH -③沉淀Cr(OH)3↓其中第①步存在平衡:2CrO 2-4(黄色)+2H +Cr 2O 2-7(橙色)+H 2O 。