四大平衡常数的相互关系及运算.pdf
- 格式:pdf
- 大小:4.17 MB
- 文档页数:29

无机化学中四大平衡相互影响的问题探讨无机化学中的四大平衡相互影响一直是化学领域研究的重要课题。
这四大平衡包括了溶解平衡、配位化学平衡、氧化还原平衡和放射化学平衡。
它们之间相互影响,相互制约,共同构成了无机化学体系的平衡网络。
本文将从这四大平衡的相互影响出发,探讨它们之间的关系以及在实际应用中的重要意义。
我们来了解一下这四大平衡的基本概念。
溶解平衡是指当某种物质溶解时,其分子或者离子与溶剂之间的相互作用所导致的动态平衡。
在溶解过程中,溶质的溶解度是一个很重要的参数,它受溶液中其他物质浓度、温度等因素的影响。
配位化学平衡是指配合物(也称配合物离子)的形成与分解反应,通常包括了络合离子的形成常数和络合物的稳定性常数等参数。
氧化还原平衡是指涉及到电子转移的化学反应。
在这种反应中,一个物质被氧化,同时另一个物质被还原。
氧化还原反应的平衡常数可以通过电动势或者标准氧化还原电位来进行定量描述。
放射化学平衡是指放射性核素的衰变反应。
放射性核素具有一定的衰变速率,它们的衰变反应也有平衡定律,可以通过半衰期来进行描述。
这四大平衡在无机化学中起着至关重要的作用,它们之间的相互影响也是无机化学研究的一个重要课题。
首先来看溶解平衡和配位化学平衡之间的相互关系。
实际上,溶解平衡和配位化学平衡之间存在着密切的联系。
溶解平衡中的配位化学过程对溶解度的影响是非常显著的。
以金属离子配位化学为例,金属离子在水中溶解时,往往会形成水合离子,而这些水合离子又会与配体形成络合物。
这种络合物的形成会影响金属离子的溶解度,从而影响溶解平衡。
配位化学过程中,配合物的稳定性也受到了溶液中其他物质的影响,例如存在其他金属离子、配体或者其它配位物等都会影响络合物的形成和分解反应,进而影响配位化学平衡的达到。
溶解平衡和配位化学平衡之间存在着相互影响,它们共同决定了一种物质在溶液中的化学行为。
接下来,我们看一看氧化还原平衡和放射化学平衡之间的相互影响。
氧化还原平衡和放射化学平衡之间的联系主要体现在两个方面,一是在氧化还原反应中,电子的转移往往受到溶液中其他物质的影响,有些物质可以促进还原反应的进行,有些物质则会抑制还原反应的发生。
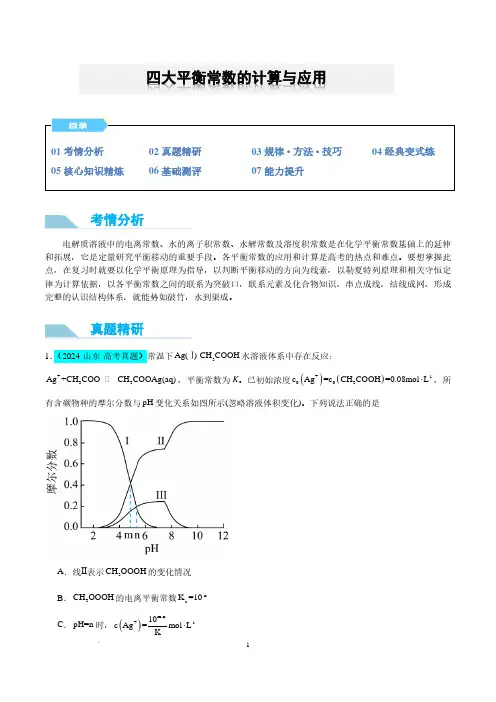
四大平衡常数的计算与应用考情分析真题精研D .pH=10时,()()+-13c Ag+c CH COOAg =0.08mol L⋅2.(2024·安徽·高考真题)环境保护工程师研究利用2Na S 、FeS 和2H S 处理水样中的2+Cd 。
已知25℃时,2H S 饱和溶液浓度约为-10.1mol L ⋅,()-6.97a12K H S =10,()-12.90a22K H S =10,-17.20sp K (FeS)=10,-26.10sp K (CdS)=10。
下列说法错误的是A .2Na S 溶液中:()()()()()+--2-c H+c Na =c OH +c HS +2c S +B .-120.01mol L Na S ⋅溶液中:()()()()+2---c Na >c S >c OH >c HSC .向()2+-1c Cd=0.01mol L⋅的溶液中加入FeS ,可使()2+-8-1c Cd <10mol L ⋅D .向()2+-1c Cd=0.01mol L⋅的溶液中通入2H S 气体至饱和,所得溶液中:()()+2+c H >c Cd注意:(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp 可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a (或K b )、K h 均变大。
规律·方法·技巧A .pH=6.5时,溶液中()()2-2+3c CO <c PbB .()()2+3δPb=δPbCO 时,()2+c Pb <1.010×()-1M lg c /mol L ⋅(M 代表+Ag 、-Cl 或2-4CrO )随加入NaCl 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
下列叙述正确的是经典变式练核心知识精炼(1)A、C、B三点均为中性增大(2)D点为酸性溶液,E点为碱性溶液(1)a、c点在曲线上,a→c Na2SO4固体,但K sp不变基础测评1.(2024·陕西商洛·模拟预测)室温下,用-10.1mol L ⋅的二甲胺()32CH NH 溶液(二甲胺在水中的电离与一水合氨相似)滴定-110.00mL0.1mol L ⋅盐酸溶液。

化学反应的平衡常数表在化学领域中,平衡常数是衡量一个化学反应在平衡状态下的反应程度的重要指标。
它表示了在给定温度和压力下,反应物与生成物的浓度之间的比例关系。
平衡常数的值越大,说明反应向生成物的方向偏移得越明显,反之亦然。
下面是几个常见化学反应的平衡常数表(单位为摩尔分数):1. 水的离解平衡H2O ⇌ H+ + OH-平衡常数:Kw = [H+][OH-]在25°C下,Kw的值约为1.0 x 10^-142. 一元一次反应A ⇌ B平衡常数:K = [B]/[A]3. 一元二次反应A ⇌B + C平衡常数:K = [B][C]/[A]4. 二元一次反应A +B ⇌ C平衡常数:K = [C]/[A][B]5. 二元二次反应A +B ⇌C + D平衡常数:K = [C][D]/[A][B]6. 反应系列A ⇌B ⇌ C平衡常数:K = [B]/[A] 和 K' = [C]/[B]总平衡常数:Koverall = K * K' = [C]/[A]7. 气体反应(在一定温度和压力下)aA + bB ⇌ cC + dD平衡常数:K = (pC^c * pD^d) / (pA^a * pB^b) (p为分压)或 K = (C^c * D^d) / (A^a * B^b) (C、D、A、B为浓度)需要注意的是,平衡常数的值与温度密切相关。
随着温度的变化,平衡常数的值也会发生变化。
温度升高时,平衡常数通常会增大;温度降低时,平衡常数通常会减小。
这个关系由热力学基本原理所决定。
综上所述,平衡常数是描述化学反应平衡状态下反应物与生成物浓度关系的重要指标。
通过了解平衡常数的概念和计算方法,我们可以更好地理解化学反应的动力学和平衡特性,为实验设计和工业生产提供指导。
高中化学四大平衡常数的相互关系及判定杨小过电解质溶液中的电离常数、水的离子积常数、水解常数及溶度积常数是在化学平衡常数基础上的延深和拓展,它是定量研究平衡移动的重要手段。
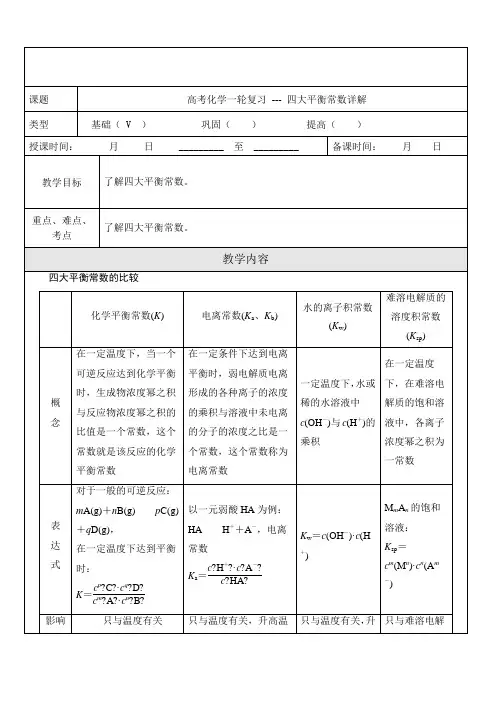
在复习时就要以化学平衡原理为指导,以判断平衡移动的方向为线索,以勒夏特列原理和相关守恒定律为计算依据,以各平衡常数之间的联系为突破口,联系元素及化合物知识,串点成线,结线成网,形成完整的认识结构体系.1.四大平衡常数的比较HA H++A-,电离常数K a=c(H+)·c(A-) c(HA)BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)M A的饱和溶液:K2.四大平衡常数间的关系(1)CH3COONa、CH3COOH溶液中,K a、K h、K W的关系是K W=K a·K h。
(2)NH4Cl、NH3·H2O溶液中,K b、K h、K W的关系是K W=K b·K h。
(3)M(OH)n悬浊液中K sp、K W、pH间的关系是K sp=c(M n+)·c n(OH-)=c(OH-)n·cn(OH-)=c n+1(OH-)n=1n⎝⎛⎭⎫K W10-pH n+1。
3.四大平衡常数的应用 (1)判断平衡移动方向(2)如将NH 3·H 2O 溶液加水稀释,c (OH -)减小,由于电离常数为c (NH +4)·c (OH -)c (NH 3·H 2O ),此值不变,故c (NH +4)c (NH 3·H 2O )的值增大。
(3)利用K sp 计算沉淀转化时的平衡常数 如:AgCl +I-AgI +Cl -[已知:K sp (AgCl)=1.8×10-10、K sp (AgI)=8.5×10-17]反应的平衡常数K =c (Cl -)c (I -)=c (Ag +)·c (Cl -)c (Ag +)·c (I -)=K sp (AgCl )K sp (AgI )=1.8×10-108.5×10-17≈2.12×106。



对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),在一定温度下达到平衡时:K=c p?C?·c q?D?c m?A?·c n?B?以一元弱酸HA为例:HA H++A-,电离常数K a=c?H+?·c?A-?c?HA?因素度,K值增大高温度,K w增大质的性质和温度有关考点一化学平衡常数常考题型1.求解平衡常数;2.由平衡常数计算初始(或平衡)浓度;3.计算转化率(或产率);4.应用平衡常数K判断平衡移动的方向(或放热、吸热等情况)。
对策从基础的地方入手,如速率计算、“三阶段式”的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力。
1.高炉炼铁过程中发生的主要反应为13Fe2O3(s)+CO(g)23Fe(s)+CO2(g)。
已知该反应在不同温度下的平衡常数如下:温度/℃ 1 000 1 150 1 300平衡常数 4.0 3.7 3.5请回答下列问题:(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”“<”或“=”);(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。
求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率=________。
2.已知可逆反应:M(g)+N(g)P(g)+Q(g)ΔH>0,请回答下列问题:(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L;达到平衡后,M的转化率为60%,此时N的转化率为________。
(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”)。


四大平衡常数mBn不同的物质之间,Ksp不能直接比较溶解度大小。
2)一般情况下,温度升高,物质的溶解度增大,但也有特殊情况,如CaSO4AgCl等物质在温度升高时溶解度减小。
突破点10:四大平衡常数提炼1:水的离子积常数1.水的离子积常数是指在25℃下,纯水中H2O分子自发地分解成H和OH离子的程度。
其数值为1.0×10142.Kw只适用于纯水和稀电解质(如酸、碱、盐)水溶液。
在恒温条件下,Kw保持不变。
当温度升高时,水的电离程度增大(因为电离一般吸热),因此Kw也会增大。
提炼2:电离平衡常数(KaKb1.电离平衡常数是指弱酸(HA)或弱碱(BOH)在水中发生电离反应时,反应物和生成物之间的浓度比值。
对于HA 来说,电离平衡常数为Ka对于___来说,电离平衡常数为Kb2.在相同温度下,K值越小表明电离程度越小,对应酸的酸性或碱的碱性越弱。
3.同一电解质,K值只与温度有关。
一般情况下,温度越高,K值越大。
对于多元弱酸来说,其Ka1___2___3提炼3:水解平衡常数(Kh1.水解平衡常数是指酸、碱、盐水溶液中某些离子与水分子发生水解反应时,反应物和生成物之间的浓度比值。
对于弱酸HA和弱碱BOH来说,它们的水解平衡常数分别为K a和Kb2.Kh值的大小由离子的水解能力和温度共同决定。
在温度不变的情况下,离子的水解能力越强,Kh值越大。
随着温度升高,Kh值也会增大。
对于多元弱酸阴离子或多元弱碱阳离子来说,其Kh1___2___3提炼4:溶度积常数(Ksp1.溶度积常数Ksp是指电解质在饱和溶液中,其离解产生的离子浓度之积。
对于组成为AmBn的电解质,其饱和溶液中存在平衡AmBns)nBm-(aq),Kspcm(An+)·cn(Bm-)。
2.Ksp只与温度有关。
一般情况下,随着温度升高,K sp也会增大。
3.当溶液中的离子浓度乘积Qc大于Ksp时,溶液过饱和,会有沉淀析出,直至溶液饱和。
水溶液中的离子平衡——难溶电解质的溶解平衡知识点一沉淀溶解平衡及其影响因素1.沉淀溶解平衡的含义在一定温度下的水溶液中,当沉淀溶解和生成的速率相等时,即建立了沉淀溶解平衡状态。
2.沉淀溶解平衡的建立固体溶质溶解沉淀溶液中的溶质⎩⎨⎧v溶解>v沉淀,固体溶解v溶解=v沉淀,溶解平衡v溶解<v沉淀,析出晶体3.沉淀溶解平衡的特点4.影响沉淀溶解平衡的因素(1)内因:难溶电解质本身的性质,这是决定因素。
(2)外因:以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例【即时巩固】1.判断正误(正确的打“√”,错误的打“×”)。
(1)沉淀达到溶解平衡时,溶液中溶质离子浓度一定相等,且保持不变(×)(2)AgCl(s)Ag+(aq)+Cl-(aq)表示AgCl的电离平衡(×)(3)升高温度,沉淀溶解平衡一定正向移动(×)(4)碳酸钙在水中的溶解度比在氯化钙溶液中的溶解度大(√)(5)难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动(×)(6)根据AgCl(s)Ag+(aq)+Cl-(aq),CH3COOH CH3COO-+H+,可以判断AgCl、CH3COOH均为弱电解质(×)(7)为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀(√)2.有关AgCl沉淀的溶解平衡的说法中,不正确的是( )A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等B.AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl沉淀的溶解度增大D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低解析:选B 沉淀溶解平衡的实质是v(沉淀)=v(溶解)≠0,A对。
AgCl(s)Ag+(aq)+Cl-(aq)是动态平衡,B错。
溶解过程吸热,C对。
加入NaCl固体,c(Cl-)增大,AgCl溶解平衡左移,D对。
四大平衡常数计算方法在化学中,平衡常数是理解化学反应的重要工具。
四大平衡常数(Kc、Kp、Ka、Kb)分别用于描述化学反应在平衡状态下的动态行为。
每种常数提供了对反应物和生成物之间相对浓度的量化表现,能够帮助我们预测反应方向、反应程度以及反应条件对平衡位置的影响。
理解四大平衡常数的计算方法对化学研究和实际应用具有重要意义。
一、平衡常数Kc的计算1. Kc定义Kc是指在特定温度下,化学反应达到平衡时生成物浓度的乘积与反应物浓度的乘积的比值,通常用方程表示为Kc=[C]^c[D]^d/[A]^a[B]^b,其中[A]、[B]为反应物浓度,[C]、[D]为生成物浓度,a、b、c、d为反应物和产品的化学计量数。
2.计算步骤a.确定反应方程式并确保其平衡。
b.测定各物质在平衡时的浓度值。
c.带入Kc公式进行计算。
3.注意事项a. Kc只与温度有关,温度变化会导致平衡常数的变化。
b.反应浓度单位不同,Kc的数值会有影响。
二、平衡常数Kp的计算1. Kp定义Kp是用来描述气体反应在平衡时分压的比值,其公式与Kc类似,Kp=[P_C]^c[P_D]^d/[P_A]^a[P_B]^b。
P_A、P_B、P_C、P_D为反应物和生成物的分压。
2. Kc与Kp的关系Kp与Kc之间有明确的联系,Kp=Kc(RT)^(Δn),其中Δn是气体产品摩尔数与反应物摩尔数之差,R为气体常数,T为绝对温度。
3.计算步骤a.确定反应的平衡方程式。
b.测定气体的分压。
c.根据Kp与Kc的关系进行计算。
三、酸离解常数Ka的计算1. Ka定义Ka是描述弱酸在水中部分离解的能力,其值反映了溶液中氢离子的浓度与未离解酸的浓度的关系,公式为Ka=[H^+][A^-]/[HA]。
2.计算步骤a.设定反应方程HA ⇌ H^+ + A^-。
b.测量平衡时的浓度。
c.将各浓度代入Ka公式进行计算。
3.注意事项a.分子结构、溶液pH会对Ka值产生影响。
b. Ka值的大小能够反映酸的强度。
四大平衡常数的相互关系及运算1.(2019·廊坊模拟)水的电离平衡曲线如图所示,下列说法不正确的是()A.图中四点K W间的关系:A=D<C<BB.若从A点到D点,可采用:温度不变在水中加入少量酸C.若从A点到C点,可采用:温度不变在水中加入少量NH4Cl固体D.若从A点到D点,可采用:温度不变在水中加入少量NH4Cl固体解析:选C K W只受温度的影响,随温度升高而增大,A、D点温度相同,B点温度>C 点温度>A点温度,A正确;从A点到D点,温度不变,酸性增强,B、D正确;A、C点温度不同,C错误。
2.已知,常温下浓度为0.1 mol·L-1的下列溶液的pH如表:下列有关说法正确的是()A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HFB.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液呈中性,则溶液中2c(CO2-3)+c(HCO-3)=0.1 mol·L-1C.根据上表,水解方程式ClO-+H2O HClO+OH-的水解常数K≈10-7.6D.向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-)解析:选C盐NaF、NaClO、Na2CO3、NaHCO3所对应的酸依次为HF、HClO、HCO-3、H2CO3,酸性:HCO-3<HClO <H2CO3<HF,所以三种酸溶液的导电能力顺序:HClO<H2CO3<HF,A项错误;0.1 mol·L-1 Na2CO3溶液中,c(Na+)=0.2 mol·L-1,根据电荷守恒有:c(Na+)+c(H+)=c(HCO-3)+2c(CO2-3)+c(OH-),由于溶液呈中性:c(H+)=c(OH-),则c(Na+)=2c(CO2-3)+c(HCO-3)=0.2 mol·L-1,B项错误;根据水解方程式ClO-+H2O HClO+OH-,水解的平衡常数表达式为K=c(HClO)·c(OH-)c(ClO-),从上表可知常温下浓度为0.1 mol·L-1NaClO溶液的pH=9.7,则pOH=4.3,c(OH-)=10-4.3,所以,K=10-4.3×10-4.30.1≈10-7.6,C项正确;向NaClO 溶液中通HF气体至恰好完全反应,NaClO+HF===NaF +HClO ,溶液中生成等物质的量的NaF 和HClO ,由于HClO 为弱酸,存在着电离平衡:HClOH ++ClO -,同时溶液中也存在着NaF 的水解平衡,但是由于水解程度是很微弱的,所以溶液中应该是c (Na +)>c (F -) >c (HClO)>c (H +)>c (OH -),D 项错误。
对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),在一定温度下达到平衡时:K=c p?C?·c q?D?c m?A?·c n?B?以一元弱酸HA为例:HA H++A-,电离常数K a=c?H+?·c?A-?c?HA?3.计算转化率(或产率);4.应用平衡常数K 判断平衡移动的方向(或放热、吸热等情况)。
对 策从基础的地方入手,如速率计算、“三阶段式”的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力。
1.高炉炼铁过程中发生的主要反应为13Fe 2O 3(s)+CO(g)23Fe(s)+CO 2(g)。
已知该反应在不同温度下的平衡常数如下:温度/℃ 1 000 1 150 1 300 平衡常数4.03.73.5请回答下列问题:(1)该反应的平衡常数表达式K =________,ΔH ________0(填“>”“<”或“=”);(2)在一个容积为10 L 的密闭容器中,1 000 ℃时加入Fe 、Fe 2O 3、CO 、CO 2各1.0 mol ,反应经过10 min 后达到平衡。
求该时间范围内反应的平均反应速率v (CO 2)=________,CO 的平衡转化率=________。
2.已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH >0,请回答下列问题:(1)在某温度下,反应物的起始浓度分别为:c (M)=1 mol/L ,c (N)=2.4 mol/L ;达到平衡后,M 的转化率为60%,此时N 的转化率为________。
(2)若反应温度升高,M 的转化率________(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c (M)=4 mol /L ,c (N)=a mol/L ;达到平衡后,c (P)=2 mol/L ,a =________。