亲电加成反应
- 格式:doc
- 大小:139.50 KB
- 文档页数:6

亲电加成反应的机理-回复亲电加成反应是有机化学中常用的一种反应类型,也是一种非常重要的反应。
它是指通过亲电试剂与底物发生加成反应,生成化合物中新的化学键。
在这篇文章中,我将详细介绍亲电加成反应的机理,从反应物的构型到产物的形成,一步一步回答。
首先,我们来讨论亲电试剂。
亲电试剂是一种具有正电荷或部分正电荷的化合物,通常有金属阳离子、卤素或含有电子亲和性较强的官能团等。
它们具有亲电子活性,可以与电子丰富的底物发生反应。
常见的亲电试剂有卤代烷、硫酸酐、酸酐、酢酸酐等。
接着,我们来看底物。
底物是指参与反应的有机化合物,其中有一个或多个具有电子富余的键。
这些键可以成为亲电试剂攻击的中心,从而形成新的化学键。
在亲电加成反应中,亲电试剂以“亲电子”的形式攻击底物中具有电子富余的键。
亲电试剂的正电荷会与底物中的负电荷形成电荷云重叠,从而产生共轭体系。
这种电荷云重叠有助于亲电试剂与底物之间的相互作用,并降低活化能,促进反应的进行。
然而,亲电加成反应并不是简单地将亲电试剂与底物中的电子富余键结合。
在反应中,还需要考虑到化学键的断裂和重组。
亲电试剂攻击底物中的电子富余键后,通常会导致一个中间产物的生成。
这个中间产物具有比反应物更高的能量,因为生成了一个新的化学键。
为了使反应更容易进行,并得到一个稳定的产物,通常会加入一个试剂作为辅助。
这个辅助试剂通常具有负电性,可以吸引亲电试剂上的正电荷。
这种吸引力可以促使亲电试剂更容易接近底物,并减少不利的电子间排斥作用。
例如,用碱金属盐类作为辅助试剂时,亲电试剂中正电荷将与负离子结合,形成一个离子对。
这个离子对可以提高亲电试剂的亲电性,并促进反应的进行。
在亲电加成反应中,中间产物通常是一个离子。
这个离子可以是正离子、负离子或离子对。
这取决于亲电试剂和底物的性质,以及辅助试剂的影响。
最后,我们来看产物的形成。
在亲电加成反应中,生成的产物是经过化学键的重新排列而得到的。
这种重新排列可以发生在中间产物中,也可以发生在反应结束后。




大学有机化学反应方程式总结亲电加成和亲核取代反应在有机化学中,亲电加成和亲核取代反应是两种常见的反应机理。
它们在有机合成中具有重要的地位,能够合成各种有机化合物。
本文将对亲电加成和亲核取代反应的机理和常见的反应方程式进行总结。
亲电加成反应是指通过亲电试剂攻击有机化合物中的亲电性较强的部分,从而形成共价键和新的化合物。
亲电试剂可以是正离子或中性分子,常见的有卤代烷、氯化亚砜、硫酮等。
亲电加成反应的机理通常包括四个步骤:1. 亲电试剂进攻:亲电试剂通过正电荷或δ+部分攻击有机分子的亲电性较强的部分;2. 形成共价键:亲电攻击后形成新的化学键,生成中间体;3. 步骤二反应完成:通过负离子或中性分子的攻击,使得步骤二生成的中间体去离子,生成产物;4. 氢离子回收:再生负离子或中性分子的离子,进行下一轮反应。
亲电加成反应的反应方程式常常以杂环化合物的形式出现,例如:环氧化酮的开环反应、环胺的开环反应等。
下面是几个亲电加成反应的常见例子:1. 环氧化酮的开环反应:[图1]2. 氨的亲电加成反应:[图2]3. 烯烃的亲电加成反应:[图3]亲核取代反应是指通过亲核试剂攻击有机分子中较强亲核性的部分,从而发生反应。
亲核试剂可以是负离子或中性分子,常见的有水、氨、醇等。
亲核取代反应通常包括三个步骤:1. 亲核试剂进攻:亲核试剂通过负离子或δ-部分攻击有机分子的亲核性较强部分;2. 形成新的化学键:亲核攻击后,在反应物中形成新的共价键;3. 步骤二反应完成:通过离子或中性分子的离去,生成产物。
亲核取代反应的常见反应方程式有醇的取代反应、酯的加水反应等。
下面是几个亲核取代反应的常见例子:1. 醇的取代反应:[图4]2. 酯的加水反应:[图5]3. 卤代烃的取代反应:[图6]亲电加成和亲核取代反应是大学有机化学中重要的反应机制,对于有机化合物的合成有着重要的意义。
在实际应用中,根据具体反应需要选择适当的试剂和条件,合理设计反应方程式,才能获得所需的产物。



化学反应中的亲电加成反应机理探讨化学反应是物质转化的过程,其中亲电加成反应是一种常见的反应类型。
在这篇文章中,我们将探讨亲电加成反应的机理以及其在化学反应中的重要性。
亲电加成反应属于反应物中亲电性物种与亲电性较低的物种之间的反应。
这种反应的机理主要涉及到亲电受体和亲电受体两个步骤。
在第一个步骤中,亲电性物种(通常是亲电性较高的分子或离子)通过提供一个亲电子对与亲电性较低的物种中的亲核性部位结合。
这个过程中,亲电性物质中的孤对电子或是氧、氮等元素上的亲电子对可以以共价键的形式与亲核性物质中的亲核性部位结合。
例如,对于烯烃的亲电加成反应,亲电性物质通常是一个电子亏损的分子。
它的亲电性中心可以是一个电子缺失的原子或是一个具有正电荷的离子。
当它与烯烃分子中的π键结合时,会通过共用电子对的形式形成一个新的化学键。
在第二个步骤中,亲电性物质中的亲电性中心得到亲核性部位提供的一个亲电子对,并释放出一个亲电子位。
这个过程中,亲电性物质的亲电性中心会经历电子的亲核性替代而与亲核性电子形成新的化学键。
亲电加成反应机理的探讨离不开两个关键因素:亲电中心的亲电性和亲核性部位的亲核性。
亲电中心的亲电性越高,反应速率越快。
在一些情况下,亲电中心的亲电性会受到分子结构的影响,例如共轭体系的存在可能会增加中间体的稳定性,从而加速亲电加成反应的进行。
另一方面,亲核性部位的亲核性也是决定亲电加成反应速率的一个重要因素。
亲核性部位的亲核性越高,越容易与亲电性物质中的亲电中心结合,从而促进反应的进行。
类似地,亲核性部位的亲核性也可能受分子结构的影响,例如通过酸性或碱性的调节可以增强亲核性部位的亲核性。
亲电加成反应在有机合成中广泛应用。
它可以用于构建新的碳-碳键或碳-其他原子键,从而合成具有特定结构和功能的有机分子。
通过选择合适的亲电性物质和亲核性部位,可以实现对反应产物的控制。
此外,亲电加成反应还常见于药物合成、材料科学和天然产物合成等领域。

烯烃的亲电加成反应遵循什么反应机理?该反应有哪些应用?一、烯烃的亲电加成反应概述烯烃的亲电加成反应是指在烯烃分子上发生的加成反应,其中一个或多个亲电试剂与烯烃发生加成反应,生成新的化合物。
这种反应是有机合成中最为常见和重要的反应之一。
二、烯烃的亲电加成反应机理1. 电子云重叠首先,亲电试剂与双键上的π电子形成共价键。
在这个过程中,由于π键上的电子密度较高,因此π键上的电子会与亲电试剂形成重叠区域。
2. 形成中间体接下来,共价键形成后,产生了一个中间体。
这个中间体是一个共轭系统,并且具有不饱和性质。
3. 中间体进一步转化中间体可以通过多种方式进一步转化。
例如,它可以被质子化、被氧化或被还原等。
4. 新化合物生成最后,在这个过程中产生了新的化合物。
这个新的化合物通常比原来的双键更稳定,并且具有不同的性质。
三、烯烃的亲电加成反应分类1. 羰基亲电加成反应羰基亲电加成反应是指在烯烃分子上发生的加成反应,其中羰基试剂与烯烃发生加成反应,生成新的化合物。
这种反应是有机合成中最为常见和重要的反应之一。
2. 卤素亲电加成反应卤素亲电加成反应是指在烯烃分子上发生的加成反应,其中卤素试剂与烯烃发生加成反应,生成新的化合物。
这种反应通常需要催化剂的存在,并且可以用于制备各种有机卤化物。
3. 硫醇亲电加成反应硫醇亲电加成反应是指在烯烃分子上发生的加成反应,其中硫醇试剂与烯烃发生加成反应,生成新的化合物。
这种反应通常需要催化剂的存在,并且可以用于制备各种有机硫化合物。
四、烯烃的亲电加成反应在有机合成中的重要性1. 制备各种有机化合物由于其广泛性和高效性,烯烃的亲电加成反应在有机合成中被广泛应用。
它可以用于制备各种有机化合物,包括药物、天然产物和高分子材料等。
2. 用于构建碳-碳和碳-氧化合物键烯烃的亲电加成反应可以用于构建碳-碳和碳-氧化合物键。
这些键是有机分子中最为常见的键之一,因此这种反应在有机合成中具有重要地位。
3. 在不对称合成中的作用烯烃的亲电加成反应还可以在不对称合成中发挥重要作用。
亲电加成反应名词解释亲电加成反应是有机化学中常见的一种化学反应,是指亲电试剂与一个π电子体系发生加成反应,形成新的化学键。
该反应是有机合成中的重要工具,常用于合成复杂有机分子。
以下是对亲电加成反应的详细解释。
1. 亲电加成反应的定义亲电加成反应指的是一个亲电试剂与一个π电子体系发生加成反应,形成新的化学键。
在该过程中,亲电试剂通过与π键上的π电子形成新的σ键,从而改变原有分子结构。
2. 亲核和亲电试剂在亲电加成反应中,通常存在两种基本类型的试剂:一种是具有孤对或自由基结构上富余或富集了一对非共用原子轨道(通常为孤对轨道)或自由基轨道(通常为非共用原子轨道)而具有较强核性和较强求核性质;另一种则是具有σ键上富余了正荷或正荷分布较大而具有较强正荷性质和较强求荷性质。
前者被称为“异极物”,后者被称为“极性物”。
3. 亲电加成反应的机理亲电加成反应一般遵循亲电试剂的进攻性和π电子体系的亲核性。
具体来说,亲电试剂通过与π键上的π电子形成新的σ键,从而改变原有分子结构。
这个过程可以分为三个步骤:进攻步骤、形成新键步骤和离去步骤。
3.1 进攻步骤在进攻步骤中,亲电试剂中带有正荷的原子或基团通过与π键上孤对或自由基轨道上的π电子形成新的σ键。
这一过程中,正荷原子或基团被称为“进攻物种”。
3.2 形成新键步骤在形成新键步骤中,由于正荷原子或基团与π键上孤对或自由基轨道上的π电子发生相互作用而形成了新的σ键。
这一过程是整个反应中最关键和最决定性的一步。
3.3 离去步骤在离去步骤中,离去基团从反应物分子中离去,并带走一对非共用原子轨道上富余了正荷而具有较强正荷性质的正荷。
这一过程一般是通过负离子的形式进行的。
4. 亲电加成反应的应用亲电加成反应在有机合成中有着广泛的应用。
通过选择合适的亲电试剂和π电子体系,可以实现多样化的化学转化。
常见的亲电加成反应包括醛和酮与亲核试剂发生加成反应、烯烃与亲核试剂发生加成反应等。
4.1 醛和酮与亲核试剂发生加成反应醛和酮是常见的有机化合物,它们可以通过与亲核试剂发生亲电加成反应,形成新的碳-碳键或碳-氧键。
乙烯亲电加成的反应机理乙烯的亲电加成反应是一种重要的化学反应,广泛应用于有机合成和化学工业领域。
在此反应中,亲电试剂与乙烯的双键进行加成,生成新的碳—碳键。
乙烯的亲电加成反应可以分为电子导入型和电子导出型两种类型。
1.电子导入型乙烯亲电加成反应机理:在电子导入型乙烯亲电加成反应中,亲电试剂通过与乙烯形成相互作用,使电子从亲电试剂移动到乙烯的π电子体系上,生成新的键。
通常,电子导入型乙烯亲电加成反应可以分为以下几个步骤:第一步:亲电试剂的进攻亲电试剂通过其正电荷(或亲核性原子)进攻并与乙烯形成共价键。
这个步骤是整个反应的起始步骤,也是速率决定步骤。
第二步:配体迁移在电子导入型反应中,亲电试剂中的正电荷会通过氢或其他原子的转移而迁移到乙烯分子上。
这一步骤通常成为配体迁移或迁移步骤。
第三步:重排重排是一种分子结构的重新分布过程,通常伴随着π键的重组或移动。
重排可以发生在反应的任何时刻,也可以在配体迁移之后发生。
第四步:生成产物通过以上步骤,产生了新的碳—碳键,形成了加合物。
这个产物可以是一个新的分子,也可以是一个中间体,进一步反应生成最终产物。
电子导入型乙烯亲电加成反应的机理实际上是一个极其复杂的过程,其中涉及了多个中间物和过渡态的生成和变化。
2.电子导出型乙烯亲电加成反应机理:在电子导出型乙烯亲电加成反应中,亲电试剂的正电荷(或亲核性原子)进攻乙烯双键中的一个碳原子上,使得其上的π电子向另一个碳原子上重新分布。
通常,电子导出型乙烯亲电加成反应可以分为以下几个步骤:第一步:亲电试剂的进攻亲电试剂通过其正电荷(或亲核性原子)进攻乙烯双键中的一个碳原子,形成一个质子化中间体。
第二步:质子迁移质子化中间体中的质子通过氢或其他原子的转移而迁移到乙烯双键的另一个碳原子上。
第三步:非对称塔自由基中间体形成质子迁移后,形成了非对称塔自由基中间体。
这个中间体是通过电子从其他原子迁移到乙烯双键上而形成的。
第四步:生成产物通过以上步骤,产生了新的碳—碳键,形成了加合物。
亲电加成反应是正离子亲电加成反应是一种化学反应,其中正离子作为反应物参与其中。
在化学中,离子是带电的原子或分子。
正离子是带正电荷的离子,在化学反应中起着重要的作用。
亲电加成反应是一种加成反应,其中一个亲电体与一个亲核体发生反应,形成一个新的化合物。
在这个过程中,亲电体作为接受电子的反应物,而亲核体作为提供电子的反应物。
正离子常常是亲电体参与亲电加成反应的重要组成部分。
亲电体是一种具有电子亲和性的化合物,它倾向于吸引和接受电子。
正离子通常具有高度的电子亲和性,因此它们往往是亲电体。
正离子可以通过失去电子或接受电子来满足其电子亲和性。
在亲电加成反应中,正离子通常接受电子并参与新化合物的形成。
亲核体是一种具有富电子特性的化合物,它倾向于提供和分享电子。
亲核体通常具有孤对电子或具有部分负电荷的原子。
当亲核体与亲电体发生反应时,亲核体提供电子给亲电体,从而形成新的化合物。
正离子在亲电加成反应中起到了接受电子的角色,与亲核体发生反应形成新的化合物。
正离子在化学反应中起着重要的作用。
它们可以作为亲电体参与亲电加成反应,与亲核体发生反应形成新的化合物。
正离子的电子亲和性使其能够接受电子,并与亲核体共享电子。
这种反应可以产生各种各样的化合物,对于有机合成和药物研发等领域具有重要意义。
亲电加成反应是有机化学中常见的一种反应类型。
正离子可以是有机分子中的阳离子,也可以是无机化合物中的阳离子。
在有机化学中,正离子可以是碳阳离子、氧阳离子、氮阳离子等。
这些正离子与亲核体发生反应,形成新的化合物。
在有机合成中,亲电加成反应是合成复杂有机分子的重要手段之一。
正离子参与其中,通过与亲核体发生反应,形成新的化合物。
这种反应可以在室温下或加热条件下进行,具有高效、高选择性和高收率的特点。
亲电加成反应的广泛应用使得有机合成变得更加灵活和高效。
总结起来,亲电加成反应是一种以正离子作为反应物参与的化学反应。
亲电体作为接受电子的反应物,亲核体作为提供电子的反应物,在亲电加成反应中发生反应形成新的化合物。
亲电加成反应
——李佳化学化工学院应用化学102班
摘要:
本文主要系统地阐述了亲电加成反应的定义,反应的本质及内在规律,反应机理及几种重要反应类型等。
一、简介
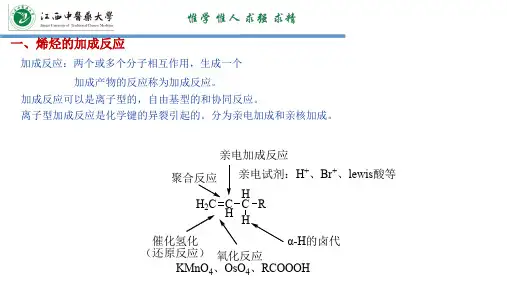
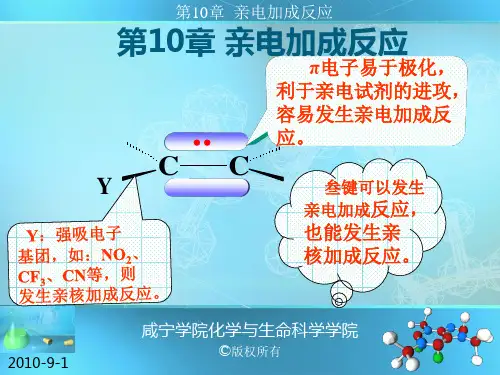
亲电加成反应(EA),简称亲电加成,不饱和烃分子中,由于π电子具流动性,易被极化,因而具有供电子性能,易受到缺电子试剂(亲电试剂)的进攻而发生反应,这种由亲电试剂的作用而引起的加成反应称为亲电加成反应。
是亲电试剂(带正电的基团)进攻不饱和键引起的加成反应。
反应中,不饱和键(双键或三键)打开,并与另一个底物形成两个新的σ键。
亲电加成反应是不饱和键的加成反应,是π电子与实际作用的结果。
π键较弱,π电子受核的束缚较小,结合较松散,因此的作为电子的来源,给别的反应物提供电子。
反应时,把它作为反应底物,与它反应的试剂应是缺电子的化合物,俗称亲电试剂。
这些物质又酸中的质子,极化的带正电的卤素,又叫马氏加成,由马可尼科夫规则而得名:“烯烃与氢卤酸的加成,氢加在氢多的碳上。
”(氢多加氢)广义的亲电加成反应是由任何亲电试剂与底物发生的加成反应。
亲电加成中最常见的不饱和化合物是烯烃和炔烃,以最简单的烯烃——乙烯为例,它与亲电试剂发生的加成反应可以通过下式来描述:
二、亲电加成机理:
亲电加成有多种机理,包括:碳正离子机理、离子对机理、环鎓离子机理以及三中心过渡态机理。
这些机理对过渡态的处理都有不同。
除最后一种外,其他机理可通过下图依此表示:
碳正离子
机理
离子对机
理
环鎓离子
机理
反应采取哪种机理进行与亲电试剂和不饱和化合物的性质、溶剂的极性和过渡态的稳定性等都有很大关系,一般来说,卤素加成反应中,溴与烯烃的加成反应主要按照环鎓离子中间体机理进行,而氯与烯烃的加成反应主要按照前两种机理进行。
这主要是因为两种卤素原子电负性和原子半径不同,溴的孤电子对容易和碳正离子p轨道重叠,而氯则不然。
亲电加成反应历程有两种,都是分两步进行的,作为第一步都是形成带正电的中间体(一种是碳正离子,另一种是鎓离子)。
2)由于形成的中间体的结构不同,第二步加负性基团时,进攻的方向
不一样,中间体为鎓离子时,负性基团只能从反面进攻,中间体为碳正离子时,正反两面都可以。
一般Br2,I2通过鎓离子历程,HX等通过碳正离子历程。
二,马氏规则的解释和碳正离子的稳定性
马氏规则是由实验总结出来的经验规则,它的理论解释可以从结构和反应历程两方面来理解:
1. 用诱导效应和σ-π共轭效应来解释,用诱导效应解释,σ-π共轭效应来解释:当键直接与双键相连时,这样的体系中,存在着电子的离域现象,其结果使极化。
2.用泼中间体碳正离子的稳定性来解释
从电负性看,Csp2 > Csp3 故烷基上的电荷向C+ 转移,分散了C+ 的电荷,烷基越多,分散作用越大,碳正离子越稳定。
从σ-P共轭效应看,参与σ-P共轭的键数目越多,则正电荷越分散,碳正离子越稳定。
不同的机理也会产生立体选择性不同的产物。
碳正离子机理得到顺式加成和反式加成产物的混合物,离子对机理得到的是顺式加成产物,而环鎓离子机理得到反式加成产物。
对于不对称的亲电加成反应来讲,反应一般符合马氏规则,产物具有区域选择性。
但双键碳上连有吸电子基或以有机硼化合物作亲电试剂时,产物是反马氏规则的,因为碳正离子的稳定性越大,越易生成,当有两种碳正离子可能生成时,则优先生成稳定的碳正离子,故主要得到马氏产物。
例如烯烃与乙硼烷生成烷基硼的反应:
乙硼烷是甲硼烷的二聚体,反应时乙硼烷离解成甲硼烷, B2H6 2BH3
产物为一、二、三烷基硼,是分步进行加成而得到的。
CH2=CH2+BH3 CH3-CH2BH2
CH2=CH2+CH3-CH2BH2(CH3-CH2)2BH
CH2=CH2+(CH3-CH2)2BH (CH3-CH2)3B
不对称烯烃加硼烷时,硼原子加到含氢较多的碳原子上:原因:电负性B2.0; H2.1
CH3- CH=CH2+ BH3 CH3-CH2-CH2BH2
烷基硼与过氧化氢(H2O2)的氢氧化钠(NaOH)溶液作用,立即被氧化,同时水解为醇:
(CH3-CH2)3B+H2O2/OH- CH3-CH2OH+B(OH)2
6RCH=CH2+B2H6→(RCH2CH2)3B
(RCH2CH2)3B→RCH2CH2OH+H2O
这是合成伯醇的一个好方法。
三、亲电试剂(electrophiles):
试剂在进攻反应中心时,试剂的正电部分较活泼,总是先加在反应中心电子云密度大的原子上,即电子云密度较大的双键碳上。
常见的亲电试剂有卤素(Cl2、Br2),无机酸(H2SO4、HCl、HBr、Hl、HOCl、HOBr),有机酸(F3C—COOH、Cl3C—COOH)等。
四、主要的亲电加成反应类型
对于烯烃,主要有:卤素加成反应、加卤化氢反应、水合反应、
氢化反应、羟汞化反应、硼氢化-氧化反应、Prins反应,以及与硫酸、次卤酸、有机酸、醇和酚的加成反应;对于炔烃,主要有:卤素加成反应、加卤化氢反应和水合反应。
由于sp碳原子的电负性比sp2碳原子电负性强,与电子结合得更为紧密,故炔烃的亲电加成反应一般比烯烃要慢;亲电试剂进攻芳香环时,主要发生的不是亲电加成反应,而是亲电芳香取代反应。
其他的加成反应主要机理还有亲核加成反应、自由基加成反应和环加成反应。
烯烃加成
在烯烃的亲电加成反应过程中,氢正离子首先进攻双键(这一步是定速步骤),生成一个碳正离子,然后卤素负离子再进攻碳正离子生成产物。
立体化学研究发现,后续的卤素负离子的进攻是从与氢离子相反的方向发生的,也就是反式加成。
如丙烯与HBr的加成:CH3-CH=CH2+HBr→CH3-CHBr-CH3第一步,HBr电离生成H和Br离子,氢离子作为亲电试剂首先进攻C=C双键,形成这样的结构:第二步,由于氢已经占据了一侧的位置,溴只能从另外一边进攻。
根据马氏规则,溴与2-碳成键,然后氢打向1-碳的一边,反应完成。
马氏规则的原因是,取代基越多的碳正离子越稳定也越容易形成。
这样占主导的取代基多的碳就优先被负离子进攻。
对其它加成试剂马氏规则可表述为:不对称烯烃与卤化氢或其它极性试剂加成,氢或带正电荷的部分总是加到含氢较多的双键碳原子上,带负电荷的部分总是加到含氢较少的双键碳原子上;当有过氧化物(如 H2O2, R-O-O-R等)存在时,不对称烯烃与HBr的加成产物
不符合马氏规则(反马氏取向)。
这是过氧化物效应(因有过氧化物的存在而引起溴化氢加成定向的现象称为过氧化物效应。
)Markovnikov规则:H原子加到烯烃含H原子较多的双键C原子上,卤素加到含H原子较少的双键C原子上。
炔烃加成
与烯相比,炔烃的C≡C键的碳为sp杂化,吸电子能力比较强,故不易给出电子对,所以较烯烃不易进行亲电加成反应。
再者,叁键的键长(0.12nm)比双键(0.134nm)短,它的p电子云有较多的重叠,故π键较难被打开。
CH2=CHCH2-C≡CH+Br2→CH2BrCHBrCH2-C≡CH 90%
炔烃也可以和卤化氢加成,不对称炔烃仍按马氏规则进行,但不如烯烃容易,用汞盐或亚铜盐作催化剂,乙炔与氯化氢加成得氯乙烯: RC≡CH+HX→RCX=CH2+HX→RCX2CH
不对称炔烃与溴化氢的加同样有过氧化物效应。
参考文献:维基百科、百度百科、搜搜百科、百度文库、《化学的100个基本问题》(纸质图书)。