烯烃亲电加成
- 格式:ppt
- 大小:1.39 MB
- 文档页数:7

烯烃亲电加成自由基加成共轭加成共轭烯烃物理性质的特点:1.红移2.易极化3.趋于稳定烯烃的反应:亲电加成:4种机理1.环正离子中间体机理:溴与烯烃的加成,溴鎓离子,主要产物为反式,苏型产物。
2.碳正离子中间体机理:顺式加成与反式加成皆有很大的机会。
3.离子对中间体机理:主要为顺式加成。
4.三中心过渡态机理:试剂的结构,反应的环境,过渡态的稳定性等等因素都会对机理的选择起影响。
马氏规则:碳碳双键与氢卤酸的加成主要产物为,卤素原子加到带有氢原子少的那一个上。
Notification:具体的特别情况仍然需要进一步的分析:借助电子效应,热力学上最稳定的那种产物,就是主要产物。
烯烃与硫酸,水,有机酸,醇和酚的反应:碳正离子机理,常常有重排产物,不采用。
与有机酸反应生成酯。
烯烃与次卤酸的加成:具体考虑机理之后,再去确定加成是顺式为主还是反式为主。
烯烃的自由基加成反应:反马氏加成Kharasch效应:过氧化物在光照条件下生成自由基。
(又名过氧化效应)书上只说了氢卤酸的kharasch效应,唯有HBr可行。
烯烃的氧化:环氧化反应:顺式加成,产物极其活泼,容易开环!;制取邻二醇:AcOH、H2O2与烯烃反应得到羟基酯,加热使其分解得到邻二醇。
高锰酸钾氧化:PH值对高锰酸钾的氧化能力有影响,需要校正PH值来引导反应方向。
特点:产率不高。
副产物极多!高锰酸钾(aq)用于烯烃的鉴别:注意:有干扰时,请慎用!现象:褪色,沉淀(MnO2)产生。
OsO4氧化烯烃:大量H2O2(低廉)和微量OsO4(昂贵)合作做氧化剂。
顺式加成。
烯烃的臭氧化-分解反应:臭氧氧化之后,得到的二级氧化产物在还原剂的庇护之下,生成两个羰基化合物用于对烯烃结构的推测:发挥想象,连接双键烯烃的硼氢化—氧化反应和硼氢化—还原反应:硼氢化:反马氏规则,顺式加成。
B2H6和烯烃反应生成烷基硼烷。
硼氢化—氧化反应:①碱性条件②底物为烷基硼③过氧化氢参与氧化反应生成硼酸酯(OH-为进攻离子)硼酸酯水解的到醇(ROH)与硼酸(B(OH)3)。

烯烃亲电加成反应选择性的探讨
烯烃亲电加成反应是一种重要的有机化学反应,它可以在烯烃分子中形成烯烃亲电络合物。
它的选择性主要取决于反应体系中的烯烃结构、反应条件和反应物的性质。
1. 烯烃结构:由于烯烃分子的结构不同,它们的亲电加成反应选择性也不同。
例如,烯烃分子中包含碳碳双键的烯烃,其亲电加成反应选择性较低,因为它们具有较弱的亲电性。
而烯烃分子中包含碳氢双键的烯烃,其亲电加成反应选择性较高,因为它们具有较强的亲电性。
2. 反应条件:反应条件也会影响烯烃亲电加成反应的选择性。
例如,在高温条件下,烯烃分子中的碳氢双键会变得更加活泼,从而提高亲电加成反应的选择性。
3. 反应物性质:反应物的性质也会影响烯烃亲电加成反应的选择性。
例如,烯烃分子中的碳氢双键可以与具有较强亲电性的反应物反应,从而提高亲电加成反应的选择性。

烯烃亲电加成自由基加成共轭加成共轭烯烃物理性质的特点:1.红移2.易极化3.趋于稳定烯烃的反应:亲电加成:4种机理1.环正离子中间体机理:溴与烯烃的加成,溴鎓离子,主要产物为反式,苏型产物。
2.碳正离子中间体机理:顺式加成与反式加成皆有很大的机会。
3.离子对中间体机理:主要为顺式加成。
4.三中心过渡态机理:试剂的结构,反应的环境,过渡态的稳定性等等因素都会对机理的选择起影响。
马氏规则:碳碳双键与氢卤酸的加成主要产物为,卤素原子加到带有氢原子少的那一个上。
Notification:具体的特别情况仍然需要进一步的分析:借助电子效应,热力学上最稳定的那种产物,就是主要产物。
烯烃与硫酸,水,有机酸,醇和酚的反应:碳正离子机理,常常有重排产物,不采用。
与有机酸反应生成酯。
烯烃与次卤酸的加成:具体考虑机理之后,再去确定加成是顺式为主还是反式为主。
烯烃的自由基加成反应:反马氏加成Kharasch效应:过氧化物在光照条件下生成自由基。
(又名过氧化效应)书上只说了氢卤酸的kharasch效应,唯有HBr可行。
烯烃的氧化:环氧化反应:顺式加成,产物极其活泼,容易开环!;制取邻二醇:AcOH、H2O2与烯烃反应得到羟基酯,加热使其分解得到邻二醇。
高锰酸钾氧化:PH值对高锰酸钾的氧化能力有影响,需要校正PH值来引导反应方向。
特点:产率不高。
副产物极多!高锰酸钾(aq)用于烯烃的鉴别:注意:有干扰时,请慎用!现象:褪色,沉淀(MnO2)产生。
OsO4氧化烯烃:大量H2O2(低廉)和微量OsO4(昂贵)合作做氧化剂。
顺式加成。
烯烃的臭氧化-分解反应:臭氧氧化之后,得到的二级氧化产物在还原剂的庇护之下,生成两个羰基化合物用于对烯烃结构的推测:发挥想象,连接双键烯烃的硼氢化—氧化反应和硼氢化—还原反应:硼氢化:反马氏规则,顺式加成。
B2H6和烯烃反应生成烷基硼烷。
硼氢化—氧化反应:①碱性条件②底物为烷基硼③过氧化氢参与氧化反应生成硼酸酯(OH-为进攻离子)硼酸酯水解的到醇(ROH)与硼酸(B(OH)3)。


烯烃的亲电加成反应烯烃的亲电加成反应烯烃的亲电加成反应与烯烃发生亲电加成的试剂,常见的有下列几种:卤素(Br2,Cl2)、无机酸(H2SO4,HCl,HBr,HI,HOCl,HOBr)及有机酸等。
1.与卤素加成主要是溴和氯对烯烃加成。
氟太活泼,反应非常激烈,放出大量的热,使烯烃分解,所以反应需在特殊条件下进行。
碘与烯烃不进行离子型加成。
(1)加溴:在实验室中常用溴与烯烃的加成反应对烯烃进行定性和定量分析,如用5%溴的四氯化碳溶液和烯烃反应,当在烯烃中滴入溴溶液后,红棕色马上消失,表明发生了加成反应,一般双键均可进行此反应。
CH2=CH2+Br2→BrCH2CH2Br卤素与烯烃的加成反应是亲电加成,反应机制是二步的,是通过环正离子过渡态的反式加成,主要根据以下实验事实:(a)反应是亲电加成:是通过溴与一些典型的烯烃加成的相对反应速率了解的:可以看到,双键碳上烷基增加,反应速率加快,因此反应速率与空间效应关系不大,与电子效应有关,烷基有给电子的诱导效应与超共轭效应,使双键电子云密度增大,烷基取代越多,反应速率越快,因此这个反应是亲电加成反应。
当双键与苯环相连时,苯环通过共轭体系,起了给电子效应,因此加成速率比乙烯快。
当双键与溴相连时,溴的吸电子诱导效应超过给电子共轭效应,总的结果起了吸电子的作用,因此加成速率大大降低。
(b)反应是分二步的:如用烯烃与溴在不同介质中进行反应,可得如下结果:上述三个反应,反应速率相同,但产物的比例不同,而且每一个反应中均有BrCH2CH2Br产生,说明反应的第一步均为Br+与CH2=CH2的加成,同时这是决定反应速率的一步;第二步是反应体系中各种负离子进行加成,是快的一步。
(上述三个反应,如溴的浓度较稀,主要产物为溴乙醇和醚。
)(c)反应是通过环正离子过渡态的反式加成,而且是立体选择性的反应(stereoselectivereaction)。
所谓环正离子过渡态,是试剂带正电荷或带部分正电荷部位与烯烃接近,与烯烃形成碳正离子,与烯烃结合的试剂上的孤电子对所占轨道,与碳正离子轨道,可以重叠形成环正离子,如形成活性中间体环正离子,这是决定反应速率的一步。

烯烃的亲电加成反应
烯烃的亲电加成反应是有机化学中的一种重要反应。
在此反应中,烯烃分子与亲电试剂之间发生加成反应,形成一个新的碳-碳化合物。
这种反应有许多应用,例如合成天然产物和药物分子等。
通常情况下,烯烃的亲电加成反应可以分为两种类型:电子不足烯烃和电子富烯烃。
对于电子不足烯烃,通常使用亲电性较高的试剂,如卤代烃、硝基化合物、醛类等作为试剂。
例如,使用氯代烃作为试剂,可以将烯烃的一个双键上的氢原子取代为氯原子,生成一种新的卤代烃。
而使用硝基化合物作为试剂,则可以将烯烃上的一个双键上的氢原子取代为硝基,形成一种新的硝基化合物。
对于电子富烯烃,一般使用亲电性较低的试剂,如酸、酚、膦酸等作为试剂。
例如,使用硫酸作为试剂,可以将烯烃的一个双键上的氢原子取代为硫酸基,形成一种新的硫酸酯。
总的来说,烯烃的亲电加成反应是一种重要的有机反应,可以实现高效的合成化学。
该反应已经被广泛应用于天然产物的合成、药物分子的合成以及其他化学领域。
- 1 -。

烯烃总结概说1烯烃的特征反应是亲电加成反应,烯烃作为亲电试剂和亲核试剂进行加成反应,加成反应可分为离子型的,自由基型得,协同型得,其中离子型的反应又可以分为亲电加成和亲核加成。
烯烃主要研究的是亲电加成即离子型的加成反应。
2亲电加成的机理可以分为环鎓离子机理,碳正离子机理,离子对机理,过渡态机理。
一.机理环鎓离子机理1与卤素的加成:环鎓离子机理,2步,第一步为速率控制步骤,第二步开环成为动力,注意此环所有原子子均满足八隅体,电负性小,体积大容易成环。
2 羟汞化—脱汞反应:2步,第一步与醋酸汞正离子形成汞金属鎓离子,水进攻汞鎓离子,使其开环,生成有机汞化醇,第二步,脱汞,在硼氢化钠碱性溶液中C-Hg变为C-H键。
3烯烃与次卤酸反应产物为邻位卤代醇2步,卤素首先与烯烃亲电加成形成环鎓离子,第二步,水作为亲核试剂进攻碳原子开环,注意:负电性物质与碳正离子的反应是竞争性的,其中卤素原子的竞争优势大于水。
碳正离子机理1 烯烃与氢卤酸的反应 2步第一步双键的质子化,形成碳正离子,对于不对称烯烃符合“马氏规则”—H加在含氢原子多的C上,此步骤为速率控制步骤,形成碳正离子吸热,此步骤的正反应活化能大于逆反应的活化能。
第二步负离子进攻C正离子形成加成产物。
碳正离子机理可以生成2种产物,顺式和反式。
注意:在有C正离子生成的反应中可能会有重排的发生,重排的动力是生成更稳定的碳正离子,如果不是更稳定,或者未使结构更加稳定化,则重排不会发生,反过来,一个产物若是重排产物,则要考虑器机理有可能是碳正离子机理。
2 与酸的反应ⅰ与硫酸的反应与浓硫酸也是按照碳正离子机理反应的,生成硫酸氢某酯,该酯在有水存在下加热水解生成醇—间接水合法。
也可以与有机酸生成酯,醇或酚生成醚,酸性都弱,所以常在强酸下催化才能完成.ⅱ与水的反应水是一种很弱的酸,与烯烃反应时常常加质子强酸催化,先双键质子化,再生成烊盐,最后失去质子,即机理仍为碳正离子机理。

烯烃可与卤素进行加成反应,生成邻二卤代烷。
该反应可用于制备邻二卤化物.烯烃可与卤化氢加成生成相应的卤代烷。
通常是将干燥的卤化氢气体直接与烯烃混合进行反应,有时也使用某些中等极性的化合物如醋酸等作溶剂,一般不使用卤化氢水溶液,因为使用卤化氢水溶液有可能导致水与烯烃加成这一副反应发生。
实验结果表明,不同卤化氢在这一反应中的活性次序是:HI>HBr>HCl,这与其酸性强度次序相符合。
卤化氢是一不对称试剂,当它与乙烯这样结构对称的烯烃加成时,只能生成一种加成产物:但遇到像丙烯这样的不对称烯烃时,则有可能生成两种不同的加成产物:实验结果表明,卤化氢与不对称烯烃的加成具有择向性,即在这一离子型加成反应中,卤化氢中的氢总是加到不对称烯烃中含氢较多的双键碳上。
这一规律是俄国化学家马尔柯夫尼可夫(V·Markovnikov)1869年提出的,称为马尔柯夫尼可夫定则,简称马氏定则。
例如:应用马氏定则,可以对许多这类反应的产物进行预测,并指导我们正确地利用这一反应来制备卤代烷。
当然,某些双键碳上连有强吸电子基的烯烃衍生物在卤化氢加成时,从形式上看就表现出反马氏定则的特性。
但从实质上看并不矛盾,因为亲电加成时,亲电试剂的正性部分总是首先加在电子云密度大的双键碳上,只不过大多数情况下,电子云密度大的双键碳上含氢原子多的缘故。
例如:此外,烯烃与溴化氢的加成当有过氧化物存在时,则真正表现出反马氏定则的特征。
例如:这种因过氧化物存在而导致加成反应取向发生改变的现象称为过氧化物效应。
在烯烃的亲电加成反应中,只有溴化氢对双键的加成有过氧化物效应,其他亲电试剂对双键的加成则不受过氧化物存在与否的影响。
因为过氧化物效应不按亲电加成反应机制进行,而是按自由基反应机制进行(见后)。
烯烃与硫酸加成生成硫酸氢酯,该酯经过水解便得到醇。
例如:利用这一过程可由烯烃制得醇,称为烯烃的间接水合法。
由于生成的硫酸氢酯可溶于浓硫酸,故实验中也常利用这一性质以硫酸除去烷烃等某些不活泼有机化合物中少量的烯烃杂质。

烯烃的亲电加成反应烯烃的亲电加成反应与烯烃发生亲电加成的试剂,常见的有下列几种:卤素( B% CI2)、机酸(H2SQ, HCI,HBr,HI,HOC( HOB)及有机酸等。
1 .与卤素加成主要是溴和氯对烯烃加成。
氟太活泼,反应非常激烈,放出大量的热,使烯烃分解,所以反应需在特殊条件下进行。
碘与烯烃不进行离子型加成。
(1)加溴:在实验室中常用溴与烯烃的加成反应对烯烃进行定性和定量分析,如用5%溴的四氯化碳溶液和烯烃反应,当在烯烃中滴入溴溶液后,红棕色马上消失,表明发生了加成反应,一般双键均可进行此反应。
CH=CH+Br2 f BrCHCHBr卤素与烯烃的加成反应是亲电加成,反应机制是二步的,是通过环正离子过渡态的反式加成,主要根据以下实验事实:(a)反应是亲电加成:是通过溴与一些典型的烯烃加成的相对反应速率了解的:烯疑H2C=CH5 CH3CH=CH, CCH3)2C=CH2(CH3XC=C(&H3)212W4 14相对速率CH==CHz BrCH==CH;3-4 < 0 04可以看到,双键碳上烷基增加,反应速率加快,因此反应速率与空间效应关系不大,与电子效应有关,烷基有给电子的诱导效应与超共轭效应,使双键电子云密度增大,烷基取代越多,反应速率越快,因此这个反应是亲电加成反应。
当双键与苯环相连时,苯环通过共轭体系,起了给电子效应,因此加成速 率比乙烯快。
当双键与溴相连时,溴的吸电子诱导效应超过给电子共轭效应, 总的结果起了吸电子的作用,因此加成速率大大降低。
(b) 反应是分二步的:如用烯烃与溴在不同介质中进行反应,可得如下 结果: CH 汙 ---- ► BrCH £CH £Br^BrCH 2CH £OHCH 2=CH 2+Br a > BrCH 2CH 2Br+BrCH £CH 2CH2C14-BrCH 2CH 2OHCH 尸CH’+BrM 込珈⑶虑比衣卅班也人比。
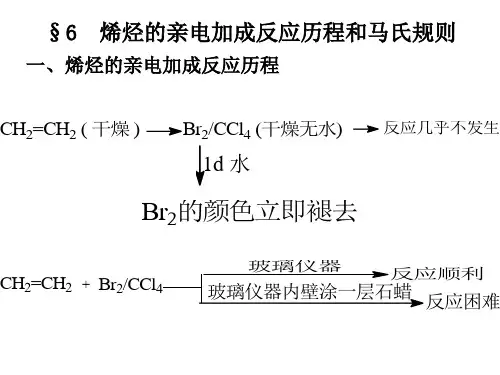

烯烃亲电加成反应机理及其活性中间体
烯烃亲电加成反应是一种重要的有机合成反应,它可以将烯烃与电子富集的受体分子反应,从而产生烯烃亲电加成产物。
烯烃亲电加成反应的机理是,烯烃分子中的π共轭系统会与受体分子中的电子富集的部分发生共轭作用,从而形成烯烃亲电加成反应的活性中间体。
活性中间体是一种具有双重性质的分子,它既具有烯烃分子的特性,又具有受体分子的特性。
活性中间体可以与受体分子发生反应,从而产生烯烃亲电加成产物。
烯烃亲电加成反应的活性中间体有多种,其中最常见的是烯烃亲电加成反应的碳碳双键中间体。
这种中间体是由烯烃分子和受体分子的电子富集部分结合而成的,它具有双重性质,既具有烯烃分子的特性,又具有受体分子的特性。
碳碳双键中间体可以与受体分子发生反应,从而产生烯烃亲电加成产物。
此外,还有一种烯烃亲电加成反应的碳氢双键中间体。
这种中间体是由烯烃分子和受体分
子的电子富集部分结合而成的,它具有双重性质,既具有烯烃分子的特性,又具有受体分
子的特性。
碳氢双键中间体可以与受体分子发生反应,从而产生烯烃亲电加成产物。
综上所述,烯烃亲电加成反应的机理是,烯烃分子中的π共轭系统会与受体分子中的电子富集的部分发生共轭作用,从而形成烯烃亲电加成反应的活性中间体。
活性中间体可以与
受体分子发生反应,从而产生烯烃亲电加成产物。
烯烃亲电加成反应的活性中间体有碳碳
双键中间体和碳氢双键中间体两种,它们都具有双重性质,既具有烯烃分子的特性,又具
有受体分子的特性。
烯烃的亲电加成反应 Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】烯烃的亲电加成反应烯烃的亲电加成反应与烯烃发生亲电加成的试剂,常见的有下列几种:卤素(Br2,Cl2)、无机酸(H2SO4,HCl,HBr,HI,HOCl,HOBr)及有机酸等。
1.与卤素加成主要是溴和氯对烯烃加成。
氟太活泼,反应非常激烈,放出大量的热,使烯烃分解,所以反应需在特殊条件下进行。
碘与烯烃不进行离子型加成。
(1)加溴:在实验室中常用溴与烯烃的加成反应对烯烃进行定性和定量分析,如用5%溴的四氯化碳溶液和烯烃反应,当在烯烃中滴入溴溶液后,红棕色马上消失,表明发生了加成反应,一般双键均可进行此反应。
CH2=CH2+Br2→BrCH2CH2Br卤素与烯烃的加成反应是亲电加成,反应机制是二步的,是通过环正离子过渡态的反式加成,主要根据以下实验事实:(a)反应是亲电加成:是通过溴与一些典型的烯烃加成的相对反应速率了解的:可以看到,双键碳上烷基增加,反应速率加快,因此反应速率与空间效应关系不大,与电子效应有关,烷基有给电子的诱导效应与超共轭效应,使双键电子云密度增大,烷基取代越多,反应速率越快,因此这个反应是亲电加成反应。
当双键与苯环相连时,苯环通过共轭体系,起了给电子效应,因此加成速率比乙烯快。
当双键与溴相连时,溴的吸电子诱导效应超过给电子共轭效应,总的结果起了吸电子的作用,因此加成速率大大降低。
(b)反应是分二步的:如用烯烃与溴在不同介质中进行反应,可得如下结果:上述三个反应,反应速率相同,但产物的比例不同,而且每一个反应中均有BrCH2CH2Br产生,说明反应的第一步均为Br+与CH2=CH2的加成,同时这是决定反应速率的一步;第二步是反应体系中各种负离子进行加成,是快的一步。
(上述三个反应,如溴的浓度较稀,主要产物为溴乙醇和醚。
)(c)反应是通过环正离子过渡态的反式加成,而且是立体选择性的反应(stereoselectivereaction)。
烯烃的亲电加成反应
烯烃是一种含有双键的有机化合物,双键上的云电子密度较高,因此容易发生亲电加成反应。
亲电加成反应是指一个亲电子试剂(如卤素、酸、羰基化合物等)攻击烯烃双键,形成一个新的化学键。
具体而言,烯烃的亲电加成反应发生的机理可以分为两种情况:
1. 烯烃与电子亲和力强的亲电子试剂反应
例如,卤素可以与烯烃发生亲电加成反应,生成卤代烃。
反应过程中,卤素的正电荷通过共价键与双键上的π电子形成新的化学键,同时烯烃的一个碳原子上的π电子与卤素之间的连接断裂。
2. 烯烃与亲电子试剂之间发生共轭加成反应
共轭加成反应是指亲电子试剂首先攻击烯烃双键上的π电子,形成一个共轭体系,然后在这个体系中发生加成反应。
例如,羰基化合物可以与烯烃发生共轭加成反应,生成羰基双键和烷基链。
反应过程中,羰基化合物的碳原子上的正电荷通过共价键与双键上的π电子形成一个共轭体系,然后这个体系中的双键上的π电子攻击羰基化合物的羰基,形成新的化学键。
总之,烯烃的亲电加成反应是很重要的有机化学反应,可以用来合成许多有机化合物。
因此,对烯烃的亲电加成反应的研究具有重要的理论和实际意义。
- 1 -。
烯烃亲电加成通常遵循下列规则烯烃亲电加成是有机化学中一种重要的反应类型,其反应规律主
要表现在烯烃与亲电试剂发生加成反应时的化学变化过程中。
在烯烃
亲电加成的反应机理中,烯烃中的π电子与亲电试剂中的δ+电子互
相吸引,形成中间体并进一步转化成产物。
下面我们来详细了解一下
关于烯烃亲电加成的规则。
首先,烯烃亲电加成反应中的烯烃必须是不对称的,即二重键两
侧的基团不相同。
如果两侧基团相同,那么产生的中间体和产物将是
对称的,反应无法进行。
其次,烯烃亲电加成反应中的亲电试剂通常都是氢、卤素、水、醇、醛、酮等带正电荷的分子。
这些分子通常与烯烃之间的相互作用,会击中烯烃的云层上一侧的π电子,从而产生一个正电荷中间体。
而后,对于烯烃中的不同类型反应基团(如烷基、烷基、烃基等),其亲电反应程度可能会有所不同。
比如说烷基对于亲电试剂的
反应性就比较差,而烷基则相对亲电试剂更加具有亲和力。
另外,烯烃亲电加成反应还具有顺反异构体选择性。
精确地来说,亲电试剂会优先与烯烃上的顺式二重键反应,因为反应中位于同一平
面的烷基会产生键阻力,抑制反应的进行。
如果存在一侧的顺式二重键,那么反应就会发生在这一侧而并不是整个烯烃分子。
最后,总的来说,烯烃亲电加成反应是一种灵活多变,具有广泛应用前景的有机反应。
深入理解其反应规律,将有助于我们设计更加高效的新型有机合成路线,从而推动有机化学领域的发展。
烯烃亲电加成需要注意什么烯烃亲电加成是一个重要的有机化学反应,它在有机合成中具有广泛的应用。
在这个反应中,烯烃作为亲电受体与亲电试剂发生加成反应,形成一个新的碳碳单键。
这个反应可以用于构建碳骨架,生成新的化合物,同时也能实现分子中官能团的转化。
但在进行烯烃亲电加成反应时,需要注意以下几个方面。
首先,选择适当的亲电试剂。
亲电试剂是引发烯烃加成反应的关键。
在选择亲电试剂时,需要考虑其稳定性、亲电性以及反应条件的适用性。
亲电试剂可以是有机物中含有电位较高的阳离子,如卤代烷、烯烃、卤代烃等。
另外,还可以是金属化合物,如金属卤化物、金属有机化合物等。
选择适当的亲电试剂可以确保反应的高效性和选择性。
其次,要注意烯烃的立体化学。
烯烃分子中的碳碳双键可以存在不同的立体异构体,如顺式异构体和反式异构体。
在烯烃亲电加成反应中,不同的立体异构体可能会产生不同的产物。
因此,在进行烯烃亲电加成反应时,需要认识到立体异构体的存在,并根据需要选择适当的立体异构体进行反应。
第三,在反应过程中要控制反应条件。
反应条件包括温度、溶剂、反应时间等。
温度的选择要考虑亲电试剂的稳定性和反应的速率。
溶剂的选择要充分溶解反应物,并提供合适的溶剂极性以促进反应的进行。
反应时间的长短要根据具体情况选择,以确保反应的完全性和产率的最大化。
第四,在反应中要注意产物的稳定性。
烯烃亲电加成反应可以生成各种不同的产物,其中一些产物可能不稳定,容易发生进一步的反应。
为了防止这种进一步的反应发生,需要及时对产物进行处理,如加入稳定剂、降低反应温度等。
最后,要进行适当的反应监测和分析。
反应结束后,需要对反应产物进行分析和表征,以确定产物的结构和纯度。
常用的分析方法包括核磁共振(NMR)和质谱(Mass spectrometry)。
这些分析方法可以帮助确定反应的产物和副产物,以及反应的选择性和产率。
总之,烯烃亲电加成是一个重要的有机化学反应,通过合理选择亲电试剂和优化反应条件,可以实现高效性和选择性的反应。