亲电加成反应亲电加成反应
- 格式:ppt
- 大小:612.50 KB
- 文档页数:15

《有机化学反应类型》亲电加成实例有机化学反应类型——亲电加成实例在有机化学的广阔领域中,亲电加成反应是一类非常重要的反应类型。
亲电加成反应是指不饱和键(如双键或三键)的电子云密度较高,容易受到亲电试剂的进攻,从而发生加成反应。
接下来,让我们通过一些具体的实例来深入了解亲电加成反应。
首先,我们来看看乙烯与溴的加成反应。
乙烯分子中含有碳碳双键,双键上的电子云密度相对较高。
溴分子在接近乙烯时,会在一定条件下发生极化,形成溴正离子和溴负离子。
溴正离子作为亲电试剂进攻乙烯的双键,形成一个环状的溴鎓离子中间体。
随后,溴负离子进攻这个中间体,最终生成 1,2-二溴乙烷。
这个反应的化学方程式可以表示为:CH₂=CH₂+ Br₂ →CH₂BrCH₂Br从反应机理来看,亲电加成反应通常分为两步。
第一步是亲电试剂进攻不饱和键,形成一个不稳定的中间体;第二步是负离子或者其他亲核试剂进攻中间体,完成加成过程。
再比如,丙烯与氯化氢的加成反应。
丙烯分子中由于甲基的存在,双键上的电子云分布不均匀,导致双键的一端电子云密度相对较高,另一端相对较低。
当氯化氢接近丙烯时,氢离子(亲电试剂)会优先加到电子云密度较高的一端,形成 2-氯丙烷。
其反应式为:CH₃CH=CH₂+HCl → CH₃CHClCH₃这个例子展示了亲电加成反应的区域选择性,即亲电试剂在进攻不饱和键时,会倾向于加到电子云密度较高的位置。
另外,乙炔与水的加成反应也是一个典型的亲电加成实例。
在硫酸汞和稀硫酸的催化作用下,乙炔首先与水发生加成反应生成乙烯醇,但乙烯醇极不稳定,会迅速发生分子内重排,转化为乙醛。
反应过程可以表示为:CH≡CH + H₂O → CH₂=CHOH (不稳定)→ CH₃CHO这一反应不仅体现了亲电加成的特点,还涉及到了后续的分子内重排过程。
亲电加成反应在有机合成中具有广泛的应用。
例如,通过对烯烃的亲电加成,可以引入各种官能团,从而合成出具有特定结构和性质的有机化合物。

举例说明亲电加成反应亲电加成反应啊,听起来是不是很高大上?但别担心,咱们今天就来好好聊聊这个化学反应,通过具体的例子,让大家都能明白它到底是怎么回事。
亲电加成反应,简单说,就是两个分子之间,一个带着正电或者部分正电(我们叫它亲电试剂),另一个呢,带着可以共享的电子对(我们叫它亲核部分),它们一碰头,嘿,就形成了新的化学键,两个分子就手拉手变成一个新分子了。
这个过程,就像是两个好朋友,一个带着礼物(正电或部分正电),另一个带着期待(电子对),一见面,礼物一送,关系就确定了,成了更紧密的一家子。
咱们举个例子来说明吧。
比如说,乙烯,这个大家伙在化学世界里可是个常客。
它有两个碳原子,中间连着两个双键,就像是两个好朋友手拉手,特别紧密。
但是呢,有一天,乙烯遇到了溴分子,溴分子就像是带着礼物的朋友,它有两个溴原子,每个溴原子都想找个伴儿,于是它们就带着部分正电,成了亲电试剂。
当乙烯遇到溴分子的时候,溴分子就像是被乙烯吸引住了,慢慢靠近。
乙烯的两个碳原子之间的双键,就像是两个好朋友之间的秘密通道,但是溴分子太想加入这个圈子了,于是它就试着用自己的部分正电去吸引乙烯上的一个电子对。
这一吸引可不得了,乙烯上的一个电子对被溴分子拉了过去,两个溴原子分别和乙烯的两个碳原子形成了新的化学键。
就像是两个新朋友,一个送出了礼物(部分正电),另一个接受了礼物(电子对),它们就成了好朋友,手拉手一起玩了。
这个过程,就是亲电加成反应。
乙烯和溴分子,通过这个过程,形成了一个新的分子,我们叫它1,2-二溴乙烷。
这个新分子,就像是乙烯和溴分子的孩子,继承了它们的特点,但又有自己的新面貌。
你可能会问,这个过程为什么会发生呢?其实啊,这就是化学反应的奥秘所在。
就像人与人之间有吸引力一样,分子之间也有吸引力。
而亲电加成反应,就是利用了这种吸引力,让两个分子能够紧紧地结合在一起,形成新的化学键。
这个过程,不仅仅是化学上的变化,更是一种美的体现。


化学反应中的亲电亲电加成反应机理解析化学反应中的亲电加成反应机理解析化学反应是物质之间发生变化的过程,其中亲电加成反应是一种常见的反应类型。
本文将对亲电加成反应的机理进行解析,帮助读者更好地理解这一化学过程。
一、亲电加成反应的定义和背景介绍亲电加成反应是指亲电子反应物(通常是亲核试剂)与另一个反应物(通常是含有π电子体系的亲电子试剂)之间形成新键的过程。
这种反应通常涉及到多个步骤和中间体,其具体机理可根据不同反应情况而异。
二、典型亲电加成反应的机理解析2.1 亲电加成反应的基本步骤亲电加成反应的机理通常涉及以下基本步骤:亲电子试剂的进攻,产生中间体,中间体的重排和解离,最终生成产物。
2.2 实例分析:亲电加成反应与烯烃的加成反应以烯烃与亲电子试剂发生加成反应为例,具体步骤如下:1)亲电子试剂(如卤素)先与烯烃中的π电子形成中间体。
2)中间体发生重排,形成更稳定的中间体。
3)最终中间体发生解离,生成加成产物。
2.3 亲电加成反应机理的变化与反应类型亲电加成反应并不是固定的,其机理和类型可以根据反应物的不同而有所变化。
一些常见的亲电加成反应类型包括酮与醛的亲电加成反应、烯烃与亲电子试剂的加成反应等。
三、亲电加成反应的应用亲电加成反应在有机合成中有着广泛的应用,可用于合成各种有机化合物。
例如,亲电加成反应被应用于制备药物、农药、化妆品等领域。
四、亲电加成反应的前景展望随着化学科学的发展,亲电加成反应仍然是有机化学领域一个重要的研究方向。
随着对反应机理的深入研究,人们对亲电加成反应的控制性和选择性进一步提高,将有助于开发新的合成方法和探索新的化学反应。
综上所述,亲电加成反应是一类重要的化学反应类型,通过亲电子试剂与亲电子试剂之间形成新键的过程来合成各种有机化合物。
亲电加成反应的机理可以根据不同的反应类型和反应物而有所变化,但其基本步骤包括亲电子试剂的进攻、中间体的形成、重排和解离。
亲电加成反应在有机合成和其他领域具有广泛的应用前景。


亲电加成反应难易顺序
亲电加成反应是一种化学反应,其中一个亲电试剂攻击并与一个电子负足以提供反应的亲核试剂结合。
这种反应的难易程度可以基于亲电试剂的亲电性和亲核试剂的亲核性来确定。
以下是亲电加成反应的难易顺序示例:
1. 亲电性高的亲电试剂和亲核性高的亲核试剂之间的反应通常比较易于进行。
例如,亲电性较高的卤代烃(如溴代烷)可以与亲核性较高的亚胺产生加成反应。
2. 亲电性适中的亲电试剂和亲核性适中的亲核试剂之间的反应可能要求更特殊的条件或催化剂。
例如,羧酸和醇可以进行酯化反应,其中酸催化剂帮助推动反应。
3. 亲电性较低的亲电试剂和亲核性较低的亲核试剂之间的反应可能是较困难的。
这种情况下,通常需要更强的条件或更特殊的催化剂。
例如,酮和亚胺之间的加成反应通常需要更高的温度和酸性条件。
需要注意的是,亲电性和亲核性不是绝对的值,而是相对于其他分子或试剂而言的。
此外,反应的难易程度还受到其他因素的影响,如溶剂、温度和反应物的浓度等。
因此,上述顺序仅供参考,具体的反应难易程度可能因具体情况而有所不同。
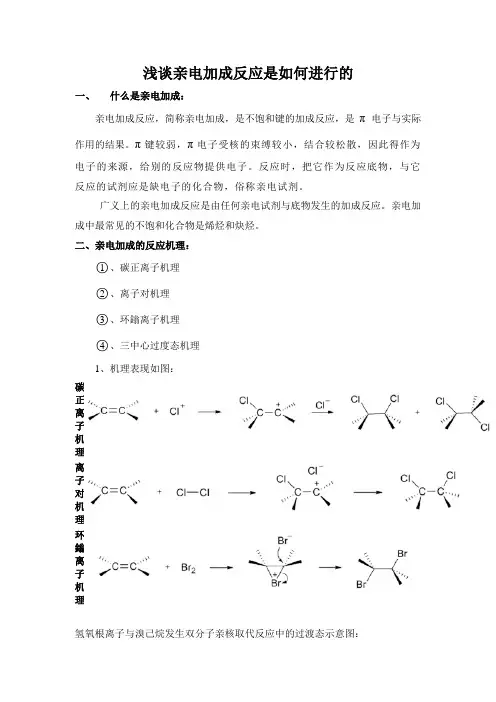
浅谈亲电加成反应是如何进行的一、什么是亲电加成:亲电加成反应,简称亲电加成,是不饱和键的加成反应,是π电子与实际作用的结果。
π键较弱,π电子受核的束缚较小,结合较松散,因此得作为电子的来源,给别的反应物提供电子。
反应时,把它作为反应底物,与它反应的试剂应是缺电子的化合物,俗称亲电试剂。
广义上的亲电加成反应是由任何亲电试剂与底物发生的加成反应。
亲电加成中最常见的不饱和化合物是烯烃和炔烃。
二、亲电加成的反应机理:○1、碳正离子机理○2、离子对机理○3、环鎓离子机理○4、三中心过度态机理1、机理表现如图:碳正离子机理离子对机理环鎓离子机理氢氧根离子与溴己烷发生双分子亲核取代反应中的过渡态示意图:2、反应采取哪种机理进行与亲电试剂和不饱和化合物的性质、溶剂的极性和过渡态的稳定性等有很大的关系:一般来说,卤素加成反应中,溴与烯烃的加成反应主要按照环鎓离子中间体机理进行,而氯与烯烃的加成反应主要按照碳正离子机理和离子对机理进行。
(这主要是因为两种卤素原子电负性和原子半径不同,溴的孤电子对容易和碳正离子P轨道重叠,而氯则不同。
)3、不同的机理也会产生立体选择性不同的产物:碳正离子机理得到顺式加成和反式加成产物的混合物,离子对机理得到的是顺式加成产物,而环鎓离子机理得到的是反式加成产物。
对不对称的亲电加成反应来讲,反应一般符合马氏规则,产物具有区域选择性。
但双键碳上连有吸电子基或以有机硼化合物做亲电试剂时,产物是反马氏规则的。
4、亲电试剂进攻芳香环时,主要发生的不是亲电加成反应,而是亲电芳香取代反应。
三、主要的亲电加成反应类型:1、烯烃:卤素加成反应、加卤化氢反应、水合反应、氢化反应、羟汞化反应、硼氢化-氧化反应、Prins反应、以及与硫酸、次卤酸、有机酸、醇和酚的加成反应2、炔烃:卤素加成反应、加卤化氢反应以及水合反应。
(由于SP碳原子的电负性比SP2的碳原子的电负性强,与电子结合的更为紧密,所以炔烃的亲电加成反应一般要比烯烃的慢。

亲电反应和亲核反应的区别亲电反应和亲核反应的区别以及区分方法:一、亲电反应:亲电反应指缺电子(对电子有亲和力)的试剂进攻另一化合物电子云密度较高(富电子)区域引起的反应。
亲电反应在机理上可分为三类:1、亲电加成反应,2、亲电取代反应,3、亲电重排反应。
亲电反应,顾名思义是亲电试剂在化学反应中取代其它官能团的一种反应类型,其常发生于芳香族类化合物中,亲电试剂从名字上可以理解为缺少电子的基团或原子,由于缺少电子,容易进攻反应物上带部分负电荷的位置,由这类亲电试剂进攻而发生发反应称为亲电反应.常见的亲电试剂有:H+、Cl+、Br+等带正电荷试剂或BF3、AlCl3等路易斯酸二、新核反应:电负性低的亲核基团向反应底物中的带正电的部分进攻而使反应发生,这种反应为亲核反应。
由亲核试剂如HO、:NR3、CN、H2N、…等。
1、与有机分子相互作用而发生的取代反应,称为亲核取代反应。
2、由亲核试剂HCN、H2O、丙二酸二乙酯等与世轭不饱和醛或酮进行的加成反应称亲核加成反应。
在《基础有机化学》中指出,亲核试剂是电子对的给予体,它在化学反应过程中以给出电子或共用电子的方式和其他分子或离子生成共价键.亲核试剂通常是路易斯碱,例如,HO—、RO—、Cl—、Br—、CN—、R3N:、H2O、ROH等。
多重键的π电子对也被看作是亲核试剂,能提供电子与反应物的缺电子部分形成新键的试剂,反应试剂在反应过程中,对与之相互作用的原子或体系给予或共享电子对者,称为亲核试剂②亲电反应综上所述,两者的区别是:亲核反应通常发生于卤代烃,羟醛缩合类反应当中,羰基碳正电性强的活性强,空间阻碍小的活性强,连有吸电子基可使正电性加强,推电子基减弱,这部分不会考活性比较的,重点是亲核取代。
而亲电反应一般发生在亲电加成中,并且是反式加成,加成中间体为卤桥正离子,反应是分步进行的。


亲电加成反应名词解释亲电加成反应是有机化学中常见的一种化学反应,是指亲电试剂与一个π电子体系发生加成反应,形成新的化学键。
该反应是有机合成中的重要工具,常用于合成复杂有机分子。
以下是对亲电加成反应的详细解释。
1. 亲电加成反应的定义亲电加成反应指的是一个亲电试剂与一个π电子体系发生加成反应,形成新的化学键。
在该过程中,亲电试剂通过与π键上的π电子形成新的σ键,从而改变原有分子结构。
2. 亲核和亲电试剂在亲电加成反应中,通常存在两种基本类型的试剂:一种是具有孤对或自由基结构上富余或富集了一对非共用原子轨道(通常为孤对轨道)或自由基轨道(通常为非共用原子轨道)而具有较强核性和较强求核性质;另一种则是具有σ键上富余了正荷或正荷分布较大而具有较强正荷性质和较强求荷性质。
前者被称为“异极物”,后者被称为“极性物”。
3. 亲电加成反应的机理亲电加成反应一般遵循亲电试剂的进攻性和π电子体系的亲核性。
具体来说,亲电试剂通过与π键上的π电子形成新的σ键,从而改变原有分子结构。
这个过程可以分为三个步骤:进攻步骤、形成新键步骤和离去步骤。
3.1 进攻步骤在进攻步骤中,亲电试剂中带有正荷的原子或基团通过与π键上孤对或自由基轨道上的π电子形成新的σ键。
这一过程中,正荷原子或基团被称为“进攻物种”。
3.2 形成新键步骤在形成新键步骤中,由于正荷原子或基团与π键上孤对或自由基轨道上的π电子发生相互作用而形成了新的σ键。
这一过程是整个反应中最关键和最决定性的一步。
3.3 离去步骤在离去步骤中,离去基团从反应物分子中离去,并带走一对非共用原子轨道上富余了正荷而具有较强正荷性质的正荷。
这一过程一般是通过负离子的形式进行的。
4. 亲电加成反应的应用亲电加成反应在有机合成中有着广泛的应用。
通过选择合适的亲电试剂和π电子体系,可以实现多样化的化学转化。
常见的亲电加成反应包括醛和酮与亲核试剂发生加成反应、烯烃与亲核试剂发生加成反应等。
4.1 醛和酮与亲核试剂发生加成反应醛和酮是常见的有机化合物,它们可以通过与亲核试剂发生亲电加成反应,形成新的碳-碳键或碳-氧键。
化学反应中的亲核亲电加成反应机理探讨化学反应是物质之间发生变化的过程,其中亲核亲电加成反应是一类常见的反应机理。
本文将探讨亲核亲电加成反应的机理以及相关实例。
一、亲核亲电加成反应的机理亲核亲电加成反应是一种化学反应机理,在该反应中,亲核试剂和亲电试剂通过共价键形成新的化学键。
这种反应机理常见于酰基、亚胺、酮等官能团之间的化学反应。
亲核试剂是具有亲核性质的化合物,通常带有孤立电子对或负电荷。
亲电试剂则是具有亲电性质的化合物,通常带有正电荷或部分正电荷。
亲核试剂的亲核性质使其可以攻击亲电试剂中的亲电中心,从而形成新的化学键。
亲核亲电加成反应的机理可以分为三个步骤:亲核试剂的亲核性攻击、共价键的形成和负电荷的转移。
1. 亲核试剂的亲核性攻击:亲核试剂中的亲核性质使其攻击亲电试剂中的亲电中心,常见的亲电中心包括氢原子、碳原子和电子不足的原子。
2. 共价键的形成:亲核试剂攻击亲电中心后,形成新的化学键。
这种化学键通常是通过共用电子对的形式形成的。
3. 负电荷的转移:在形成新的化学键后,部分电荷会从亲核试剂转移到亲电试剂上,使亲电试剂带有正电荷或部分正电荷。
亲核亲电加成反应的机理可以通过一系列实验和计算验证。
通过观察反应物和产物的结构和性质变化,可以确定亲核试剂攻击亲电中心的位置和方式。
同时,分子模拟和量子化学计算方法也可以用来研究和预测亲核亲电加成反应的机理。
二、亲核亲电加成反应的实例亲核亲电加成反应在有机合成中有着广泛的应用。
以下是一些常见的亲核亲电加成反应实例:1. Michael加成反应:该反应是以亲核试剂为亮点试剂,亲电试剂为含有α,β-不饱和酮或醛的化合物。
亲核试剂通过攻击亲电中心,形成新的碳碳键。
2. Aldol加成反应:该反应以亲核试剂为含有羰基的化合物,亲电试剂为醛或酮。
亲核试剂中的羰基攻击亲电中心,形成新的碳碳键。
3. Grignard反应:该反应以亲核试剂为Grignard试剂(一种具有亲核性质的有机锂或有机镁化合物),亲电试剂为卤代烷或羰基化合物。