亲电加成
- 格式:doc
- 大小:81.50 KB
- 文档页数:6


亲电加成三分子机理以亲电加成三分子机理为标题,本文将介绍亲电加成反应的机理和三分子反应的特点。
亲电加成反应是有机化学中常见的一类反应,它是指亲电试剂与亲核试剂之间的反应,生成新的化学键。
亲电试剂是具有正电荷或部分正电荷的化合物,如卤代烃、羰基化合物等;亲核试剂则是具有孤对电子或负电荷的化合物,如醇、胺等。
亲电加成反应可以分为两步:首先是亲电试剂与亲核试剂之间的加成反应,生成一个中间体;然后中间体进一步发生负离子或亲核试剂的加成反应,生成最终的产物。
亲电加成反应的机理可以分为两种类型:Sn1型和Sn2型。
Sn1型反应是指亲电试剂与亲核试剂之间的反应发生在两个步骤中的第一步,形成一个稳定的中间离子。
这种反应通常发生在亲电试剂的反应速率决定步骤比较慢的情况下,例如亲电试剂是一个烷基卤代物或醇酚的酯化反应。
Sn2型反应是指亲电试剂与亲核试剂之间的反应发生在一个步骤中,没有稳定的中间离子生成。
这种反应通常发生在亲电试剂的反应速率决定步骤比较快的情况下,例如亲电试剂是一个烷基卤代物或醇酚的亲核取代反应。
三分子反应是指反应物中有三个分子参与的化学反应。
与二分子反应相比,三分子反应的反应机理更加复杂,因为需要同时考虑三个分子之间的相互作用。
在三分子反应中,通常会涉及到一系列复杂的中间体的形成和解离步骤。
三分子反应的速率通常比较低,因为反应物之间的相互作用和取向要求较高。
亲电加成三分子机理的研究是有机化学领域的重要课题之一。
通过研究亲电加成反应的机理和控制因素,可以设计合成新的有机化合物,拓展化学反应的应用领域。
在实际应用中,研究人员可以通过选择适当的反应条件、催化剂和溶剂等,来调控亲电加成反应的速率和选择性,从而实现对产物的控制。
亲电加成反应是有机化学中重要的反应类型,其机理涉及到亲电试剂和亲核试剂之间的相互作用和中间体的形成与解离。
而三分子反应则是一类涉及到三个分子的复杂反应,其速率和选择性的控制较为困难。
研究亲电加成三分子机理对于有机合成化学的发展具有重要意义,将有助于开发新的合成方法和化合物。

举例说明亲电加成反应亲电加成反应啊,听起来是不是很高大上?但别担心,咱们今天就来好好聊聊这个化学反应,通过具体的例子,让大家都能明白它到底是怎么回事。
亲电加成反应,简单说,就是两个分子之间,一个带着正电或者部分正电(我们叫它亲电试剂),另一个呢,带着可以共享的电子对(我们叫它亲核部分),它们一碰头,嘿,就形成了新的化学键,两个分子就手拉手变成一个新分子了。
这个过程,就像是两个好朋友,一个带着礼物(正电或部分正电),另一个带着期待(电子对),一见面,礼物一送,关系就确定了,成了更紧密的一家子。
咱们举个例子来说明吧。
比如说,乙烯,这个大家伙在化学世界里可是个常客。
它有两个碳原子,中间连着两个双键,就像是两个好朋友手拉手,特别紧密。
但是呢,有一天,乙烯遇到了溴分子,溴分子就像是带着礼物的朋友,它有两个溴原子,每个溴原子都想找个伴儿,于是它们就带着部分正电,成了亲电试剂。
当乙烯遇到溴分子的时候,溴分子就像是被乙烯吸引住了,慢慢靠近。
乙烯的两个碳原子之间的双键,就像是两个好朋友之间的秘密通道,但是溴分子太想加入这个圈子了,于是它就试着用自己的部分正电去吸引乙烯上的一个电子对。
这一吸引可不得了,乙烯上的一个电子对被溴分子拉了过去,两个溴原子分别和乙烯的两个碳原子形成了新的化学键。
就像是两个新朋友,一个送出了礼物(部分正电),另一个接受了礼物(电子对),它们就成了好朋友,手拉手一起玩了。
这个过程,就是亲电加成反应。
乙烯和溴分子,通过这个过程,形成了一个新的分子,我们叫它1,2-二溴乙烷。
这个新分子,就像是乙烯和溴分子的孩子,继承了它们的特点,但又有自己的新面貌。
你可能会问,这个过程为什么会发生呢?其实啊,这就是化学反应的奥秘所在。
就像人与人之间有吸引力一样,分子之间也有吸引力。
而亲电加成反应,就是利用了这种吸引力,让两个分子能够紧紧地结合在一起,形成新的化学键。
这个过程,不仅仅是化学上的变化,更是一种美的体现。


亲电加成反应难易顺序
亲电加成反应是一种化学反应,其中一个亲电试剂攻击并与一个电子负足以提供反应的亲核试剂结合。
这种反应的难易程度可以基于亲电试剂的亲电性和亲核试剂的亲核性来确定。
以下是亲电加成反应的难易顺序示例:
1. 亲电性高的亲电试剂和亲核性高的亲核试剂之间的反应通常比较易于进行。
例如,亲电性较高的卤代烃(如溴代烷)可以与亲核性较高的亚胺产生加成反应。
2. 亲电性适中的亲电试剂和亲核性适中的亲核试剂之间的反应可能要求更特殊的条件或催化剂。
例如,羧酸和醇可以进行酯化反应,其中酸催化剂帮助推动反应。
3. 亲电性较低的亲电试剂和亲核性较低的亲核试剂之间的反应可能是较困难的。
这种情况下,通常需要更强的条件或更特殊的催化剂。
例如,酮和亚胺之间的加成反应通常需要更高的温度和酸性条件。
需要注意的是,亲电性和亲核性不是绝对的值,而是相对于其他分子或试剂而言的。
此外,反应的难易程度还受到其他因素的影响,如溶剂、温度和反应物的浓度等。
因此,上述顺序仅供参考,具体的反应难易程度可能因具体情况而有所不同。

取代反应与亲电加成取代反应与亲电加成是有机化学中两种常见的反应类型。
它们在有机合成中具有重要的地位,可以用于合成各种有机化合物。
本文将分别介绍这两种反应类型的基本概念、机理和应用。
一、取代反应取代反应是指一个原子或官能团被另一个原子或官能团所取代的反应。
这种反应类型在有机化学中非常常见,例如烷基卤化反应、芳香族取代反应等。
其中,烷基卤化反应是最基本的取代反应类型之一,它的机理可以用SN1和SN2两种机理来解释。
SN1机理是指离子型取代反应,它的反应步骤包括离子化、亲核攻击和脱离反应。
SN2机理是指亲核取代反应,它的反应步骤包括亲核攻击和脱离反应。
这两种机理的选择取决于反应物的结构和反应条件。
取代反应在有机合成中有广泛的应用,例如合成醇、醛、酮、酸等有机化合物。
此外,取代反应还可以用于制备药物、农药、染料等化学品。
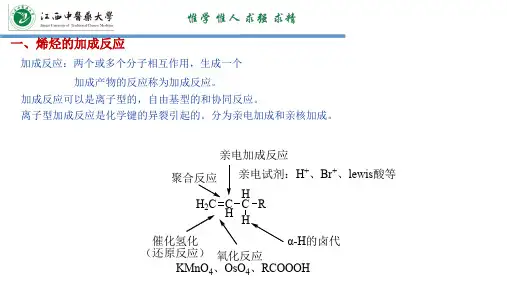
二、亲电加成亲电加成是指亲电性物质与双键或三键之间的反应。
这种反应类型在有机化学中也非常常见,例如酰基化反应、烯烃加成反应等。
其中,酰基化反应是最基本的亲电加成反应类型之一,它的机理可以用酸催化和碱催化两种机理来解释。
酸催化机理是指亲电性物质与双键之间的反应,它的反应步骤包括亲电攻击、质子转移和消除反应。
碱催化机理是指亲电性物质与三键之间的反应,它的反应步骤包括亲电攻击、负离子中间体形成和质子转移。
亲电加成在有机合成中也有广泛的应用,例如合成酯、醛、酮、酸等有机化合物。
此外,亲电加成还可以用于制备高分子材料、涂料、塑料等化学品。
取代反应和亲电加成是有机化学中两种常见的反应类型。
它们在有机合成中具有重要的地位,可以用于合成各种有机化合物。
熟练掌握这两种反应类型的基本概念、机理和应用,对于有机化学的学习和研究都具有重要的意义。



亲电加成反应名词解释亲电加成反应是有机化学中常见的一种化学反应,是指亲电试剂与一个π电子体系发生加成反应,形成新的化学键。
该反应是有机合成中的重要工具,常用于合成复杂有机分子。
以下是对亲电加成反应的详细解释。
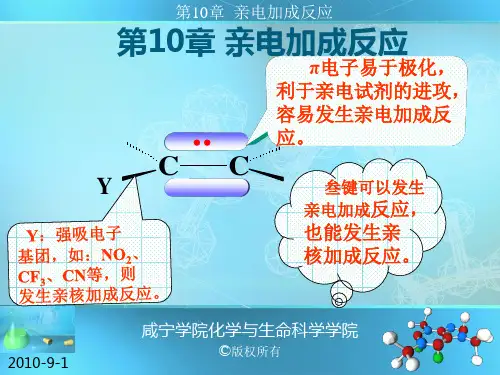
1. 亲电加成反应的定义亲电加成反应指的是一个亲电试剂与一个π电子体系发生加成反应,形成新的化学键。
在该过程中,亲电试剂通过与π键上的π电子形成新的σ键,从而改变原有分子结构。
2. 亲核和亲电试剂在亲电加成反应中,通常存在两种基本类型的试剂:一种是具有孤对或自由基结构上富余或富集了一对非共用原子轨道(通常为孤对轨道)或自由基轨道(通常为非共用原子轨道)而具有较强核性和较强求核性质;另一种则是具有σ键上富余了正荷或正荷分布较大而具有较强正荷性质和较强求荷性质。
前者被称为“异极物”,后者被称为“极性物”。
3. 亲电加成反应的机理亲电加成反应一般遵循亲电试剂的进攻性和π电子体系的亲核性。
具体来说,亲电试剂通过与π键上的π电子形成新的σ键,从而改变原有分子结构。
这个过程可以分为三个步骤:进攻步骤、形成新键步骤和离去步骤。
3.1 进攻步骤在进攻步骤中,亲电试剂中带有正荷的原子或基团通过与π键上孤对或自由基轨道上的π电子形成新的σ键。
这一过程中,正荷原子或基团被称为“进攻物种”。
3.2 形成新键步骤在形成新键步骤中,由于正荷原子或基团与π键上孤对或自由基轨道上的π电子发生相互作用而形成了新的σ键。
这一过程是整个反应中最关键和最决定性的一步。
3.3 离去步骤在离去步骤中,离去基团从反应物分子中离去,并带走一对非共用原子轨道上富余了正荷而具有较强正荷性质的正荷。
这一过程一般是通过负离子的形式进行的。
4. 亲电加成反应的应用亲电加成反应在有机合成中有着广泛的应用。
通过选择合适的亲电试剂和π电子体系,可以实现多样化的化学转化。
常见的亲电加成反应包括醛和酮与亲核试剂发生加成反应、烯烃与亲核试剂发生加成反应等。
4.1 醛和酮与亲核试剂发生加成反应醛和酮是常见的有机化合物,它们可以通过与亲核试剂发生亲电加成反应,形成新的碳-碳键或碳-氧键。
教学目标:反应机理的形成和烯烃亲电加成反应机理。
教学重点:溴的反式加成和马尔科夫尼科夫规律的解释。
教学安排:F
—>F4;40min
1,F3
反应机理的建立:对反应进行研究,积累了一些实验现象和事实,根据化学知识进行理论假设,提出可能的反应的一些基元反应步骤,能圆满地解释现有的实验现象,并能予测可能发生的现象,这种理论假设称为反应机理。
实践中发现新的现象不能被反应机理解释,要对原有的机理进行补充,修改、甚至重新进行理论假设,提出新的机理。
反应机理是相对的,是在发展的。
一、烯与溴的加成反应机理——分步、反式的亲电加成机理。
1.烯烃与溴反应,积累了下列实验事实:
1)干燥乙烯通入无水的溴的四氯化碳溶液中,红色不褪去,当加入几滴水后,溴的颜色迅速褪去。
2)在玻璃瓶中反应很顺利,放在内壁涂了石腊的玻璃容器中,反应不易进行。
3)乙烯分别通入含有NaCl、NaI和NaNO3的溴的水溶液中,不仅得到1,2-二溴乙烷,还分得到了1-氯-2-溴已烷,1-氯-2-碘乙烷和硝酸-2-溴乙酯:
4)乙烯与溴反应分别在甲醇和水溶液中反应,还得了1-甲氧基-2-溴乙烷和2-溴乙醇:
5)环烯烃与溴在四氯化碳等非极性溶液中加成反应得到反式-1,2-二溴环烷烃。
2.分析现有实验现象:
实验事实(1)和(2)说明在无光照射条件下,烯与溴反应需要极性条件,说明反应不是自由基型反应,而是离子型的反应。
实验事实(3)和(4)可假设反应分步进行。
先加成上一个Br+,然后亲核性基团竞争加到双键的另一个碳原子上。
实验事实(5)能假定第一步从双键的一侧加上一个Br+,而双键两个碳原子的相对位置没有变化,某种程度上保持双键的性质,亲核性基团从溴的对面(或双键的另一侧)进攻双键的另一个碳原子,完成了反应。
这种假设符合烯烃π键电子密度高,易流动的特征。
由此提出烯烃加溴反应经过环状溴正离子(缺字离子)的分步机理。
以乙烯为例说明:溴分子接近乙烯时,在双键电子密度高的电场作用下,使溴分子产生的σ健极化加大。
靠近π
电子一端的溴原子带有部分正电荷,别一溴原子带等量负电荷,烯溴越接近,互相极化程度越大,近到一定程度形成π络合物,然后溴的σ键断裂形成三元环溴缺字离子:
形成溴缺字离子是合理的,Br原子半径大,有孤对电子,在π电子偏到一个碳原子上与Br成键的同时,孤对电子与双键的另一碳原子成键,能量比BrCH2-CH2+的能量低,较稳定;三元环缺字离子的键很弱(三元环是弯曲键)第二步,Br-只能从空间位阻小的缺字离子Br 的对面进攻缺字离子的两个碳中的一个,最后得到反式加成产物:
在第二步Br-进攻时,若Cl-、I-、-ONO2等在在,会与Br-竞争与缺字离子反应,形成实验事实(3)中的产物:
若在水、醇溶液中反应,则有溶剂竞争反应:
若与次氯酸反应则形成下列中间体,并转化成产物:
在第二步反式进攻时,亲核的电负性基团进攻两个碳的机会相等.如环烯烃加溴反应,形成等量的(S,S)-二溴环烷烃和(R,R)-二溴环烷烃:
二、烯烃与质子酸的反应机理——对马尔科夫尼科夫规则的解释
烯烃与质子酸反应,两反应产物接近也形质子与烯的π络合物,质子体积小又无孤电子对,不能形成三元环氢离子,只能形成碳正离子中间体,质子与双键哪个碳结合,取决于那个碳原子上负电荷,确切地说取决于形成烃基碳正离子的稳定性,稳定性大的烃基碳正离子容易形成。
第二步亲核性负离子与烃基碳正离子结合完成反应:
按着静电学原理,带电体的稳定性随着电荷的分散而增大。
烷基是给电子基,碳正离子上连结的烷基越多,越稳定:
在烯烃加成反应中,第一步形成烷基碳正离子是反应控制步骤,整个加成反应速度取决于
烷基碳正离子的形成速度。
因此加成反应表现出符合马尔科夫尼科夫规律,而且烯烃不对称性越大,马尔科夫尼科夫规律越明显。
由此推导得到烯烃与质子酸加成反应的相对活性顺序为:
这与前面(F3节)中不同结构的C4烯烃与硫酸反应生成硫酸氢酯,需要的硫酸浓度不同是一致的。
可以这样来理解马氏加成规则:
不对称烯烃与质子酸的亲电加成,作为中间体是稳定的烷基碳正离子。
可以把马氏加成规则进一步扩展成普遍规律:
不对称烯烃与亲电试剂加成反应,试剂带部分正电荷的部分加到双键带部分负电荷碳上,而试剂带部分负电荷的部分加到双键带部分正电荷的碳上。
写成通式:
三、烯烃与质子酸反应的立体化学——碳原子的构型
在前面讨论了烯烃与溴的加成反应中,讨论了C原子的构型,在烯烃与质子酸加成反应中,C原子的构型如何?
形成烃基碳正离子中间体,其构型为平面结构,碳正离子的烃基还可以绕C-C+σ键旋转,因此可以得到两种构型的产物,为外消旋体。
四、关键词
亲电加成,反应机理,反式加成,马尔科夫尼科夫规律,溴缺字离子,竞争反应,碳原子构型,π-络合物,碳正离子的稳定性,反应控制步骤,烯烃与H+反应活泼性,碳原子的构型,外消旋体。