碳负离子缩合反应
- 格式:pptx
- 大小:2.06 MB
- 文档页数:137






碳正离子、碳负离子、自由基参与的化学反应应用化学09-2班 王竹青 29号一 碳正离子参加的反应含有一个外层只有 6 个电子的碳原子作为中心碳原子的正离子。
常见的碳正离子如下:(一)碳正离子的形成一般有三种方法产生碳正离子。
1 .由反应物直接生成 :RXRX与碳原子直接相连的原子或原子团带着一对成键电子裂解,产生碳正离子。
极性溶剂、Lewis 酸常有促进效果。
1.1 X=H 。
烃很少自动失去氢负离子,只有在强亲电试剂如Lewis 酸或其它稳定正离子的因素存在下才能发生这一反应。
CHCH 3CH 3H 3C3C CH 3CH 3H 3C+HAlCl 31.2 X=F 、Cl 、Br 或I 。
这是SN1异裂反应。
Lewis酸可加速这种电离作用。
CClCH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+HAlCl 4CH 3CH 3CH 2(CH 3)3C1.3 X=OTs 酯类衍生物。
OTs 是一个很好的离去基团,这类酯很易 解离。
1.4 X=OCOZ ,其中Z= Cl 、Br 或I ,其推动力是由于形成二氧化碳。
氯亚磺酸酯,X=OSOCl 也属于这一类。
其推动力是由于排除SO2。
COSOClRR R3C RRR+Cl+SO 21.5 X=H2O 或ROH 。
断裂是由醚ROR 中氧原子的质子化引起的。
1.6 X= N 2。
亚硝酸和伯胺的反应生成的重氮离子很容易分解成碳正离子,推动力是由于生成了氮气。
1.7 X=CO 。
当相应的正离子稳定的时候,某些羧酸先质子化,然后脱去羰基。
C CH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+OTs -+C OCOClR RRC R RR+Cl -CO2+OR'RH OR'RR +R'OH+N 2H +N 2+COH 2OCOH 2O++CO 1.8 X=CO2。
羧酸氧化脱羧,生成碳正离子和CO2。
RCOOAgBr 2R+Br+AgBr+CO 22 质子或其它阳离子与不饱和体系加成质子或其它阳离子与不饱和体系加成,留下的临碳原子带正电。



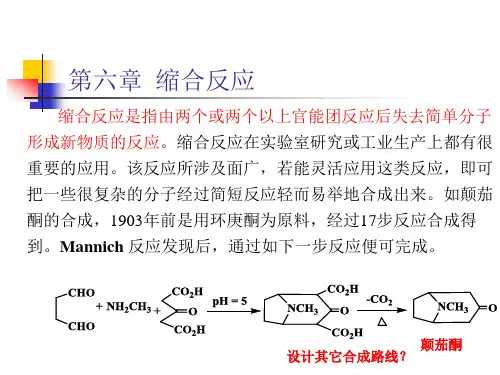

第15章碳负离子缩合反应一、选择题1.下列碳负离子中最稳定的是()。
[大连理工大学2004研]【答案】B【解析】连在碳负离子上的基团的吸电子能力越强,则碳负离子越稳定。
2.下列碳负离子最稳定的是()。
[中国科学院-中国科学技术大学2001研]【答案】D【解析】氯原子既有吸电子的诱导效应,又有给电子的超共轭效应,总的结果是吸电子的诱导效应大于给电子的超共轭效应,故(D)项的碳负离子最稳定。
3.与稀NaOH溶液反应得到()。
[武汉大学2002研]【答案】C【解析】在碱性条件下,醛的α-C形成碳负离子,与另一分子醛的羰基发生亲核加成反应,形成β-羟基醛。
4.按亲核性从强到弱的次序排列,哪一个是对的?()。
[上海大学2004研]【答案】B【解析】由于(d)的性质大家不熟悉,所以本题用排除法做较好。
比较有机锂化合物的亲核性关键在于比较碳负离子的碱性,碳负离子的碱性越强,其亲核性一般越强;而氮元素电负性较强,较之碳负离子,氮负离子的亲核性较弱。
二、填空题1.。
[大连理工大学2004研]【答案】【解析】在强碱作用下,活泼亚甲基变成碳负离子,与α,β-不饱和酮发生l,4加成反应。
2.按碱性增强的顺序排列以下各化合物:。
[武汉大学2002研]【答案】(B)>(A)>(C)【解析】碳负离子越不稳定,则碱性越强。
双键碳为sp2杂化,叁键碳为sp杂化,而饱和碳为sp3杂化,杂化轨道中含s成分越多,则吸引电子能力越强,其碳负离子越稳定,碱性越弱。
3.。
[浙江大学2003研]【答案】【解析】卤代烃与亚磷酸酯反应生成烷基亚磷酸酯,后者在NaH的作用下放出一分子氢气后生成烷基亚磷酸酯碳负离子:,该碳负离子具有很强的亲核性。
4.。
[浙江大学2003研]【答案】【解析】在碱作用下具有α-H的酮形成碳负离子,与苯甲醛发生羟醛缩合反应,生成α,β-不饱和酮。
5.。
[南京大学2003研]【答案】【解析】乙酰乙酸乙酯中的α氢先与碱作用生成碳负离子,碳负离子再与醛发生缩合反应生成产物。
碳正离子、碳负离子、自由基参与的化学反应应用化学09-2班 王竹青 29号一 碳正离子参加的反应含有一个外层只有 6 个电子的碳原子作为中心碳原子的正离子。
常见的碳正离子如下:(一)碳正离子的形成一般有三种方法产生碳正离子。
1 .由反应物直接生成 :RXRX与碳原子直接相连的原子或原子团带着一对成键电子裂解,产生碳正离子。
极性溶剂、Lewis 酸常有促进效果。
1.1 X=H 。
烃很少自动失去氢负离子,只有在强亲电试剂如Lewis 酸或其它稳定正离子的因素存在下才能发生这一反应。
CHCH 3CH 3H 3C3C CH 3CH 3H 3C+HAlCl 31.2 X=F 、Cl 、Br 或I 。
这是SN1异裂反应。
Lewis酸可加速这种电离作用。
CClCH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+HAlCl 4CH 3CH 3CH 2(CH 3)3C1.3 X=OTs 酯类衍生物。
OTs 是一个很好的离去基团,这类酯很易 解离。
1.4 X=OCOZ ,其中Z= Cl 、Br 或I ,其推动力是由于形成二氧化碳。
氯亚磺酸酯,X=OSOCl 也属于这一类。
其推动力是由于排除SO2。
COSOClRR R3C RRR+Cl+SO 21.5 X=H2O 或ROH 。
断裂是由醚ROR 中氧原子的质子化引起的。
1.6 X= N 2。
亚硝酸和伯胺的反应生成的重氮离子很容易分解成碳正离子,推动力是由于生成了氮气。
1.7 X=CO 。
当相应的正离子稳定的时候,某些羧酸先质子化,然后脱去羰基。
C CH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+OTs -+C OCOClR RRC R RR+Cl -CO2+OR'RH OR'RR +R'OH+N 2H +N 2+COH 2OCOH 2O++CO 1.8 X=CO2。
羧酸氧化脱羧,生成碳正离子和CO2。
RCOOAgBr 2R+Br+AgBr+CO 22 质子或其它阳离子与不饱和体系加成质子或其它阳离子与不饱和体系加成,留下的临碳原子带正电。
第15章碳负离子缩合反应15.1 复习笔记一、氢碳酸的概念和α氢的酸性氢碳酸的酸性强弱可用碳上的氢以正离子解离下来的能力表示,用pK a值来表示,值越小,酸性越强。
烷烃的酸性很弱。
烯丙位和苯甲位碳上的氢的酸性比烷烃强。
末端炔烃的酸性更强一些,环戊二烯亚甲基上的氢相对更活泼一些。
1.α氢的酸性与官能团直接相连的碳称为α碳,α碳上的氢称为α氢。
α氢以正离子解离下来的能力即为α氢的活性(酸性)。
通过测定α氢的pK a值或其与重氢的交换速率可以确定α氢的酸性强弱。
(1)α氢的酸性强弱取决于与α碳相连的官能团及其它基团的吸电子能力。
总的吸电子能力越强,α氢的酸性就越强。
一些常见基团的吸电子能力强弱次序排列如下:(2)α氢的酸性还取决于氢解离后的碳负离子(carbanion)结构的稳定性。
碳负离子的离域范围越大越稳定。
(3)分子的几何形状会影响α氢的酸性。
(4)与α氢的解离和介质的介电常数及溶剂化有关。
2.羰基化合物α氢的活性分析羰基的吸电子能力很强,因此羰基化合物的α氢都很活泼。
例如在NaOD—D20中,2-甲基环己酮的α氢均可被氘取代。
(1)羰基使α碳原子上的氢具有活泼性,是因为:①羰基的吸电子诱导效应;②羰基α碳上的碳氢键与羰基有超共轭作用。
(2)羰基旁所连的基团的不同导致了它们的α氢的活性也有差异。
可以从这些化合物本身的结构以及它们形成烯醇式后的结构来认识:含羰基化合物的α氢的酸性从大到小顺序:酰氯>醛>酮>酯>酰胺①在酰氯中,氯的存在增强了羰基对α碳的吸电子能力,从而也增强了α氢的活性。
同时氯的吸电子效应也使形成的烯醇负离子因负电荷分散而趋于稳定。
②在酯和酰胺中,烷氧基氧的孤电子对和氨基氮的孤电子对均可与羰基共轭而使体系变得稳定。
③酰胺氮上的孤电子对碱性较强,使共轭体系更加稳定,要解离α氢,形成烯醇负离子需要的能量更多,故酸性比酯还弱。
④当醛基中的氢被烷基代替后,由于烷基的空阻比氢大,从某种程度上讲阻碍了碱和氢的反应;另外,由于烷基对羰基具有给电子的超共轭作用,因此醛的α氢比酮的α氢活泼。
Knoevenagel缩合反应文献综述1.摘要Knoevenagel缩合反应是有机化学中较常见的一个反应。
本文在综合大量文献的成果基础上,简述了这一反应,分析了其可能的反应机理和影响反应进行的动力学、热力学因素,列举了此反应在有机合成方面的广泛应用,对Knoevenagel缩合反应的研究提出了新的展望。
2.正文2.1反应简述Knoevenagel缩合反应(脑文格反应;克诺维纳盖尔缩合反应;柯诺瓦诺格缩合反应;克脑文盖尔缩合反应),又称Knoevenagel反应:含有活泼亚甲基的化合物与醛或酮在弱碱催化下,发生失水缩合生成α,β-不饱和羰基化合物及其类似物。
图1 Knoevenagel缩合反应通式Z 基是吸电子基团,一般为 -CHO、-COR、-COOR、-COOH、-CN、-NO2等基团。
两个 Z 基团可以相同,也可以不同。
-NO2基团的吸电子能力很强,有一个就足以产生活泼氢。
常用的碱性催化剂有哌啶、吡啶、喹啉和其他一级胺、二级胺等。
常用的活泼亚甲基化合物有丙二酸二乙酯、米氏酸、乙酰乙酸乙酯、硝基甲烷和丙二酸等,但事实上任何含有能被碱除去氢原子的 C-H 键化合物都能发生此反应。
反应一般在苯或甲苯中进行,同时将产生的水分离出去,此法所用温度较低,产率高。
Knoevenagel 反应是对Perkin反应的改进,将酸酐改为活泼亚甲基化合物。
由于活泼氢的存在,使得弱碱作用下,能产生足够浓度的碳负离子进行亲核加成。
弱碱的使用避免了醛酮的自身缩合,因此除芳香醛外,酮和脂肪醛均能进行反应,扩大了适用范围。
Knoevenagel 反应是制备α,β-不饱和化合物的常用方法之一。
2.2 发现历史这个反应最早是由德国化学家亚瑟·汉斯(Arthur Hantzsch)发现的,1885年,他用乙酰乙酸乙酯、苯甲醛和氨反应,发现生成了对称的缩合产物 2,6-二甲基-4-苯基-1,4-二氢吡啶-3,5-二甲酸二乙酯,也生成了少量的 2,4-二乙酰基-3-苯基戊二酸二乙酯,这是有关 Knoevenagel 反应的最早纪录。