碳负离子反应110506ppt课件
- 格式:ppt
- 大小:2.08 MB
- 文档页数:103

第14章 碳负离子的反应——β-二羰基化合物§14.1 α-H 的酸性和互变异构14.1.1 α-H 的酸性 1、?-H 的酸性在有机化学中,与官能团直接相连的碳原子均称为?-C ;?-C 上的氢原子均称为?-H 。
?-H 以质子形式解离下来的能力,即为?-H 的活性或?-H 的酸性。
因此烃也可叫做氢碳酸。
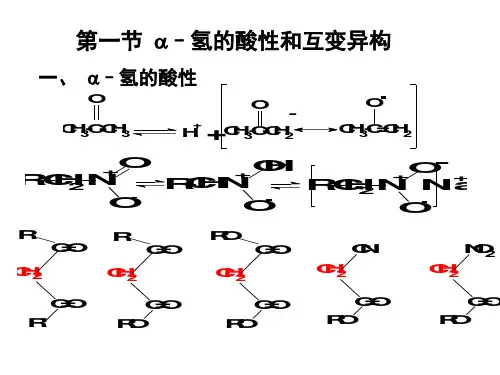
表14-1-1 常见化合物?-H 的p K a 值羧酸衍生物中的?-H 的活性一般比醛酮为弱,但酰氯中由于氯原子与羰基的共轭程度差且吸电子效应强,反而使其?-H 的酸性增强。
酸性大小: 酰氯>醛、酮>酯>酰胺 Cl :吸电子诱导>给电子共轭 O :给电子共轭>吸电子诱导 2、影响?-H 的酸性的因素1)?-C 所连接的官能团及其官能团的吸电子能力。
总的吸电子能力越强,?-H 的酸性就越大; 2)取决于氢解离后生成的碳负离子(carbanion)结构的稳定性。
负离子上电子的离域范围越大越稳定;3)分子的几何形状、介质的介电常数、溶剂等都有关系。
3、β-二羰基化合物α-H 的活性分析乙酰乙酸乙酯是一个典型的1,3-二羰基化合物,由于受两个羰基的吸电子作用,亚甲基上的H 特别活泼,和碱作用形成稳定的负离子。
负离子特别稳定是因为负离子可以同时和两个羰基发生共轭作用,具有比较广泛的离域范围。
烯醇负离子其他1,3-二羰基化合物情况相似,其他的吸电子基团如硝基、氰基等与羰基作用相同在含有氢的碳原子上连有两个吸电子基团的化合物都含有一个活泼的亚甲基,它们统称为含活泼亚甲基(氢 )的化合物。
β-二酮 β-羰基酸酯 丙二酸酯 氰乙酸酯 硝基乙酸酯 活泼氢化合物的双重反应性能: 碳负离子 烯醇负离子 氧负离子 一般情况下,这些物质在反应时可以看作是碳负离子对其它官能团的亲核加成反应。
14.1.2 酮式和烯醇式的互变异构可以看作是活泼H 可以在α-C 和羰基O 之间来回移动。
1、酸碱对互变平衡的影响痕量的酸、碱甚至是玻璃仪器都能促使平衡的快速建立。



第14章 碳负离子的反应——β-二羰基化合物§ α-H 的酸性和互变异构α-H 的酸性 1、-H 的酸性在有机化学中,与官能团直接相连的碳原子均称为-C ;-C 上的氢原子均称为-H; -H 以质子形式解离下来的能力,即为-H 的活性或-H 的酸性;因此烃也可叫做氢碳酸;表14-1-1 常见化合物-H 的p K a 值羧酸衍生物中的-H 的活性一般比醛酮为弱,但酰氯中由于氯原子与羰基的共轭程度差且吸电子效应强,反而使其-H 的酸性增强;酸性大小: 酰氯>醛、酮>酯>酰胺 Cl :吸电子诱导>给电子共轭 O :给电子共轭>吸电子诱导 2、影响-H 的酸性的因素1-C 所连接的官能团及其官能团的吸电子能力;总的吸电子能力越强,-H 的酸性就越大;2取决于氢解离后生成的碳负离子carbanion 结构的稳定性;负离子上电子的离域范围越大越稳定;3分子的几何形状、介质的介电常数、溶剂等都有关系; 3、β-二羰基化合物α-H 的活性分析乙酰乙酸乙酯是一个典型的1,3-二羰基化合物,由于受两个羰基的吸电子作用,亚甲基上的H 特别活泼,和碱作用形成稳定的负离子;负离子特别稳定是因为负离子可以同时和两个羰基发生共轭作用,具有比较广泛的离域范围;烯醇负离子其他1,3-二羰基化合物情况相似,其他的吸电子基团如硝基、氰基等与羰基作用相同在含有氢的碳原子上连有两个吸电子基团的化合物都含有一个活泼的亚甲基,它们统称为含活泼亚甲基氢 的化合物;β-二酮 β-羰基酸酯 丙二酸酯 氰乙酸酯 硝基乙酸酯 活泼氢化合物的双重反应性能: 碳负离子 烯醇负离子 氧负离子 一般情况下,这些物质在反应时可以看作是碳负离子对其它官能团的亲核加成反应;酮式和烯醇式的互变异构可以看作是活泼H 可以在α-C 和羰基O 之间来回移动;1、酸碱对互变平衡的影响痕量的酸、碱甚至是玻璃仪器都能促使平衡的快速建立; 1酸催化过程在酸催异构化过程中,酸首先与羰基氧原子作用形成盐,其共轭碱——水再夺取-H 形成烯醇; 2碱催化过程碳可以直接和α-H 结合,同时形成一个碳负离子;通过电子对的转移,碳上的负电荷转移到氧上,形成烯醇负离子;2、化合物的结构对互变平衡的影响通常,单羰基化合物中的烯醇式异构体含量很少;两个羰基被一个碳原子隔开的化合物;当同一碳原子上连有两个吸电子基团时,这样的化合物其酸性则明显增强;酮式中碳氧π键比烯醇式中碳碳π键更稳定-二羰基结构的化合物,在平衡状态下其烯醇式的含量较高;通常以平衡混合物的形式存在;例:乙酰乙酸乙酯三乙酮式% 烯醇式%这类化合物的烯醇式异构体具有较大稳定性的原因有二:①通过分子内氢键,形成稳定的六元环状化合物;②羟基氧上的未共用电子对,可以通过p-π共轭发生离域,使分子内能降低;4、异构化对化学性质的影响1与FeCl3的显色反应烯醇式含量多的物质;2与溴的四氯化碳溶液加成;3-H氘代快速确定-H 的个数;4构型变化;如-C是手性中心并且手性碳上有氢原子,会发生外消旋化;如-C不是手性中心则不会发生外消旋化;碳负离子形成及其基本原理1、碳负离子的形成及其稳定性碳负离子是以一个带有负电荷的碳为中心原子的中间体,是有机化学反应中常见的活性中间体;如甲基负离子、烯丙基负离子、苄基负离子、三苯甲基负离子等;碳负离子可以通过金属有机化合物异裂而产生;碳氢键的碳原子上存在吸电子基时易形成碳负离子;如:1内部条件能形成碳负离子的化合物从结构上讲,至少含有一个氢的碳原子的邻位要有一个活化基团,一⇨活化基团的作用:①由于其吸电子作用,使氢碳酸的酸性增加,而容易脱质子化;②使形成的C的负电荷离域而趋于稳定;22652除了要有一个活化基团外,分子中的其它基团的空间效应和电子效应对C—的形成和稳定性也有影响,其中空间阻碍影响最大;2外部条件有了一个带有活化基团的化合物后,还必须加入碱,才能把α-H交换下来,形成碳负离子;选择强度适合的碱,酸性弱的α-H要用强碱,反之用较弱的碱;在选择碱的时候,还要分清哪些碱是强亲质子性的与质子结合的能力,哪些碱是强亲核性的与碳正离子的结合能力,哪些是两种都有的;这是因为在形成C的过程中,碱可能进攻碳原子,也可能进攻质子氢;一般来说,亲核试剂的亲核性能大致与其碱性的强弱次序相对应;对具有相同进攻原子的亲核试剂,碱性愈强者,亲核性愈强;⇨下面列出常用碱的性能:1具有强亲质子和强亲核能力的碱:HO,CH3O,C2H5O,RS,CN等;2具有强亲质子弱亲核能力的碱:H,NH2;3具有强亲质子相当弱亲核性的碱:Et2N,C6H 5N,Me3Si-N;在形成碳负离子的外部因素中,还应指出的是溶剂的影响;假如溶剂的酸性比氢碳酸强的多的话,就不能产生很多的C,因为刚形成的碱性很强的C夺取溶剂的质子,又成为原来的化合物内返作用;一般应采用极性大但酸性弱的溶剂,即非质子溶剂;有以下几种配合:1t-BuOH,溶剂用t-BuOH或DMSO、THF;2NaNH2,溶剂用液氨或醚、苯、甲苯、1,2-二甲氧基烷苯等;3NaH、LiH,溶剂为苯、醚、THF等;4C6H53CNa,溶剂为苯基醚、液氨等;为了满足合成的需要,常常需要形成单一部位的烯醇盐;因此需要从形成碳负离子时的条件上加以控制:①动力学控制,形成碳负离子部位碳氢被碱提取质子的相对速度;一般在较低温度下和体积较大的碱时,易使碳负离子在位阻较小部位的碳氢键处形成;②热力学控制,两种碳负离子能相互转化并达到平衡,一般在较高温度、体积较小的碱条件下,取代基较多部位的碳氢键易于形成碳负离子如:2、碳负离子的反应C形成后虽然是共振稳定的具有很高的能量,可以发生多种亲核加成反应,重要的四类反应用通式表示如下:1与含羰基的化合物2酰基化反应:与羧酸及其衍生物的羰基发生亲核加成接着失去RO或Z形成β-酮酯或β-二酮,这是酯缩合型反应,总的结果是在C上带上一个酰基;3与烷基卤化物的反应4与活泼烯烃的加成反应§缩合反应Ⅰ——羟醛缩合见第11章醛与酮α-H的反应§缩合反应Ⅱ——Mannich反应Mannich反应甲醛与仲胺在弱酸性介质中亲核加成,再脱水形成正碳离子与醛酮、羧酸、酯、硝基化合物、腈的α-C,以及端炔、酚的邻、对位等具有负碳离子性质的位置偶联,称为Mannich反应,又称胺甲基化反应;1、反应通式2、Mannich反应机理3、Mannich反应举例Mannich反应在合成上的应用1、合成β-氨基酮衍生物例1写出合成路线2、制备,-不饱和酮例2甲基乙烯基酮的制备➢通过Mannich碱产生※弱酸性介质的作用:①使醛与胺亲核加成的产物脱水,形成C+;②质子化羰基使α-C 成为负离子;§缩合反应Ⅲ卤代反应——见第11章醛与酮α-H的反应3、卤仿反应酯的缩合反应1、Claisen缩合两个相同酯之间的缩合Claisen缩合举例:➢Claisen缩合机理1交叉酯缩合两个不同酯之间的缩合➢混合酯缩合举例:2、Dieckmann缩合分子内酯缩合二元酸酯若分子中的酯基被四个以上的碳原子隔开时,就发生分子内的酯缩合反应,形成五元环或六元环的酯,这种分子内的环化酯缩合反应称为狄克曼酯缩合;⇨对称二羧酸酯的Dieckmann 缩合⇨例:Dieckmann 缩合的可逆性在合成上的应用如两个酯基间只隔有三个或三个以下的碳原子时,就不能发生分子内的缩合;但这种二酸酯可以发生分子间缩合,或与不含-H的酯缩合,也均能得到环状羰基酯;如丁二酸二乙酯间的缩合:3、酮的酰基化酮酯缩合反应机理⇨不对称酮的酰基化4、β-二羰基化合物的互变异构现象5、酮或酯的酰基化反应在合成上的应用——制备β-二羰基型化合物1, 3-二羰基化合物➢1, 3-二羰基型化合物的反合成分析例 1反合成分析例 2反合成分析例 3反合成分析➢合成路线例2例3⇨1, 3 -二羰基化合物的烷基化反应例4§缩合反应Ⅳ复习1、羰基α位的反应——酰基化Claisen缩合, 交叉酯缩合,Dieckmann缩合和烷基化➢本节重点:羰基α位的酰基化和烷基化在合成上的应用2、酮式水解和酸式水解乙酰乙酸乙酯的制备及在合成中的应用合成等价物丙酮1、乙酰乙酸乙酯的合成乙酰乙酸乙酯−−−−→2、在合成中的应用1制备取代丙酮甲基酮类化合物➢扩展:制备环烷基甲基酮2制备甲基二酮类化合物➢扩展:制备2, 5-己二酮3通过酰基化制备β-二酮类化合物丙二酸二酯的制备及在合成中的应用合成等价物丙酮1、丙二酸二酯的合成丙二酸二酯−−−−→2、在合成中的应用1制备取代乙酸➢扩展:制备环烷基乙酸2制备二元羧酸羰基α位酯基的作用——活化、定位、引导断键例:比较以下两条合成路线,你认为哪种较好,为什么例 1分析并写出合成路线➢合成线路a➢合成线路b例 2分析并写出合成路线§缩合反应ⅤMichael加成碳负离子与,-不饱和羰基化合物发生的1,4-加成反应,叫做Michael反应;这是形成碳碳键的重要方法之一;1、反应通式2、反应机理Micheal加成后,再发生分子内的羟醛缩合或酯酮缩合,形成六元环状α,β不饱和酮或1,3-环己二酮;1、反应通式2、Robinson成环举例Knoevenagel反应在弱碱性催化下,醛酮与具有活泼亚甲基的化合物的缩合反应;常用的碱性催化剂有吡啶、哌啶、胺等;1、反应通式2、反应特点➢类似Aldol缩合;➢双活化基团的羰基化合物为烯醇负离子供体;➢弱碱催化一般为胺类化合物或吡啶;3、反应机理➢由于使用的是弱碱避免了醛酮自身的缩合,扩大了醛酮的使用范围;4、Knoevenagel反应举例Perkin反应类似Aldol缩合碱催化下,芳醛和酸酐反应生成-芳基-,-不饱和羧酸的反应;催化剂常用与酸酐相应的羧酸盐;1、反应通式➢最简单的Perkin 反应2、反应机理⇨当芳环上有吸电子基时加速反应进行,有推电子基时使反应难以进行;脂肪醛不能进行反应;⇨参加反应的酸酐必须具有至少两个-H;3、Perkin反应的应用香豆素一种重要香料Darzen反应强碱醇钠、氨基钠作用下,醛、酮与-卤代酸酯反应生成,-环氧酸酯的反应;1、反应通式2、反应机理3、Darzen反应的应用——合成环氧酸酯,合成比原料醛、酮多一个碳的醛、酮例1由环己酮转化成其他化合物例2由苯甲醛转化成其他化合物Reformatsky反应在惰性溶剂中,α-溴卤代酸酯、锌与醛或酮互相作用,得到β-羟基酸酯的反应称为瑞佛马斯基反应;如能进一步脱水,则生成,-不饱和酸酯;1、反应通式2、Reformatsky反应的特点及用途1该反应的历程与格氏合成类似;2有机锌试剂活性比格氏试剂小它不与酯进行加成;3有机锌试剂在空气中会自燃,因而不单独制备;4该反应可用以合成β—羟基酸酯、α,β—不饱和酸酯以及α,β—不饱和羧酸;⇨α-卤代酸酯的反应活性⇨有机锌试剂:镁、锂、铝试剂∙无水操作;∙反应在有机溶剂中进行,溶剂为惰性溶剂;∙锌粉需活化;3、Reformatsky反应的应用安息香缩合芳香醛在CN—催化下二聚为α-羟基酮的反应;安息香二苯乙醇酮1、反应通式2、反应机理⏹ 安息香的进一步反应——氧化和还原 ⏹ 二苯乙二酮重排 反应机理3、安息香缩合反应的应用§ 缩合反应ⅦWittig 反应及其合成上的应用 1、磷Ylide —Wittig 试剂➢ 不同类型的磷Ylide2、Wittig 反应A 、通式B 、反应机理C 、Wittig 反应举例D 、Wittig 反应的立体化学➢ 生成 E 型和Z 型混合烯烃;➢ 反应的立体选择性尚无规律可预测; Wittig 反应在合成中的应用 1、制备烯烃 ➢ 合成路线2、通过烯基醚引入醛基例: 3、Wittig 反应的改良——Wittig-Horner 反应Wittig 反应遇到的问题:副产物Ph 3P=O 较难除尽;⏹ Wittig-Horner 反应对底物的要求 ——碳负离子上必须连有一个稳定基团; ⏹ 几种类型的Wittig-Horner 试剂⏹ Wittig-Horner 反应与传统 Wittig 反应比较 4、硫内鎓盐硫ylides硫叶立德ylides 可与羰基化合物作用,而生成环氧类,反应性与磷酸或磷类叶立德 ylides 不同产生烯类;之所以会有这样不同的反应活性,在于磷一氧的键能比硫一氧的键能强; 硫及亚砜的叶立德Ylides,其反应活性介于亚砜和砜之间:硫的叶立德 ylides 反应时受动力学控制,从轴向位置进攻,即生成的环氧化合物以氧原子在横键为主:而亚砜的叶立德 ylides 反应时受热力学控制,即生成的环氧化合理以竖立键为主:§ 缩合反应Ⅷ缩合反应中区域选择性问题 1、不对称酮的烯醇负离子化2、通过烯醇锂盐或烯醇硅醚的“定向”羟醛缩合 烯胺的性质和在合成中的应用 1、烯胺和烯胺的制备Ylide Ylene Wittig 试剂邻位两性离子,有亲核性烯醇负离子的氮类似物2、烯胺的性质3、烯胺的反应举例4、烯胺的反应机理⇨解释:烯胺反应的区域选择性5、合成上应用举例➢合成路线1可能存在的问题:•一般条件下有醛的自身醇醛缩合;•需要强碱、低温,产率可能不好;➢合成路线2:通过两次烯胺的Michael 加成⇨烯胺反应特点小结1烯胺可方便制备、分离和纯化;2通过烯胺的反应避免了羰基化合物的自身缩合等副反应;3烯胺的反应与烯醇负离子的类似反应在选择性上有所不同;。





第14章碳负离子的反应——β-二羰基化合物§14.1 α-H的酸性和互变异构14.1.1 α-H的酸性1、a-H的酸性在有机化学中,与官能团直接相连的碳原子均称为a-C;a-C上的氢原子均称为a-H。
a-H以质子形式解离下来的能力,即为a-H的活性或a-H的酸性。
因此烃也可叫做氢碳酸。
表14-1-1 常见化合物a-H的p K a值羧酸衍生物中的a-H的活性一般比醛酮为弱,但酰氯中由于氯原子与羰基的共轭程度差且吸电子效应强,反而使其a-H的酸性增强。
酸性大小:酰氯>醛、酮>酯>酰胺Cl:吸电子诱导>给电子共轭O:给电子共轭>吸电子诱导2、影响a-H的酸性的因素1)a-C所连接的官能团及其官能团的吸电子能力。
总的吸电子能力越强,a-H的酸性就越大;2)取决于氢解离后生成的碳负离子(carbanion)结构的稳定性。
负离子上电子的离域范围越大越稳定;3)分子的几何形状、介质的介电常数、溶剂等都有关系。
3、β-二羰基化合物α-H的活性分析乙酰乙酸乙酯是一个典型的1,3-二羰基化合物,由于受两个羰基的吸电子作用,亚甲基上的H 特别活泼,和碱作用形成稳定的负离子。
负离子特别稳定是因为负离子可以同时和两个羰基发生共轭作用,具有比较广泛的离域范围。
烯醇负离子其他1,3-二羰基化合物情况相似,其他的吸电子基团如硝基、氰基等与羰基作用相同在含有氢的碳原子上连有两个吸电子基团的化合物都含有一个活泼的亚甲基,它们统称为含活泼亚甲基(氢)的化合物。
β-二酮β-羰基酸酯丙二酸酯氰乙酸酯硝基乙酸酯活泼氢化合物的双重反应性能:碳负离子烯醇负离子氧负离子一般情况下,这些物质在反应时可以看作是碳负离子对其它官能团的亲核加成反应。
14.1.2 酮式和烯醇式的互变异构可以看作是活泼H可以在α-C和羰基O之间来回移动。
1、酸碱对互变平衡的影响痕量的酸、碱甚至是玻璃仪器都能促使平衡的快速建立。
(1)酸催化过程在酸催异构化过程中,酸首先与羰基氧原子作用形成 盐,其共轭碱——水再夺取a-H形成烯醇。