AL2O3的化学性质
- 格式:doc
- 大小:81.00 KB
- 文档页数:15

AL2O3的化学性质一、Al、Al2O3、Al(OH)3 的性质0分铝(一)物理性质:有良好的延性和展性,导电性和导热性。
铝在空气中表面生成一层致密的氧化膜,可阻止铝进一步氧化。
铝对水、浓硫酸,浓硝酸有耐腐蚀性。
高温下有强还原性。
铝可作还原剂、制造电线、铝合金是制汽车、飞机、火箭的材料。
(二)化学性质:1.和氧气反应:铝粉可燃铙4A l+3O2=2Al2O3(发强白光)2.和非金属反应:2Al+3S=Al2S33.和热水反应:2Al+6H2O=2Al(OH)3+3H2↑(反应缓慢)4.和较不活动金属氧化物反应:3Fe3O4+8Al=9Fe+4Al2O35.和酸反应:在常温下浓硫酸和浓硝酸可使铝钝化。
盐酸和稀硫酸可跟铝发生置换反应,生成盐并放出氢气。
2Al+6H2O=2AlCl3+3H2↑2Al+3H2SO4(稀)=Al2(SO4)3+3H2↑6.和盐溶液反应:2Al+3Hg(NO3)2=3Hg+2Al(NO3)37.和碱溶液反应:主要和NaOH、KOH强碱溶液反应,可看做是碱溶液先溶解掉铝表面氧化铝保护膜 A l2O3+2NaOH=2NaAlO2+H2O8.铝和水发生置换反应:2Al+6H2O=2Al(OH)3+3H2↑Al(OH)3溶解在强碱溶液中,Al(OH)3+NaOH=NaAlO2+2H2O一般可用下列化学方程式或离子方程式表示这一反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Al+2OH-+2H2O=2AlO2-+3H2↑注:1.铝和不活动金属氧化物(主要是难熔金属氧化物如C r2O3、V2O5以及F e2O3等)的混合物,都叫铝热剂,在反应中铝做还原剂。
反应过程放大量热,可将被还原的金属熔化成液态2.铝在加热时可以跟浓硫酸或硝酸反应,情况较复杂不做要求氧化铝:(一)物理性质:白色难溶难溶的固体(二)化学性质:1.与强酸反应:A l2O3+ 6H+ = 2Al3+ + 3H2O2.与强碱反应:A l2O3+ 2OH- = 2AlO2- + H2O氢氧化铝:化学性质:1.两性:可与强酸或强碱反应,Al(OH)3 + 3H+ = Al3+ + 3H2O,Al(OH)3 + 2OH- = 2AlO2- + 2H2O;2.不稳定性:2Al(OH)3 =(加热) Al2O3+ 3H2O求铝的性质,能和什么物质反应,还有它的氧化物的性质,最好详细点,谢了。

硼酸的化学性质
硼酸是一种常见的酸性化合物,它的分子式为H3BO3,主要用于硼烷(Al2O3)的合成,也用于光硅及其它高级核子材料的制备。
硼
酸的结构式中,一个氢原子与一个硼原子存在三种键结,其同系列的硝酸、磷酸等其他酸具有相似的结构。
硼酸具有若干特殊的化学性质,在室温下呈白色无定形晶体,溶于水,溶解度随温度的升高而降低。
硼酸具有强烈的酸性,与嗜碱性的溶液反应时发生反应的温度较低,碱性溶液中形成硼烷,且生成的产物具有悬浮特性,能用来检测碱性溶液中惰性成分的硼含量。
硼酸有良好的非电解质性质,能与质子性离子反应,吸收热量,蓄热-放热。
硼酸与醋酸或乙酸反应,可以生成用于硼烯体系的有机酸类化合物,如硼酸乙酯、硼酸丁酯和硼酸丙酯,也可以通过电熔技术制备硼酸,在制备氢氧化硼的过程中也可以使用硼酸。
硼酸的另一个重要的用途是用来制备硼烯体系的重要的硼基衍
生物,如醇酸和硼酸酯类化合物,还具有重要的有机合成活性,能作为聚合物的硼酸酯催化剂,特别是在各种丙烯聚合物中,大大提高了聚合物的制备速度和质量,在聚合反应中可以有效降低异构体的生成。
此外,硼酸还有广泛的应用性,如用作制备金属表面处理技术中用于清洗氧化物的溶剂,电镀剂,腐蚀抑制剂,多孔材料,磁性材料,药物剂型,荧光粉,烟草及橡胶的贴合性,以及矿物除垢、腐蚀室测试剂等。
总之,硼酸具有多种独特的特性和应用,在化学领域具有广泛的应用前景,为许多行业发展提供了新的可能性和机会。


展开编辑本段概要管制信息本品不受管制名称中文名称:铝氧,三氧化二铝英文别名:Aluminum oxide化学式Al2O3相对分子质量101.96性状白色结晶性粉末。
无臭。
无味。
质极硬。
易吸潮而不潮解。
溶于浓硫酸,缓慢溶于碱液中形成氢氧化物,几乎不溶于水及非极性有机溶剂。
相对密度(d204)4.0。
熔点约2000℃。
储存密封干燥保存。
SCRC100009用途用作分析试剂。
有机溶剂的脱水。
吸附剂。
有机反应催化剂。
研磨剂。
抛光剂。
质检信息质检项目指标值水中溶解物,% ≤0.5硅酸盐(SiO3) 合格碱金属及碱士金属,% ≤0.50重金属(以Pb计),% ≤0.005氯化物(Cl),% ≤0.01硫酸盐(SO4),% ≤0.05灼烧失量,% ≤5.0铁(Fe),% ≤0.01编辑本段物理性质式量 101.96 amu熔点 2303 K沸点 3250 K真密度 3.97 g/cm3松装密度:0.85g/mL(325目~0)0.9g/mL(120目~325目)晶体结构三方晶系 (hex)导电性常温状态下不导电热化学属性ΔfH0liquid ?1620.57 kJ/molΔfH0solid ?1675.69 kJ/molS0liquid, 1 bar 67.24 J/mol·KS0solid 50.9 J/mol·K编辑本段安全性食入低危险吸入可能造成刺激或肺部伤害皮肤低危险眼睛低危险在没有特别注明的情况下,使用SI单位和标准气温和气压。
氧化铝是铝和氧的化合物,分子式为Al2O3。
在矿业、制陶业和材料科学上又被称为矾土。
编辑本段应急处理隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
避免扬尘,小心扫起,置于袋中转移至安全场所。
若大量泄漏,用塑料布、帆布覆盖。
收集回收或运至废物处理场所处置。
编辑本段中国工业概况我国具有较丰富的铝土矿资源,迄今已探明保守储量23亿吨,位居世界第4,具备发展氧化铝工业的资源条件。

氧化铝,又称三氧化二铝,分子量102,通常称为“铝氧”,是一种白色无定形粉状物,俗称矾土。
氧化铝,化学式为Al2O3,,刚玉型晶体接近于原子晶体,其它晶型的基本上是离子晶体,熔点为2050℃,沸点为3000℃,真密度为3.6g/cm。
外观:白色晶状粉末或固体它的流动性好,难溶于水,能溶解在熔融的冰晶石中。
它是铝电解生产中的主要原料。
有四种同素异构体β-氧化铝δ-氧化铝γ-氧化铝α-氧化铝,主要有α型和γ型两种变体,工业上可从铝土矿中提取。
食入低危险吸入可能造成刺激或肺部伤害皮肤低危险眼睛低危险氧化铝是铝和氧的化合物,分子式为Al2O3。
在矿业、制陶业和材料科学上又被称为矾土。
氧化铝是没毒的(陶瓷、烤瓷牙齿等都是氧化铝),我们做菜用的锅很多就是用铝做的。
铝比较活泼,与空气中的氧气反应会变成氧化铝,这层氧化铝薄膜非常致密,附着在表面,阻止里面的铝继续与氧气反应。
平常我们摄入铝的途径只有一个:食物。
使用铝质的锅,再就是含有铝成分的食物(比如油条,炸油条的时候会使用明矾做膨化剂,明矾中含有铝元素)。
平常接触铝制品是没有问题的。
不会有中毒的危险铝有毒,但氧化铝不一定有毒,相反,碳无毒,CO却有毒γ型氧化铝γ型氧化铝是氢氧化铝在140-150℃的低温环境下脱水制得,工业上也叫活性氧化铝、铝胶.其结构中氧离子近似为立方面心紧密堆积,Al3+不规则地分布在由氧离子围成的八面体和四面体空隙之中.γ型氧化铝不溶于水,能溶于强酸或强碱溶液,将它加热至1200℃就全部转化为α型氧化铝.γ型氧化铝是一种多孔性物质,每克的内表面积高达数百平方米,活性高吸附能力强.工业品常为无色或微带粉红的圆柱型颗粒,耐压性好.在石油炼制和石油化工中是常用的吸附剂、催化剂和催化剂载体;在工业上是变压器油、透平油的脱酸剂,还用于色层分析;在实验室是中性强干燥剂,其干燥能力不亚于五氧化二磷,使用后在175℃以下加热6-8h还能再生重复使用.分子筛是一种具有立方晶格的硅铝酸盐化合物,主要由硅铝通过氧桥连接组成空旷的骨架结构,在结构中有很多孔径均匀的孔道和排列整齐、内表面积很大的空穴。

氧化铝实验计算公式氧化铝(Al2O3)是一种重要的无机化合物,具有多种应用领域,如陶瓷、催化剂、电子材料等。
在化学实验中,我们经常需要计算氧化铝的含量或者反应产物的量,因此掌握氧化铝实验计算公式是非常重要的。
本文将介绍氧化铝实验计算公式的相关知识,并通过实例演示其应用。
一、氧化铝的化学性质。
氧化铝是由铝和氧两种元素组成的化合物,化学式为Al2O3。
它是一种无色、无味、无毒的固体,具有很高的熔点和热稳定性。
在化学反应中,氧化铝通常作为反应物或者产物参与其中,因此需要进行相关的计算。
二、氧化铝实验计算公式。
1. 氧化铝的质量计算。
在实验中,我们常常需要计算氧化铝的质量,这可以通过其化学式和反应物的量来计算。
假设有一定量的铝(Al)与氧气(O2)反应生成氧化铝,可以通过以下公式进行计算:氧化铝的质量 = 铝的质量×(氧的摩尔质量 / 铝的摩尔质量)。
2. 氧化铝的摩尔计算。
在一些反应中,需要计算氧化铝的摩尔量,这可以通过其质量和摩尔质量来计算。
假设已知氧化铝的质量,可以通过以下公式进行计算:氧化铝的摩尔量 = 氧化铝的质量 / 氧化铝的摩尔质量。
3. 反应产物的计算。
在某些反应中,氧化铝可能是反应的产物之一,需要计算其产生的量。
可以通过反应物的量和反应方程式来计算氧化铝的产生量。
三、实例演示。
假设有100克铝与氧气反应生成氧化铝,铝的摩尔质量为27克/摩尔,氧的摩尔质量为16克/摩尔,氧化铝的摩尔质量为102克/摩尔。
根据以上信息,我们可以进行如下计算:1. 计算氧化铝的质量:氧化铝的质量 = 100 ×(16 / 27)= 59.26克。
2. 计算氧化铝的摩尔量:氧化铝的摩尔量 = 59.26 / 102 = 0.58摩尔。
通过以上实例演示,我们可以看到氧化铝实验计算公式的应用方法,这些计算公式可以帮助我们在化学实验中准确计算氧化铝的质量和产生量,为实验提供了重要的参考数据。
四、注意事项。

氧化铝化学式
氧化铝,化学式为Al2O3,是一种重要的无机化合物。
它由两个铝原子和三个氧原子组成。
氧化铝具有许多重要的物理和化学性质,被广泛应用于各个领域。
氧化铝具有优异的热稳定性和耐腐蚀性。
它能够在高温下保持稳定,并且不被酸和碱侵蚀。
这使得氧化铝成为一种重要的耐火材料,用于制造高温炉和耐火陶瓷。
此外,氧化铝还具有良好的电绝缘性能,常被用作电子元件的绝缘材料。
氧化铝具有良好的光学性质。
它具有较高的折射率和透明度,可以用于制造光学镜片和玻璃。
此外,氧化铝还具有优异的耐磨性和划痕性能,常被用作涂层材料,用于保护玻璃和金属表面。
氧化铝还具有吸附性能。
由于其具有大量的氢键和表面羟基,可以吸附水分子和有机分子。
因此,氧化铝常被用作吸附剂和催化剂载体。
例如,氧化铝催化剂常被用于催化加氢反应、氧化反应和裂化反应等。
氧化铝还具有一定的生物活性。
研究表明,氧化铝纳米颗粒可以通过与细胞膜的相互作用,影响细胞的生长和分化。
这使得氧化铝在生物医学领域有着广泛的应用前景。
例如,氧化铝纳米颗粒可以用于制备生物传感器、药物输送系统和组织工程材料等。
氧化铝作为一种重要的无机化合物,具有多种优异的物理和化学性质,被广泛应用于耐火材料、光学材料、吸附剂和生物医学材料等领域。
随着科学技术的不断发展,相信氧化铝的应用前景将会更加广阔。

氧化铝的性质
及应用
氧化铝是一种由铝元素氧化后的物质,也称为铝氧化物。
它的化学式
为Al2O3,晶体结构为类硅酸盐结构。
氧化铝具有优良的导热性、导电性、热稳定性、耐磨性及不溶于水的性质,主要应用于各种建筑、机械、电子
以及冶金工业。
1、建筑工业:氧化铝可作为建筑建材,如涂料、砖瓦和涂层等,可
耐火、耐腐蚀、无毒。
2、机械工业:氧化铝可制成垫片、活塞环、密封圈、轴套等,具有
良好的耐磨性及高温加工性能。
3、电子工业:氧化铝可应用于电子元件的制造,具有良好的消耗性
能和稳定性,可有效抑制电磁干扰。
4、冶金工业:氧化铝可用于冶金工业,可作为钢铁冶炼、有色金属
冶炼及洗涤时的阴极材料,具有优异的耐腐蚀性、导电性以及导热性能。

柱层析硅胶 al2o3 区别柱层析和硅胶、Al2O3在化学分析中起到了重要的作用,它们具有不同的特点和用途。
本文将从柱层析和硅胶、Al2O3的定义、性质、制备方法以及应用领域等方面进行比较和阐述。
一、定义柱层析是一种基于物质在不同相中的分配系数差异而进行物质分离和纯化的技术。
它是一种静态分离方法,通过在固体支持物上填充液相色谱柱,利用样品中物质在固液两相之间的分配系数差异,达到分离和纯化的目的。
硅胶是一种由二氧化硅(SiO2)构成的非晶态固体,具有很强的吸附性能。
硅胶分为不同孔径和不同极性的类型,适用于各种不同的分离和纯化目的。
Al2O3是氧化铝的化学式,是一种无机化合物。
它具有较高的化学稳定性和热稳定性,适用于高温环境下的分离和纯化。
二、性质比较1. 吸附性能:硅胶具有较强的吸附性能,可以吸附大部分有机物和无机物。
Al2O3的吸附性能相对较弱,主要用于高极性物质的吸附和分离。
2. 极性:硅胶具有较高的极性,适用于分离极性物质。
而Al2O3的极性较低,适用于分离非极性物质。
3. 孔径:硅胶的孔径较大,适用于分离大分子和高分子化合物。
而Al2O3的孔径较小,适用于分离小分子化合物。
4. 稳定性:硅胶相对来说比较脆弱,容易破碎。
而Al2O3具有较高的稳定性和耐热性。
三、制备方法比较硅胶的制备方法主要有溶胶-凝胶法、熔融法和水热法等。
其中溶胶-凝胶法是最常用的制备方法,通过水解硅酸酯或硅酸盐,得到胶体溶液,再进行凝胶化和干燥而制备硅胶。
Al2O3的制备方法主要有溶胶-凝胶法、水热法和沉淀法等。
其中溶胶-凝胶法也是最常用的制备方法,通过水解铝酸酯或铝盐,得到胶体溶液,再进行凝胶化和干燥而制备Al2O3。
四、应用领域比较硅胶广泛应用于化学分析、制药工业、食品工业等领域。
在化学分析中,硅胶常用于有机物的分离和纯化,例如萃取、柱层析、固相萃取等。
在制药工业中,硅胶常用于药物的分离纯化和质量控制。
在食品工业中,硅胶常用于食品添加剂的分离和纯化。

氧化铝与氢氧化铝氧化铝与氢氧化铝是广泛存在于自然界中的两种化合物。
它们在化工、冶金、建筑、电子等诸多领域中都有重要的应用。
本文将从化学、性质、制备和应用四个方面对氧化铝与氢氧化铝进行介绍。
一、化学1. 氧化铝氧化铝(Al2O3)是铝在高温下与氧气反应形成的一种白色固体。
它具有高熔点、高硬度和较高的热稳定性。
氧化铝是一种典型的离子晶体,由氧离子和铝离子组成,具有良好的绝缘电性能和化学稳定性。
2. 氢氧化铝氢氧化铝(Al(OH)3)是一种白色粉末状固体。
它具有一定的溶解性,可以在酸性或碱性溶液中溶解。
根据它的化学组成,可以将氢氧化铝分为结晶水型和无水型两种。
它的化学性质较为稳定,不易溶解于水和其它溶液中。
氢氧化铝是铝水合物的一种,可以通过铝和氢氧化钠反应得到。
二、性质1. 氧化铝氧化铝是一种高硬度材料,具有优异的机械性能和耐磨性。
它是不溶于水和有机溶剂的,但可以在强碱性溶液中溶解。
氧化铝表面拥有大量的氧化物位点,可用于吸附气体和液体。
氧化铝的材料性能、表面性质和结构等可通过制备方法进行调控。
2. 氢氧化铝氢氧化铝具有吸水性和稳定性,被广泛应用于防火材料、涂料、塑料等领域。
它可以溶于强酸或强碱溶液中,且具有中性化作用。
另外,氢氧化铝还具有一定的生物学适用性,在药物制剂和生物材料等领域中也有应用。
三、制备1. 氧化铝氧化铝的制备方法多种多样,常见的有氧化铝粉末热分解、松散凝胶脱水、热水解、氧化铝酸化等方法。
同时也可以通过碳酸盐还原法,将氢氧化铝高温还原得到氧化铝。
2. 氢氧化铝氢氧化铝最早是通过天然矾土的水洗提取得到的。
现在广泛采用的是铝粉和氢氧化钠反应制备氢氧化铝。
具体操作是:将铝粉和氢氧化钠混合,加热反应生成氢氧化铝,再通过酸化、沉淀和洗涤等步骤进行制备。
四、应用1. 氧化铝氧化铝在冶金、建筑、电子等领域中有广泛的应用。
例如,氧化铝可以作为电容器、IC硬盘、导线等电气工业材料的绝缘层、外壳和介质材料。
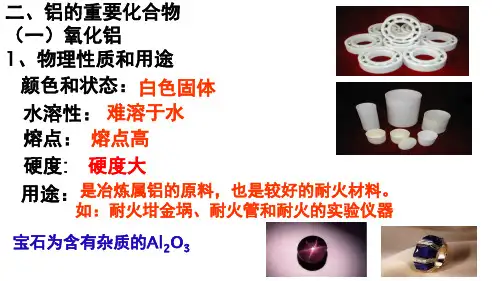
al2o3氧化铝
【原创版】
目录
1.氧化铝简介
2.氧化铝的性质与特点
3.氧化铝的应用领域
4.氧化铝的生产方法
5.氧化铝的环境影响与应对措施
正文
氧化铝(Al2O3)是一种无机化合物,是铝元素最常见的氧化物。
它是一种白色或微红色的粉末,不溶于水,但可溶于强酸和强碱溶液。
氧化铝具有高熔点、高硬度、高热稳定性等优点,使其在多个领域都有广泛的应用。
氧化铝的性质与特点主要表现在其晶体结构、熔点、硬度和化学稳定性等方面。
氧化铝的晶体结构为离子晶体,具有较高的熔点(约 2072 摄氏度)和硬度。
此外,氧化铝在常温下对酸和碱具有较好的稳定性,但在高温下会与强酸和强碱反应。
氧化铝的应用领域十分广泛,包括陶瓷、磨料、耐火材料、电子元器件等。
在陶瓷工业中,氧化铝作为常见的陶瓷原料,可用于制作炊具、餐具等;在磨料领域,氧化铝砂轮和砂纸等产品具有较高的磨削效率;在耐火材料方面,氧化铝可提高耐火材料的耐高温性能;在电子元器件领域,氧化铝可用于制作高热稳定性的电子元件。
氧化铝的生产方法主要包括拜耳法、烧结法和化学气相沉积法等。
拜耳法是工业上生产氧化铝的主要方法,其过程包括铝矾土的溶出、过滤、酸化、碱化和氢氧化铝的煅烧等步骤。
烧结法适用于生产高纯度氧化铝,
主要通过将氢氧化铝或氧化铝粉末在高温下烧结而制得。
化学气相沉积法则是通过气相反应生成氧化铝薄膜。
在生产氧化铝过程中,可能会产生废水、废气和废渣等污染物。
为了减少氧化铝生产对环境的影响,应采取相应的环保措施,包括废水处理、废气净化和废渣利用等。
三氧化二铝规格1. 引言三氧化二铝(Aluminum trioxide)是一种重要的无机化合物,具有广泛的应用领域。
本文将介绍三氧化二铝的规格,包括其化学性质、物理性质、生产工艺以及应用领域等方面。
2. 化学性质2.1 分子式和分子量三氧化二铝的分子式为Al2O3,相对分子量为101.96。
2.2 结构和晶型三氧化二铝具有多种晶型,其中最常见的是α-Al2O3和γ-Al2O3。
α-Al2O3为六方晶系,γ-Al2O3为立方晶系。
2.3 溶解性三氧化二铝在水中几乎不溶解,在酸性溶液中可溶解生成相应的盐类。
2.4 化学反应三氧化二铝可与强碱反应生成相应的盐类,并可参与一些重要的催化反应,如加氢反应、氧化反应等。
3. 物理性质3.1 外观三氧化二铝呈白色结晶粉末状。
3.2 密度三氧化二铝的密度约为3.97 g/cm³。
3.3 熔点和沸点三氧化二铝的熔点约为2072°C,沸点约为2977°C。
3.4 热性质三氧化二铝具有较高的热稳定性,能够耐受高温条件下的应用。
3.5 光学性质三氧化二铝具有良好的透光性,对可见光和紫外线具有一定的透过率。
4. 生产工艺4.1 工艺概述三氧化二铝的生产可以采用多种工艺路线,常见的包括碳酸铝法、水合硝酸盐法、溶胶-凝胶法等。
4.2 碳酸铝法碳酸铝法是一种常用的生产三氧化二铝的方法。
该方法首先将铁、硅等杂质从原料中去除,然后将纯度较高的氢氧化铝与碳酸钠反应生成碳酸铝,在高温条件下分解得到三氧化二铝。
4.3 水合硝酸盐法水合硝酸盐法是另一种常用的生产三氧化二铝的方法。
该方法通过将铝金属与硝酸等反应生成硝酸铝,再经过水合反应得到三氧化二铝。
4.4 溶胶-凝胶法溶胶-凝胶法是一种新型的生产三氧化二铝的方法。
该方法通过将适量的铝源与溶剂混合形成溶胶,然后通过凝胶化和热处理得到三氧化二铝。
5. 应用领域5.1 陶瓷工业由于三氧化二铝具有良好的耐火性和电绝缘性,因此广泛应用于陶瓷工业中,用作陶瓷材料的添加剂、涂料和填充剂等。
氧化铝和氧化锶一、氧化铝的概述氧化铝是一种重要的无机化合物,其分子式为Al2O3,是由氧和铝元素组成的。
它是一种白色晶体,具有高硬度、高熔点、高耐腐蚀性和高绝缘性等特点,在工业上应用广泛。
氧化铝可以通过多种方法制备,例如煅烧铝矾土、电解法、水解法等。
二、氧化铝的性质1.物理性质氧化铝是一种白色晶体,密度为3.95 g/cm³,熔点为2072℃,沸点为2980℃。
它具有较高的硬度和绝缘性能。
2.化学性质氧化铝是一种弱碱性物质,在水中不易溶解。
但在浓稀酸和碱中都能溶解,并且可以与酸或碱反应生成相应的盐。
三、氧化铝的应用1.制陶瓷材料:氧化铝具有高硬度和耐腐蚀性能,在制陶瓷材料时可以作为填充剂或涂层添加剂。
2.电子工业:由于其优异的绝缘性能,氧化铝被广泛应用于制造电子元件、绝缘材料和半导体器件等。
3.研磨材料:氧化铝可以作为研磨材料,用于金属表面的抛光和打磨。
4.催化剂:氧化铝可以作为催化剂的载体,用于各种化学反应中。
四、氧化锶的概述氧化锶是一种无机化合物,其分子式为SrO,是由氧和锶元素组成的。
它是一种白色粉末,在空气中容易吸收水分。
氧化锶可以通过多种方法制备,例如加热碳酸锶、水解碳酸锶等。
五、氧化锶的性质1.物理性质氧化锶是一种白色粉末,密度为4.7 g/cm³。
它具有高熔点和高硬度。
2.化学性质氧化锶在水中容易吸收水分并与之反应生成碱性溶液。
它可以与酸或碱反应生成相应的盐。
六、氧化锶的应用1.荧光材料:由于其特殊的发光性能,氧化锶被广泛应用于制造荧光材料。
2.电子工业:氧化锶可以作为电子元件和半导体器件的材料。
3.催化剂:氧化锶可以作为催化剂的载体,用于各种化学反应中。
4.烟花助燃剂:氧化锶具有良好的助燃性能,因此被广泛应用于烟花制造中。
七、氧化铝和氧化锶的比较1.物理性质方面:氧化铝具有高硬度和高绝缘性能,而氧化锶则具有高密度和高熔点。
2.化学性质方面:两者都是碱性物质,在水中不易溶解。
氧化铝和氧化锆氧化铝和氧化锆是两种常见的无机化合物,它们在工业生产和科学研究中有着广泛的应用。
本文将分别介绍氧化铝和氧化锆的特性、制备方法、物理化学性质以及应用领域。
一、氧化铝1. 特性:氧化铝,化学式为Al2O3,是一种白色结晶性粉末,具有高熔点、高硬度和优良的绝缘性能。
它在自然界中以矾土矿石的形式存在。
2. 制备方法:氧化铝可以通过多种方法制备,常见的方法有热分解法、溶胶-凝胶法和氢氧化铝烧结法。
其中,热分解法是最常用的制备方法之一,通过加热铝盐类化合物使其分解生成氧化铝。
3. 物理化学性质:氧化铝具有高熔点(约2050℃)、高硬度和优良的绝缘性能。
它是一种无毒、无味、无臭的化合物,不溶于水和酸,但可以与碱反应生成相应的盐类。
氧化铝具有良好的耐热性、耐腐蚀性和耐磨性,因此在工业中被广泛应用。
4. 应用领域:氧化铝具有很多重要的应用领域。
首先,它是制备金属铝的重要原料,在铝电解和铝冶炼过程中起着重要作用。
其次,氧化铝是一种优良的绝缘材料,广泛应用于电子、电气和通信领域。
此外,氧化铝还可以用作催化剂、填料和耐火材料等。
二、氧化锆1. 特性:氧化锆,化学式为ZrO2,是一种白色结晶性粉末,具有高熔点、高硬度和优良的化学稳定性。
它在自然界中主要以锆石的形式存在。
2. 制备方法:氧化锆可以通过多种方法制备,常见的方法有煅烧法、水热法和溶胶-凝胶法。
其中,煅烧法是最常用的制备方法之一,通过高温处理锆矿石或锆化合物使其转化为氧化锆。
3. 物理化学性质:氧化锆具有高熔点(约2700℃)、高硬度和优良的化学稳定性。
它是一种无毒、无味、无臭的化合物,不溶于水和大多数溶剂。
氧化锆具有良好的耐热性、耐腐蚀性和耐磨性,因此在工业中有广泛应用。
4. 应用领域:氧化锆具有很多重要的应用领域。
首先,它是制备金属锆的重要原料,在核能、航空航天等高技术领域有广泛应用。
其次,氧化锆是一种优良的结构陶瓷材料,广泛应用于陶瓷制品、磨料和涂料等。