盐的化学性质
- 格式:ppt
- 大小:864.00 KB
- 文档页数:10


盐的化学性质
盐是由阴离子和阳离子组成的一种离子化合物,其化学性质主要包括稳定性、水溶性、结晶水的存在、热稳定性、氧化还原性等。
1.稳定性:
盐通过阴阳离子的吸引力相结合而形成,具有相对稳定的物理和化学结构。
盐通常在室温下非常稳定,即使在空气中也不会发生任何化学反应。
这种稳定性意味着,盐通常可以长时间储存并保持其化学特性。
2.水溶性:
大部分盐是水溶性的。
盐在水中溶解时,它们的离子会与水分子相互作用,并释放出能量。
盐在水中的溶解度是受温度、压力和PH值的影响。
当温度升高、压力变大、PH值趋近中性时,许多盐的溶解度会增加。
3.结晶水的存在:
某些盐的晶体中含有水分子,这些水分子称为结晶水。
这些盐称为水合盐。
结晶水可以影响盐的物理和化学特性。
一些水合盐在失去结晶水后会发生分解,这也是它们的热稳定性的表现。
4.热稳定性:
盐的热稳定性不同,有些盐在受热时会发生分解,而有些则不会。
该性质常用于制备和分离某些分子。
例如,氯化铵可以通过加热分解为氨气和盐酸。
5.氧化还原性:
一些盐在氧化还原反应中具有重要作用。
例如,氧化亚铁(II)盐可以还原某些金属离子为金属。
氯化金酸钾虽然不是氧化还原物质,但其可以作为氧化还原反应的催化剂。
总之,盐的化学性质涉及其稳定性、水溶性、结晶水的存在、热稳定性、氧化还原性等多个方面。
这些性质使盐成为广泛应用于化学领域的重要化合物。


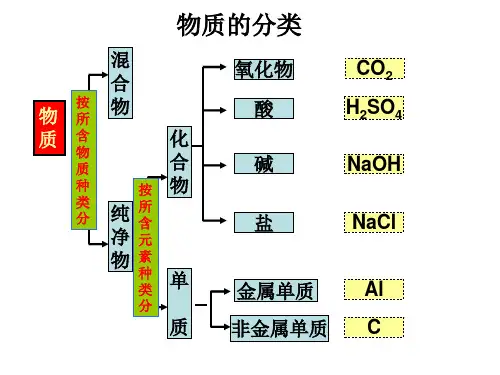
生活中常见的盐【主要内容】生活中常见的盐及其化学性质一、盐的分类根据盐的组成不同,如按盐组成中的阳离子或阴离子的名称,一般有如下的分类:钠盐:NaCl、Na2CO3、Na2SO4、Na2S等。
钾盐:K2CO3、KNO3、KCl等。
硫酸盐:CuSO4、K2SO4、(NH4)2SO4等。
碳酸盐:Na2CO3、K2CO3、(NH4)2CO3等。
盐的分类方法还有很多种,例如:酸式盐、碱式盐和正盐;含氧酸盐和无氧酸盐;强酸弱碱盐、强碱弱酸盐、强酸强碱盐和弱酸弱碱盐等。
二、生活中常见的盐1.氯化钠(重要的调味品,食盐的主要成分是NaCl)(1)物理性质:白色晶体,易溶于水,有咸味。
(2)在人的正常生理过程中的作用:人体中的氯化钠都是以离子的形式存在于体液中,钠离子对于维持细胞内外正常水分分布和促进细胞内外物质的交换起主要作用;氯离子是胃液的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
人体正常每人每天约需3 g~5 g食盐。
但长期食用过多食盐不利于人体健康。
(3)存在:海水、盐湖、盐井、盐矿(4)用途:①医疗上的生理盐水(质量分数为0.9%)②用来制备Na2CO3、NaOH、Cl2、HCl等物质;③食品的调味剂,腌渍蔬菜等;④公路积雪可以用氯化钠消除;⑤农业上利用氯化钠溶液来选种。
粗盐的提纯:(1)溶解-------使用的仪器:烧杯、玻璃棒、药匙玻璃棒的作用:加快溶解速率,不能提高物质的溶解度操作要点:搅拌时玻璃棒不能接触烧杯壁(2)过滤------使用的仪器:漏斗、铁架台(带铁圈)、玻璃棒、烧杯玻璃棒的作用:引流操作要点:一贴、二低、三靠(3)蒸发-------使用的仪器:蒸发皿、铁架台(带铁圈)、玻璃棒、酒精灯、坩埚钳玻璃棒的作用:防止液体局部过热而引起液滴飞溅操作要点:当蒸发皿中出现较多固体时,即停止加热,利用余热使液体全部挥发。
*如果有转移操作:最后在转移固体时,玻璃棒起到转移的作用。
2.碳酸钙(化学式为CaCO3)(1)物理性质:碳酸钙是一种白色晶体或粉末状固体,难溶于水(25℃在水中的溶解度为6.9×10-4g)(2)存在:自然界广泛存在的石灰石、大理石、方解石、白垩以及珍珠、珊瑚等主要成分都是碳酸钙。

盐的性质盐的定义 This manuscript was revised by the office on December 22, 2012盐的性质盐的定义:盐是指由金属离子(或钱根离子)和酸根离子构成的化合物,盐在溶液里能解离成金属离子(或钱根离子)和酸根离子。
根据阳离子不同,可将盐分为钠盐、钾盐、钙盐、钱盐等,根据阴离子不同,可将盐分为硫酸盐、碳酸盐,硝酸盐等。
常见的盐:氯化钠(NaCl),碳酸钠 (Na2CO3)、碳酸氧钠(NaHCO3)、碳酸钙和农业生产上应用的硫酸铜(CuSO4)。
盐的物理性质:(1)盐的水溶液的颜色常见的盐大多数为白色固体,其水溶液一般为无色。
但是有些盐有颜色,其水溶液也有颜色。
例如:胆矾(CuSO·5HO)为蓝色,高锰酸钾为紫黑色;含Cu2+的溶液一般为蓝色,含Fe2+的溶液一般为浅绿色,含Fe3+的溶液一般为黄色。
(2)盐的溶解性记忆如下钾钠硝钱溶水快(含K+,Na+,NH4+,NO3-的盐易溶于水);硫酸盐除钡银钙(含SO42-的盐中,AgSO, CaSO微溶,BaSO3难溶)都易溶;氯化物中银不溶(含 Cl-的盐中,AgCl不溶于水,其余一般易溶于水);碳酸盐溶钾钠钱[含CO32-的盐,NaCO、(NH)2CO、 KCO易溶,NaCO微溶,其余难溶〕。
盐的化学性质:(1)盐+金属一另一种盐+另一种金属(置换反应),例如:Fe+CuSO==FeSO+Cu规律:反应物中盐要可溶,金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来(除K, Ca,Na)应用:判断或验证金属活动性顺序和反应发生的先后顺序。
(2)盐+酸→另一种盐+另一种酸(复分解反应),例如;HCl+AgNO==AgCl↓+HNO。
规律:反应物中的酸在初中阶段一般指盐酸、硫酸、硝酸。
盐是碳酸盐时可不溶,若是其他盐,则要求可溶。
应用:实验室制取CO2,CO32-、Cl-,SO42-的检验。




盐的化学性质1,盐、碱的溶解性口诀表钾、钠、铵盐均易溶(含有钾、钠、铵根离子的盐类都可溶)。
硝酸盐类也相同(含有硝酸根离子的盐类也都可溶)。
盐酸盐除氯化银...(含有氯离子的盐类除了氯化银外都可溶)AgC l↓特殊沉淀硫酸铅、钡盐难溶(含有硫酸根离子的除了硫酸钡外都可溶)BaSO4↓特殊沉淀碳酸盐溶钾、钠、铵(碳酸盐除了K2CO3、Na2CO3、(NH4)2CO3外其他都不溶)可溶性碱钾、钠、钡。
记住钙是微溶。
2,归纳盐的性质①活泼性金属可与不活泼性金属盐类反应置换出不活泼金属。
②某些盐受热可以分解。
CaCO3、Ca(HCO3)2、NaHCO3受热可以分解。
③盐+酸→新盐+新酸(反应条件有气体、水、沉淀三者中任意一种生成)如:HCl+AgNO3=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓+2HCl记住所有的碳酸盐、碳酸氢盐都能与酸反应放出二氧化碳气体。
所以可以解释为什么可以用醋除去水垢。
原理:2H++CO32-=CO2+H2O H++HCO3-=CO2+H2O④盐+碱→新盐+新碱(反应条件有气体、水、沉淀三者中任意一种生成)注意:碱盐都要可溶。
⑤盐+盐→新盐+新盐(反应条件有气体、水、沉淀三者中任意一种生成)注意:盐都要可溶。
小结:以上③、④、⑤点反应规律即酸、碱、盐两两之间能否反应以及如何反应只需记住:△酸、碱、盐两两之间反应时,有酸时反应物无要求,无酸时碱、盐必溶,生成物“三取一”形成互换..。
也可知酸、碱、盐反应的主要原理即离子在同一溶液中不能共存。
3,中考典型题型①除杂题(除杂时不能引入新的杂质)括号中为杂质NaOH(Na2CO3) NaNO3(NaCl)NaCl(CuSO4) CaCl2(CaCO3)②共存题例1、下列物质能再pH=1.5的溶液中大量共存,形成无色溶液的是()A、NaCl BaCl2 Na2SO4B、Na2CO3NaCl Na2SO4C、CuSO4NaCl NaNO3D、Na2SO4 HCl NaNO3例2、下列离子在溶液中一定能大量共存的是()A、H+ Cl- HCO3-B、Na+Cu2+ OH-C、Ag+Cl-NO3-D、H+Fe3+ SO42-例3、在经济建设中,我们要走发展与环保并重的可持续发展道路,某化工厂有甲、乙两个车间,排出的废水澄清透明,分别含有三种不同的离子,它们可能是K+、Ba2+、Cu2+、OH-、NO3-、CO32-中的三种。

初中化学下盐的化学性质标题:初中化学下盐的化学性质在初中化学的学习中,盐的化学性质是一个重要的知识点。
盐是由金属离子和酸根离子构成的化合物,具有多种重要的化学性质。
本文将对这些性质进行详细的解释和阐述。
首先,让我们了解一下盐的溶解性。
盐在水中的溶解度因盐的种类和温度而异。
例如,氯化钠(食盐)在20℃时的溶解度约为36克,这意味着在100克水中可以溶解36克的氯化钠。
另一方面,硫酸钡在任何温度下都难溶于水。
溶解度不仅与盐的种类有关,还与温度和水质有关。
接下来,我们要探讨的是盐的酸碱性。
大多数盐显示中性,如氯化钠和硫酸钡。
然而,一些盐显示出酸性或碱性。
例如,碳酸钠是一种盐,显示出碱性,因为碳酸根离子在水中会水解,产生氢氧根离子。
同样,碳酸氢钠和碳酸铵等盐也显示出碱性。
另一方面,一些含铅的盐(如醋酸铅)会显示出酸性。
因此,盐的酸碱性取决于其构成的离子和水解反应。
盐的氧化还原性也是我们需要掌握的一个知识点。
在某些氧化还原反应中,盐可以作为氧化剂或还原剂参与反应。
例如,在铁生锈的反应中,铁与空气中的氧气和水反应,生成了铁的氧化物。
在这个过程中,铁被氧化为氧化铁,而氧气被还原为水。
同样,在硫酸铜溶液中加入铁片,铁可以将铜从硫酸铜中还原出来,这是因为铜离子在溶液中起到了氧化剂的作用。
最后,我们要讨论的是盐的配合性。
配合是指一种物质与另一种物质紧密结合,形成一种新的物质。
盐也可以与某些物质发生配合反应。
例如,硫酸铜与氢氧化钠反应生成了氢氧化铜和硫酸钠。
在这个反应中,硫酸铜中的铜离子与氢氧化钠中的氢氧根离子紧密结合,形成了氢氧化铜沉淀。
这种配合反应在化学中非常重要,因为它可以形成许多新的化合物。
综上所述,盐具有多种重要的化学性质,包括溶解性、酸碱性、氧化还原性和配合性。
了解这些性质有助于我们更好地理解化学反应的本质,并为更深入的学习打下坚实的基础。
希望这篇文章能帮助大家更好地掌握盐的化学性质,激发大家对化学学习的热情和兴趣。
盐的含义化学-概述说明以及解释1.引言1.1 概述盐是一种普遍存在于我们周围并具有重要意义的化学物质。
在化学中,盐是由一个或多个正离子和一个或多个负离子组成的离子化合物。
它们可以以晶体的形式存在,常见的盐包括氯化钠、碳酸钙和硫酸铜等。
盐的制备方法多种多样,最常用的是通过酸碱中和反应来制备。
例如,我们可以通过硫酸和氯化钠的反应制备氯化钠。
除此之外,还有其他制备盐的方法,如氧化还原反应和双水解反应等。
盐具有一系列的化学性质。
首先,大多数盐在水中能够溶解,形成离子。
这使得盐能够在化学反应中起到媒介或催化剂的作用。
其次,盐可以与其他化合物发生反应,产生新的物质。
此外,盐还可以通过加热或其他物理条件改变其结构和性质。
盐在我们的日常生活中有着广泛的应用。
它不仅仅是一种用来调味的调料,还被广泛用于食品加工、农业、化工、医药等领域。
盐还可以用作融雪剂来除冰,或者用于制备一些化学试剂。
然而,盐在高浓度下对人体健康也有一定的影响。
过量摄入盐会增加患高血压和心脏疾病的风险。
因此,保持适量的盐摄入对人体健康非常重要。
此外,盐的生产和使用也对环境产生一定的影响。
盐在地下水中的浸出导致水体的盐度升高,对水生生物造成影响。
同时,盐的制备和处理过程中还会产生一定的废水和废气,对环境造成一定的污染。
综上所述,盐是一种重要的化学物质,具有多种特征和化学性质。
它在生活中广泛应用,但也需要注意适量摄入以及对环境的影响。
在接下来的文章中,我们将更详细地探讨盐的定义、特征、制备方法、化学性质以及其在生活中的应用和对健康、环境的影响。
1.2文章结构1.2 文章结构本文共分为引言、正文和结论三个部分。
每一部分都有其特定的目的和内容。
下面将详细介绍各个部分的内容:引言部分主要是对本篇文章的主题进行概述和背景介绍。
在引言的第一部分,我将简要介绍盐的含义和化学性质,引起读者对盐的兴趣,并引出文章的目的。
第二部分将对本文的结构进行概括,列出各部分的内容和主要的思路。
食盐的分子式食盐的分子式为NaCl,它是由钠离子和氯离子组成的化合物。
食盐是一种常见的无机化合物,具有多种重要的应用和功能。
本文将详细介绍食盐的组成、性质、制备方法以及主要的应用领域。
一、食盐的组成和结构食盐的分子式为NaCl,由一个钠离子(Na+)和一个氯离子(Cl-)组成。
钠离子带有正电荷,氯离子带有负电荷,它们通过电荷的吸引力结合在一起形成离子晶体。
食盐的晶体结构为立方晶系,每个钠离子都被六个氯离子包围,每个氯离子也被六个钠离子包围,形成紧密排列的晶格结构。
二、食盐的性质1. 物理性质:食盐是一种无色晶体,呈盐味,可溶于水。
其溶解度随温度的升高而增加。
2. 化学性质:食盐在常温下相对稳定,不与空气中的氧气或水反应。
但在高温下会分解为氯气和金属钠。
此外,食盐也可与其他化合物发生反应,如与酸反应生成盐酸。
三、食盐的制备方法1. 真空蒸发法:将含有食盐的海水或盐湖水置于真空下蒸发,使水分蒸发,留下食盐。
2. 晒盐法:将盐水倒入浅盐田中,经过阳光的照射和风的吹拂,水分逐渐蒸发,最终得到食盐。
3. 矿石提炼法:通过开采盐矿石,经过破碎、洗涤、浸提等工艺,提取出食盐。
四、食盐的应用领域1. 食品加工:食盐是调味料中最重要的一种,用于增加食品的咸味。
同时,食盐还具有抑制微生物生长的作用,可用于食品保鲜。
2. 化学工业:食盐是制取氯气、盐酸和其他化学品的原料。
氯气广泛应用于制取塑料、消毒剂、农药等。
3. 医药领域:食盐被用于制备多种药物,如生理盐水、盐酸药物等。
4. 冶金工业:食盐可用于炼钢和铸造过程中的脱硫、脱酸等操作。
5. 除雪融冰:在寒冷地区,食盐被用于除雪融冰,因为其与冰有良好的溶解性,可以加速冰的融化。
食盐的分子式为NaCl,它由钠离子和氯离子组成。
食盐具有多种重要的应用和功能,包括食品加工、化学工业、医药领域、冶金工业以及除雪融冰等。
了解食盐的组成和性质,对于我们更好地理解和应用食盐具有重要意义。
生活中常见的盐盐的化学性质一、生活中常见的盐1、氯化钠:白色粉末,水溶液有咸味,溶解度受温度影响不大化学性质:能和硝酸应溶液反响:NaCl + AgNO3=== AgCl↓ + NaNO3用途:〔1〕作调味品〔2〕作防腐剂〔3〕消除积雪〔降低雪的熔点〕〔4〕农业上用NaCl溶液来选种〔5〕制生理盐水〔0.9% NaCl溶液〕Na+ 维持细胞外的水分分布,促进细胞外物质交换Cl- 促生盐酸、帮助消化,增进食欲。
2、碳酸钠:俗称纯碱、打。
白色粉末状固体,易溶于水。
化学性质〔1〕水溶液呈碱性,使紫色石蕊试液变成蓝色,使无色酚酞试液变成红色。
〔2〕能和盐酸反响,是泡沫灭火器的原理。
Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑〔3〕能和氢氧化钙溶液反响: Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH能和氢氧化钡溶液反响: Ba(OH)2 + Na2CO3 === BaCO3↓+ 2NaOH〔4〕能和钙盐、钡盐溶液反响:BaCl2 +Na2CO3=== BaCO3↓+ 2Na ClCaCl2 +Na2CO3=== CaCO3↓+ 2Na Cl用途:用于玻璃、造纸、纺织、洗涤、食品工业等3、碳酸氢钠:俗称小打。
白色粉末、易溶于水化学性质:〔1〕和稀盐酸反响NaHCO3 + HCl === NaCl + H2O + CO2↑〔2〕受热易分解:2NaHCO3 Na2CO3+H2O + CO2↑用途:制糕点所用的发酵粉,医疗上,治疗胃酸过多4、碳酸钙:白色粉末,是石灰石、石、水垢、鸡蛋壳的主要成分化学性质:〔1〕和稀盐酸反响:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑〔2〕高温受热分解:CaCO3CaO+CO2↑用途:补钙剂、建筑材料5、工业盐亚硝酸钠〔NaNO2〕有毒,不能用于烹调食物。
二、粗盐提纯1、实验步骤与实验仪器2、除去粗盐中混有的镁离子、钙离子、硫酸根根子等等可溶性杂质。