293细胞培养基本技术实践(细胞培养传代计数与冻存)
- 格式:ppt
- 大小:514.50 KB
- 文档页数:22
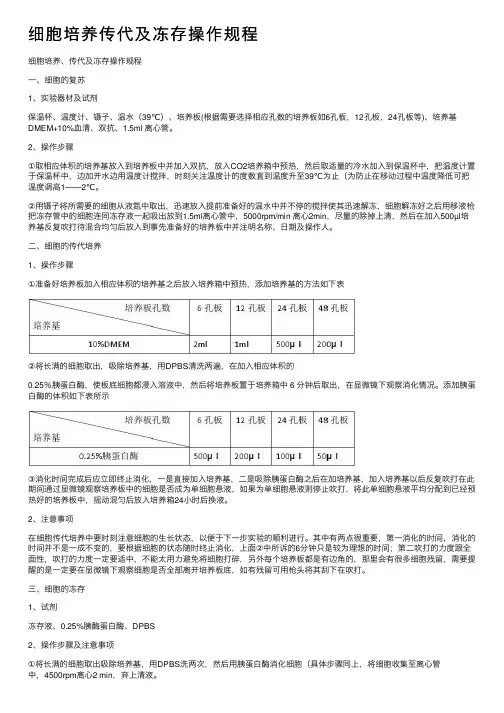
细胞培养传代及冻存操作规程细胞培养、传代及冻存操作规程⼀、细胞的复苏1、实验器材及试剂保温杯、温度计、镊⼦、温⽔(39℃)、培养板(根据需要选择相应孔数的培养板如6孔板,12孔板,24孔板等)、培养基DMEM+10%⾎清、双抗、1.5ml 离⼼管。
2、操作步骤①取相应体积的培养基放⼊到培养板中并加⼊双抗,放⼊CO2培养箱中预热,然后取适量的冷⽔加⼊到保温杯中,把温度计置于保温杯中,边加开⽔边⽤温度计搅拌,时刻关注温度计的度数直到温度升⾄39℃为⽌(为防⽌在移动过程中温度降低可把温度调⾼1——2℃。
②⽤镊⼦将所需要的细胞从液氮中取出,迅速放⼊提前准备好的温⽔中并不停的搅拌使其迅速解冻,细胞解冻好之后⽤移液枪把冻存管中的细胞连同冻存液⼀起吸出放到1.5ml离⼼管中,5000rpm/min 离⼼2min,尽量的除掉上清,然后在加⼊500µl培养基反复吹打待混合均匀后放⼊到事先准备好的培养板中并注明名称、⽇期及操作⼈。
⼆、细胞的传代培养1、操作步骤①准备好培养板加⼊相应体积的培养基之后放⼊培养箱中预热,添加培养基的⽅法如下表②将长满的细胞取出,吸除培养基,⽤DPBS清洗两遍,在加⼊相应体积的0.25%胰蛋⽩酶,使板底细胞都浸⼊溶液中,然后将培养板置于培养箱中 6 分钟后取出,在显微镜下观察消化情况。
添加胰蛋⽩酶的体积如下表所⽰③消化时间完成后应⽴即终⽌消化,⼀是直接加⼊培养基,⼆是吸除胰蛋⽩酶之后在加培养基,加⼊培养基以后反复吹打在此期间通过显微镜观察培养板中的细胞是否成为单细胞悬液,如果为单细胞悬液则停⽌吹打,将此单细胞悬液平均分配到已经预热好的培养板中,摇动混匀后放⼊培养箱24⼩时后换液。
2、注意事项在细胞传代培养中要时刻注意细胞的⽣长状态,以便于下⼀步实验的顺利进⾏。
其中有两点很重要,第⼀消化的时间,消化的时间并不是⼀成不变的,要根据细胞的状态随时终⽌消化,上⾯②中所诉的6分钟只是较为理想的时间;第⼆吹打的⼒度跟全⾯性,吹打的⼒度⼀定要适中,不能太⽤⼒避免将细胞打碎,另外每个培养板都是有边⾓的,那⾥会有很多细胞残留,需要提醒的是⼀定要在显微镜下观察细胞是否全部离开培养板底,如有残留可⽤枪头将其刮下在吹打。

Hela细胞传代培养操作步骤1.观察培养基是否正常,细胞状态如何,细胞密度如何,决定是否传代。
观察时拧紧盖子。
2.加热PBS、versene、培养基,(提前做好) 瓶子不要倒着放,不要让液体接触到瓶塞。
3.打开超净台(先开风机,后开照明),用75%乙醇清洁台面,点燃酒精灯。
不要把废液缸拿出去倒,如果废液太多,可以用其他容器先装废液。
取小离心管一个,置于架子上。
4.取尖吸管、吸量管各一支,放置在专用的架上。
放置的方式,注意吸管、吸量管前端都不要与架子接触。
5.取待传代的细胞。
打开versene,用酒精灯外焰烧。
烧吸管时距离酒精灯心远些,不要把渣滓带进去。
把试剂拿入台子的时候,尽量平稳,不要让试剂碰到瓶口。
6.用吸量管吸取旧的培养基,置离心管中,吸量管加入versene,然后将versene瓶收起来。
(加versene 主要是为了将旧培养基洗去)。
在离心管中间部分将液体加入。
吸液体和加液体时都不要对着细胞。
7.打开胰酶,然后将versene弃掉。
换新管,用尖吸管吸取适量胰酶加入。
加胰酶后,尽快放平,使细胞消化时间一致。
8.将细胞放入37度孵箱。
放孵箱2min, 收胰酶,打开PBS. 之后拿出来镜下随时观察。
使用二次消化法,去除容器中残余的细胞。
别忘了用旧培养基中和。
9.取细胞,镜下观察消化情况。
消化程度合适之后(细胞变圆,但不漂起),用尖吸管弃去胰酶,取离心管中的培养基加入细胞,吹打,至所有细胞从培养皿底部脱落下来。
用PBS洗细胞,versene对细胞有毒性,且不能被血清中和。
然后吸取至离心管中,800 rpm离心5分钟。
10.吸量管吸取适量培养基加入新的培养皿中。
11.细胞离心毕,用吸新培养基的管弃去上清,先把泡沫吸走。
换吸量管吸取培养皿中培养基适量,加入离心管,小体积混匀,将细胞重悬,尖吸管吹匀。
12.擦计数板,用枪吸10ul的液体,计数。
不要把枪伸到离心管内。
13.吸量管吸取细胞悬液,加入新的培养皿中。

精心整理293T细胞培养1.培养基:DMEM=丙酮酸钠++10%血清++青链霉素2.复苏:37度融化后,擦干冻存管酒精擦,细胞加入15ml离心管,加5ml培养基,500g离心5min,弃上清,加1ml培养基重悬后加入到培养瓶中,5~6ml左右,记得晃匀。
也不易打散。
悬浮的293T细胞很容易大规模培养,但不容易长期保持稳定。
293T细胞在传代120次以后,其表型可能改变,生长状况不再完全是单层的了,偶尔会形成局部的细胞成团聚集,应立即抛弃,重新引入新传代的细胞。
293细胞培养特性:1、细胞明显适应酸性环境,pH值在6.9~7.1时,可顺利贴壁生长,换液293T时动作要轻。
一般用高糖的DMEM培养基。
2、传代:倒去废液,PBS洗一次(轻),用0.02%EDTA与0.25%Trypsin消化,生长良好细胞,培养瓶中轻摇,使之流遍所有细胞表面,即将其吸除或弃去消化30s,然后吸去,再让剩下的EDTA/Trypsin作用30s,镜下观察细胞脱落,就可加DMEM终止消化,反复吹打至细胞全成单个悬浮细胞即可。
12小时-24小时90%以上细胞贴壁。
293细胞传代时机为达80-90%汇合,传代比其它的经验:1、用大瓶培养较小瓶要好,可能是更有利于293均匀的分布,利于营养的摄取2、培养液要新鲜,每次只配1000ml,分为2-4瓶,不用的培养液,冻存在-20度,3、要及时传代,最好是细胞基本铺满培养瓶底部,但是细胞之间还没有完全贴紧,总是多少有空隙的时候最好。
4、如果细胞贴壁不好,可能是消化过久,或是培养瓶不够干净,当然要除外细胞污染。
细胞的复苏:快速取出冻存的低代次293细胞,将其安放在底端1/2浸于37℃水浴中,轻轻晃动以加速融解。
在超净工作台中,以70%乙醇对细胞培养皿表面消毒,将细胞转移至75cm的细胞培养瓶中,加入10mL低代次293细胞培养基置于细胞培养箱内培养。
6~8h后待细胞贴壁更换培养基。
(1)利用低代次293细胞贴壁的特性,在复苏和传代时不离心,而是加入10mL培养基中和细胞消化液,培养6~8h,细胞贴壁后更换新鲜培养基,从而避免了离心剪切力对细胞造成的机械损伤;(2)在消化细胞时,振荡培养瓶,避免直接反复剧烈吹打细胞。

一、细胞复苏(1)提前20分钟打开生物安全柜紫外灯消毒待用;10%的FBS-高糖DMEM,青/链霉素,D-Hanks溶液放在37℃水浴锅中预热备用。
(2)快速从液氮罐中取出细胞冻存管,即刻放入37℃水浴锅中解冻,1000r/min 离心5分钟。
(3)吸取弃去上清液,在冻存管中加入培养基混悬细胞,移液器转移至细胞培养皿中,反复两次用培养液清洗冻存管,清洗液也移入培养瓶中。
(4)加入足量的培养液,放在CO培养箱中细胞培养,第二天换液。
2二、细胞冻存(1)提前20分钟打开生物安全柜紫外灯消毒待用;10%的FBS-高糖DMEM,青/链霉素,D-Hanks溶液,DMSO放在37℃水浴锅中预热备用。
生长状态良好的细胞铺满培养瓶底的约80%时,换液后 12~24h 换液培养。
吸去培养液,D-Hanks溶液冲洗瓶底一次再吸弃。
加入 0.25%胰酶到培养瓶,覆盖瓶底,来回转动培养瓶,观察等待细胞消化至多数细胞形状变圆或从瓶底脱落下来。
(2)加入 5ml 含血清的培养液中止消化。
反复吸取瓶内培养液吹打细胞,形成细胞悬液。
进行细胞计数,细胞悬液移植15ml离心管中,3500r/min 离心 5 min。
(3)静置吸弃上清液,然后加入冻存液(73% DMEM 培养液,20%FBS,最后添加 7%DMSO 二甲基亚砜),细胞计数达到2×106/ml 以上。
细胞混匀后加入冻存管中,每管 1ml。
注明细胞种类、代数、冻存时间、名字,检查密封性。
降温程序:冷冻管置于4℃ 10 分钟→-80℃ 16~18 小时(或隔夜)→液氮槽(-196℃)长期储存。
三、细胞传代(1)提前20分钟打开生物安全柜紫外灯消毒待用;10%的FBS-高糖DMEM,青/链霉素,D-Hanks溶液放在37℃水浴锅中预热备用。
当细胞长满培养瓶底的约80%时,吸弃原先的培养液。
(2)加D-Hanks溶液洗涤一次瓶底,吸弃。
加入 0.25%胰酶到培养瓶,覆盖瓶底,来回转动培养瓶,观察等待细胞消化至多数细胞形状变圆或从瓶底脱落下来。

293T细胞培养准则操作规程
百利药业⽣物药研发部
标准操作规程
题⽬:293T细胞传代培养操作规程
编号:SOP-M-e-003-
制定者:(签名)⽇期:年⽉⽇
批准者:(签名)⽇期:年⽉⽇
按照⽣物安全柜的标准操作规程,将⽣物安全柜的紫外开启半⼩时。
3.2将含10%胎⽜⾎清和100U/ml双抗的DMEM及PBS放于37℃⽔浴锅中预热。
3.2.1将已长到80%-90%的293T细胞培养瓶从37℃,5%的CO
培养箱中取出,先⽤75%的酒
2
精喷洒于瓶表⾯,将细胞培养瓶旋转放于⽣物安全柜中,⽤⽆菌的移液管吸净其中的培养基,加5ml的预热的PBS洗涤⼀次,吸净PBS。
3.2.2将含EDTA-0.25%tyption⽤PBS稀释两陪到五倍,向该75cm2的细胞瓶中加⼊3ml稀释好的EDTA-0.25%tyption,让其充分平铺于细胞表⾯。
盖好瓶盖,将细胞瓶放在显微镜下观察,直到细胞变圆,加含10%胎⽜⾎清的DMEM终⽌反应,⽤移液管轻轻将瓶上的细胞吹下,
将细胞液移到15ml⽆菌的离⼼管中,1000rpm离⼼3分钟。
3.2.3将离⼼上清吸弃掉,⽤⼿指轻轻拍打离⼼管底将底部细胞分散开,再加3mlDMEM培养基将分散的细胞重悬稀释开,取⼀定量的细胞液进⾏n倍稀释后计数,按照细胞计数标准操作规程进⾏。
3.2.4计数好之后细胞传代密度按照2~5×104个细胞/cm2进⾏传代培养,每个75cm2的培养瓶中加10mlDMEM培养基,放于37℃,5%的CO
培养箱中培养。
2
3.2.5 24⼩时后观察细胞状态,待细胞长到80%-90%时进⾏下⼀次传代培养。

293细胞培养1.培养基DMEM ++丙酮酸钠++10%血清++青链霉素2.复苏:(1)37度融化后,擦干冻存管酒精擦,细胞加入15ml离心管,加5ml培养基,500g离心5min,弃上清,加1ml培养基重悬后加入到培养瓶中,5~6ml左右,记得晃匀。
3. 传代吸出旧培基,加5mlPBS洗1-2遍,用移液管加1ml胰酶,滚2遍吸出,37度放1min左右计时,看到变圆即加入新培基吹打,几下就好了,分到新瓶里。
我个人认为:293细胞贴壁后形成圆形,可能是细胞本身状态不是很好,细胞不够饱满,细胞的贴壁后的棱角不易显露出来,所以看上去类似圆形,而且细胞较小。
293细胞是用5型腺病毒75株系转化,含有Ad5 E1区的人胚肾亚三倍体细胞系,是一种E1区缺陷互补细胞系。
它是加拿大McMaster University的F.L.Graham与ey 于1976年用DNA转染技术构建而成。
293细胞是贴壁依赖型呈上皮样细胞,表现出典型的腺病毒转化细胞的表型,细胞允许Ad5和其他血清型腺病毒在其上增殖。
哺乳细胞的大规模培养方式有三种:贴壁培养、微载体培养、无血清悬浮培养。
这三种方式均可用于293细胞的大规模培养。
293细胞在无Ca2+或含Ca2+培养基中可同样生长,也可生长在血清浓度降低的培养基中。
单层培养细胞在5-10%FBS-DMEM中能生长很好。
一般来讲,1:10传代后,一周可以长满。
严禁过度生长,这点很重要。
因为会导致细胞密度加大和堆积,影响病毒斑的形成和转染,传代时也不易打散。
悬浮的293细胞很容易大规模培养,但不容易长期保持稳定。
293细胞在传代120次以后,其表型可能改变,生长状况不再完全是单层的了,偶尔会形成局部的细胞成团聚集,应立即抛弃,重新引入新传代的细胞。
293细胞培养特性:1、293细胞明显适应酸性环境,pH值在6.9~7.1时,可顺利贴壁生长, 换液时动作要轻。
一般用高糖的DMEM培养基。
2、传代:倒去废液,PBS洗一次(轻),用0.02%EDTA与0.25%Trypsin消化,生长良好细胞,培养瓶中轻摇,使之流遍所有细胞表面,即将其吸除或弃去消化30s,然后吸去,再让剩下的EDTA/Trypsin作用30s,镜下观察细胞变圆,就可加DMEM终止消化,反复吹打至细胞全成单个悬浮细胞即可。

Hela细胞传代培养操作步骤1.观察培养基是否正常,细胞状态如何,细胞密度如何,决定是否传代。
观察时拧紧盖子。
2.加热PBS、versene、培养基,(提前做好) 瓶子不要倒着放,不要让液体接触到瓶塞。
3.打开超净台(先开风机,后开照明),用75%乙醇清洁台面,点燃酒精灯。
不要把废液缸拿出去倒,如果废液太多,可以用其他容器先装废液。
取小离心管一个,置于架子上。
4.取尖吸管、吸量管各一支,放置在专用的架上。
放置的方式,注意吸管、吸量管前端都不要与架子接触。
5.取待传代的细胞。
打开versene,用酒精灯外焰烧。
烧吸管时距离酒精灯心远些,不要把渣滓带进去。
把试剂拿入台子的时候,尽量平稳,不要让试剂碰到瓶口。
6.用吸量管吸取旧的培养基,置离心管中,吸量管加入versene,然后将versene瓶收起来。
(加versene 主要是为了将旧培养基洗去)。
在离心管中间部分将液体加入。
吸液体和加液体时都不要对着细胞。
7.打开胰酶,然后将versene弃掉。
换新管,用尖吸管吸取适量胰酶加入。
加胰酶后,尽快放平,使细胞消化时间一致。
8.将细胞放入37度孵箱。
放孵箱2min, 收胰酶,打开PBS. 之后拿出来镜下随时观察。
使用二次消化法,去除容器中残余的细胞。
别忘了用旧培养基中和。
9.取细胞,镜下观察消化情况。
消化程度合适之后(细胞变圆,但不漂起),用尖吸管弃去胰酶,取离心管中的培养基加入细胞,吹打,至所有细胞从培养皿底部脱落下来。
用PBS洗细胞,versene对细胞有毒性,且不能被血清中和。
然后吸取至离心管中,800 rpm离心5分钟。
10.吸量管吸取适量培养基加入新的培养皿中。
11.细胞离心毕,用吸新培养基的管弃去上清,先把泡沫吸走。
换吸量管吸取培养皿中培养基适量,加入离心管,小体积混匀,将细胞重悬,尖吸管吹匀。
12.擦计数板,用枪吸10ul的液体,计数。
不要把枪伸到离心管内。
13.吸量管吸取细胞悬液,加入新的培养皿中。

一、293T细胞的冻存1.随着传代的次数增加,293T细胞会出现生长状态下降,出现突变等。
所以要在细胞购进时就进行大量冻存,以保证实验的稳定性和持续性。
2.在细胞对数生长期进行冻存,增加细胞复苏成活率。
3. 倒去细胞上清液,加入D-Hank's液洗去残留的培养基。
4.加入0.25%的胰酶,消化10-20s后倒去。
5. 镜下观察细胞变圆,细胞间间隙加大时,加入新鲜培养基吹打混匀。
6.细胞计数。
7. 将细胞离心,1000rpm,2min。
8.根据计数结果加入细胞冻存液(70%完全培养基+ 20% FBS+ 10% DMSO)重悬细胞,密度为3×106个/ml。
9.分装进细胞冻存管,放入泡沫盒中,放入-80℃超低温冰箱。
10. 第二天将细胞放入液氮灌,并记录。
11.复苏检测细胞存活率,细胞状态等,并记录。
二.293T细胞的传代1. 当细胞生长至汇合率达到80~90%需要对细胞进行传代操作,以扩大细胞数量,维持细胞良好的生长状态。
2.消化细胞,方法同上。
3. 细胞离心结束后,加入完全培养基重悬。
密度为3×105个/ml。
4.分到10cm培养皿中,10ml/皿。
5.放回37℃、3%CO2和95%相对湿度的培养箱中培养。
三. 293T细胞的复苏1.当细胞传代次数过多(超过50代),细胞状态变差时或细胞出现污染事故时,需要丢弃并对开始冻存的细胞进行复苏2. 打开水浴锅,设置温度为40℃。
3.查看细胞库记录,根据记录从液氮灌中取出冻存的细胞(需戴上棉手套,防止被冻伤),迅速丢入水浴锅中并快速晃动,在1~2min内使细胞溶液完全溶解。
4. 将1ml细胞溶液加入9 ml完全培养基中并混匀后转入10cm培养皿。
5.放回37℃、3%CO2和95%相对湿度的培养箱中培养。
6.第二天观察细胞存活率。
倒掉旧的培养基,加入10ml新鲜培养基。
用于包装的293T细胞(ATCC No.CRL-11268)必需选择处于生长旺盛期,细胞状态较佳,存活率90%以上,细胞边缘清晰,传代次数较低。

Tips:HEK293细胞培养⼩技巧把握关键提升细胞成活率很多⼈对细胞培养都是⼜爱⼜恨“情不知所起,⼀往情深” 初⼊细胞培养的⼤坑总要摸索⼀番,才能领悟其精髓⽽前辈经验更是如同指路明灯让⼈瞬间醍醐灌顶,豁然开朗。
293细胞明显适应酸性环境,pH值在6.9~7.1时,可顺利贴壁⽣长,,换液时动作要轻。
⼀般⽤⾼糖的DMEM培养基。
传代:倒去废液,PBS洗⼀次(轻),⽤0.02%EDTA与0.25%Trypsin消化,⽣长良好细胞,培养瓶中轻摇,使之流遍所有细胞表⾯,即将其吸除或弃去消化30s,然后吸去,再让剩下的EDTA/Trypsin作⽤30s,镜下观察细胞变圆,就可添加培养基(DMEM,10%FBS)终⽌消化,反复吹打⾄细胞全成单个悬浮细胞即可。
293细胞传代时机为达80-90%汇合,建议传代⽐例为1:3~1:6。
293细胞在低代时容易贴壁,⽣长良好,在传到⼏⼗代以后,易聚集成团,且贴壁不牢,⽤PBS 冲洗时即可能脱落,即使消化后也不容易吹打成单细胞悬液,最好购⼊时先⼤量冻存。
复苏293细胞的另⼀⽣长特性是贴壁所需时间长且贴壁不牢。
细胞复苏时,都有不同程度的肿胀,若以50ml培养瓶待细胞长满瓶底的70%~80%时消化冻存,复苏时将其全部接种⾄2个50ml瓶中时较为合适。
刚复苏的293贴壁很慢,复苏接种后24⼩时内,应尽量减少观察细胞次数或不作观察,以免因晃动⽽影响细胞贴壁。
复苏后48⼩时左右观察贴壁情况并进⾏⾸次更换培养基⽐较合适,另外需要注意的是在细胞传代或换液步骤前,需要将培养基提前预热。
转染:293细胞进⾏细胞转染时,如果是采⽤磷酸钙转染,⼀定要注意293细胞不要全部长满细胞培养盘,长满细胞时加⼊磷酸钙就会使293细胞⼤⽚的脱落,最好是当293⽣长到1/2或2/3时进⾏磷酸钙转染,可以避免细胞的⼤量脱落。
—END—。


293ft细胞冻存条件293ft细胞是一种广泛应用于细胞生物学研究的细胞系,其广泛应用得益于其易于培养和转染的特性。
在进行293ft细胞培养和实验过程中,细胞冻存是非常重要的一环,具有保存细胞、延长细胞寿命以及避免细胞变异等重要作用。
因此,对293ft细胞的冻存条件进行深入研究,对于保障细胞的质量和实验的准确性具有重要意义。
首先,为了保证293ft细胞的生长状态和避免冻存过程中细胞的损伤,选择适当的细胞培养基是至关重要的。
一般来说,DMEM培养基是较为常用的培养基之一,其成分均衡,含有丰富的营养物质和维生素,适合293ft细胞的生长。
在培养293ft细胞时,还需要添加适量的FBS以提供细胞生长所需的生长因子和营养物质。
此外,对于293ft细胞的冻存还需要在培养基中加入适量的冻存液,以维持细胞在低温条件下的生存状态。
在冻存293ft细胞之前,我们需要对细胞进行准备工作。
首先,要确保细胞在培养皿中生长良好并且处于对数生长期。
其次,需要用PBS缓冲液对细胞进行冲洗,以去除培养基中的残留物质。
随后,用含有细胞冻存液的离心管将细胞进行收集,并迅速进行冻存操作。
对于293ft细胞的冻存条件,温度是至关重要的因素。
一般来说,-80℃是常用的细胞冻存温度,其低温有助于减缓细胞新陈代谢以及降低细胞活性,从而延长细胞的寿命。
此外,在进行细胞冻存时,需要选择合适的冻存液。
DMSO是常用的细胞冻存液之一,其具有较强的渗透性,有助于维持细胞完整性并降低细胞在冰冻过程中的损伤。
除了常见的-80℃冻存条件外,有些实验室还会选择更低温的液氮冻存条件来保存293ft细胞。
液氮冻存温度达到-196℃,极低的温度有助于更好地保护细胞,并且可以有效地避免细胞的变异或污染等问题。
然而,应当注意的是,在进行液氮冻存时需要特别小心谨慎,避免液氮对人体和环境造成伤害。
在细胞冻存过程中,我们还需要注意细胞的解冻条件。
一般来说,细胞冻存后解冻时应该迅速将离心管放入37℃的水浴中快速解冻,并立即转移到预热好的培养基中。
围绕siRNAs的相关实验详细步骤及总结实验一: 细胞传代培养材料: 15ml离心管、枪(头1ml、200ul、10ul)、无菌吸管、培养瓶、含10%FBS 的RPMI—1640(OVCAR-3)、M5A(SKOV-3)、PBS、trypsin等1、步骤: (以下均在超净台内, 酒精灯旁操作)(SKOV-3)2、打开超净台, 将离心管、枪(头)、吸管等工具置于紫外线下照射30min;含10%FBS的RPMI—1640、trypsin、PBS放在37°C水浴恒温箱中预热。
取一个生长良好的细胞培养瓶(密度适中, 细胞成梭形连接, 贴壁良好), 弃旧培养基, PBS 2ml 清洗2次(切勿用力吹打)。
用移液枪取trypsin 1ml沿细胞生长壁对侧壁注入, 然后放平培养瓶, 使贴壁细胞与trypsin充分接触, 置于CO2培养箱2min左右(时间不能太长, 以免损伤细胞)。
4.往培养瓶中加入1640 1~2ml, 随后用移液枪将悬液移到15ml离心管中, 离心1000 r/min, 5min。
5.弃上清液, 加入少量10%FBS的1640培养基使成细胞悬液。
6、分装, 按1:2~3传代, 每瓶4~5ml。
倒置显微镜下观察(细胞突起消失变圆形, 细胞间隙等距), 标记。
7、放入CO2培养箱中培养, 第二天观察生长状况。
总结: 1.在用离心机时, 看清楚是RCF还是RPM;调节Temp.以及Time。
2.在用移液枪吸出trypsin充分消化后的细胞后, 须知用少量培养液清洗一下培养瓶, 并将清洗液移入离心管中。
3、每取用一个容器, 拧开或者拧上盖子时, 注意在酒精灯上旋转一圈。
另外, 记住用酒精棉球经常擦拭台面。
4、在用移液枪或者吸管混匀细胞悬液过程中, 动作轻柔, 避免产生气泡等。
实验二: 细胞冻存材料: 15ml离心管、枪(头1ml、200ul、10ul)、无菌吸管、冻存管、RPMI —1640(OVCAR-3)、M5A(SKOV-3)、FBS、PBS、trypsin、DMSO等步骤: (以下均在超净台内, 酒精灯旁操作)(OVCAR-3)1.打开超净台, 将离心管、枪(头)、吸管等工具置于紫外线下照射30min;FBS、RPMI—1640、trypsin、PBS放在37°C水浴恒温箱中预热。
HEK-293细胞复苏培养及冻存作者:杨彪作者单位:辽宁医学院附属第一医院骨科【摘要】目的通过对人胚肾293细胞的复苏培养及其冻存的研究,为进一步行干细胞标记实验奠定基础。
方法复苏培养人胚肾293细胞,倒置显微镜观察人胚肾293细胞的生长状况,计算细胞贴壁率,绘制细胞生长曲线,冻存保留细胞。
结果人胚肾293细胞在普通培养条件下生长良好,6h后大部分细胞已经贴壁,8h细胞已完全贴壁。
结论人胚肾293细胞采用改进方法复苏培养及冻存是简便可行的,为进一步行干细胞标记实验奠定了坚实的前期基础。
【关键词】人胚肾293细胞细胞培养冻存Anabiosis and Cultivation of HEK-293 Cells and CryopreservationYANG Biao1, MEI Xi-fan1, LIU Fu-qiang2(1.Department of Orthopaedics ,the First Affiliated Hospital of Liaoning Medical University;2.Department of Endocrine,the First Affiliated Hospital of Liaoning Medical University,Jinzhou 121000 China)【Abstract】Objective To lay foundation for establishing substructure of stem cells’ labeling and transplantation therapy experimentation through the research on anabiosis and cultivation of HEK-293 cells and cryopreservation. Methods By resuscitating and cultivating HEK-293 cells, observe them with inverted microscope,calculate adherence rate,draw growth curve, cryopreservate and reserve it. Results HEK-293 cells grow well in the common cultivating conditions. Most of the cells have adherenced after 6 hours, and all cells have adherenced after 8 hours. Conclusions It is convenient and feasible to adopted improved ways to resuscitate and cultivate HEK-293 cells. In this way, we have established substantial substructure of stem cells’ labeling.【Key words】 HEK-293 cells;cell culture;cryopreservation干细胞是近年医学研究的热点之一,并显示了良好的应用前景。
实验4、细胞的传代培养与冻存【实验目的】1.掌握无菌操作技术。
2.掌握传代细胞的培养的一般方法与步骤。
3.掌握培养细胞的消化方法。
4.了解在倒置相差显微镜下观察培养细胞的形态和生长状况。
【实验原理】1.细胞系(Cell Line)与细胞株(Cell Strain)的概念细胞系:初代培养物开始第一次传代培养后的细胞,即称之为细胞系。
如细胞系的生存期有限,则称之为有限细胞系(Finite Cell Line);已获无限繁殖能力能持续生存的细胞系,称连续细胞系或无限细胞系(Infinite Cell Line)。
无限细胞系有的只有永生性(或不死性),但仍保留接触抑制和无异体接种致癌性;有的不仅有永生性,异体接种也有致瘤性- 恶性转化细胞 transformed cell Line细胞株(Cell Strain):从一个经过生物学鉴定的细胞系用单细胞分离培养或通过筛选的方法由单细胞繁殖形成的细胞群,具有特殊性质或标志物。
细胞株的特殊性质或标志必须在整个培养期间始终存在。
由原细胞株进一步分离培养出与原株性状不同的细胞群亦可称2. 传代培养的概念体外培养的原代细胞或细胞株要在体外持续地培养就必须传代,以便获得稳定的细胞株或得到大量的同种细胞,进行下一步的实验并维持细胞种的延续。
当细胞生长达到一定密度后,都需要做传代处理,传代的频率或间隔与培养液的性质、接种细胞的数量和细胞增殖速度有关。
所谓细胞“一代”,即从细胞接种到分离再培养的一段时间(细胞由原培养瓶内分离稀释后传到新的培养瓶的过程称为传代,进行一次分离再培养称之为传一代),如某一细胞系为50代即该细胞已传代50次。
为亚株(substrain)。
3.贴壁型细胞与悬浮型细胞贴壁型细胞:附着在某一固相支持物表面才能生长的细胞。
圆形的细胞-----贴壁----铺展----有丝分裂----对数生长期。
----致密的细胞单层,叫做单层细胞(单层细胞培养). ----表面相互接触时,就停止分裂增殖。
一、实习背景随着生物科学技术的不断发展,细胞培养技术在医学、生物学、药理学等领域中发挥着越来越重要的作用。
为了加深对细胞培养技术的理解,提高自身的实践操作能力,我参加了为期两周的生物细胞培养实习。
本次实习旨在通过实际操作,掌握细胞培养的基本原理、操作步骤和注意事项。
二、实习目的1. 了解细胞培养的基本原理和操作步骤。
2. 掌握细胞传代、冻存、复苏等基本技术。
3. 培养严谨的实验态度和良好的实验习惯。
4. 提高团队合作能力和解决问题的能力。
三、实习内容1. 细胞培养基础知识实习开始前,我们首先学习了细胞培养的基本知识,包括细胞生物学、分子生物学、微生物学等相关知识。
通过学习,我们了解到细胞培养是利用体外培养技术,在适宜的条件下使细胞生长、繁殖的过程。
2. 细胞培养操作步骤(1)细胞复苏:将冷冻保存的细胞取出后,用预温的培养基溶解冻存管中的保护剂,将细胞重悬于培养基中,然后接种于培养皿或培养瓶中。
(2)细胞传代:将培养皿或培养瓶中的细胞用胰酶消化,然后接种于新的培养皿或培养瓶中,进行下一次培养。
(3)细胞冻存:将培养皿或培养瓶中的细胞用预冷的含10%二甲基亚砜(DMSO)的培养基重悬,分装于冻存管中,置于-80℃冰箱中保存。
(4)细胞复苏:将冻存管取出后,置于37℃水浴中解冻,然后接种于新的培养皿或培养瓶中。
3. 实验操作在导师的指导下,我们进行了以下实验操作:(1)观察细胞形态:通过显微镜观察细胞在不同培养阶段的形态变化,了解细胞生长状态。
(2)细胞计数:使用细胞计数板和血球计数器,对细胞进行计数,了解细胞密度。
(3)细胞传代:将培养皿中的细胞用胰酶消化,然后接种于新的培养皿中,进行传代培养。
(4)细胞冻存:将培养皿中的细胞用预冷的含10%二甲基亚砜(DMSO)的培养基重悬,分装于冻存管中,置于-80℃冰箱中保存。
4. 实验结果与分析(1)细胞形态:观察细胞在不同培养阶段的形态变化,发现细胞生长状态良好,呈典型的贴壁生长状态。