可逆电池电动势
- 格式:ppt
- 大小:1.02 MB
- 文档页数:113



可逆电池电动势及应用可逆电池是指在一定条件下,电池的氧化还原反应既可以正向进行,也可以逆向进行,进而可以通过外加电势来实现电能的存储和释放。
可逆电池的电动势是指在电池没有电流通过时,测得的产生的电动势。
可逆电池的电动势主要是由电极反应引起的。
在可逆电池中,每一个电极都有自己的电对,可以分别写出其电对的反应方程式。
例如,在可逆电池中,如果正极是铜,负极是锌,则其电对可以写作:Cu2+ + 2e- -> Cu (正极反应)Zn -> Zn2+ + 2e- (负极反应)在可逆电池中,正极与负极之间既可以发生正极反应,也可以发生负极反应。
当外加电势为正极时,正极反应发生;当外加电势为负极时,负极反应发生。
当外加电势为零时,正负极反应同时发生,而且它们的速率相等。
因此,在可逆电池中,电化学动力学状态迅速达到平衡状态,电池的电动势不会因为正负极反应到达平衡而发生变化。
应用方面,可逆电池具有以下几个方面的重要应用。
1. 电能存储和释放:可逆电池是一种可充放电电池,可以通过外加电势电化学反应的正向和逆向来在化学能和电能之间进行转换。
电池在充电状态下将电能转化为化学能,而在放电状态下将化学能转化为电能。
可逆电池被广泛应用于手机、笔记本电脑、电动车等各种移动设备中,能够实现电能的高效存储和释放。
2. 电源备份:可逆电池的典型例子是蓄电池,它们能够储存电能并在需要时释放出来。
蓄电池被应用于各种场合,如UPS电源、太阳能和风能储能系统、汽车启动电池等。
蓄电池的高可逆性和长寿命使得它们成为电力系统的备用电源,确保供电的稳定性和可靠性。
3. 温度控制:可逆电池也被应用于温度控制的设备中,如恒温器和温度计。
可逆电池在恒温器中起到稳定温度的作用,通过测量温度引起的电动势差,来调整继电器的工作状态,从而实现恒定的温度控制。
4. 电化学分析:可逆电池的电动势在电化学分析中也具有重要的应用价值。
通过测量可逆电池的电动势变化,可以对溶液中的阳离子或阴离子进行定量分析。

测定可逆电池电动势的方法嘿,咱今儿个就来聊聊测定可逆电池电动势的那些事儿!你说这可逆电池电动势,就好像是一个神秘的小宝藏,得用合适的方法才能把它给挖出来。
那都有啥方法呢?有一种常见的方法叫对消法。
这就好比是在一场拔河比赛中,我们要找到两边力量平衡的那个点。
通过一个能产生稳定电压的装置,和我们要测的可逆电池对着干,直到它们俩的力量相互抵消,这时候我们就能准确地知道这个电动势是多少啦!你想想,是不是挺有意思的?还有电位差计法呢!就好像是给这个电动势来个精准的“量身定制”。
电位差计就像是一把超级精确的尺子,能把电动势的大小给量得清清楚楚。
它能让我们更直观地了解这个神秘小宝藏的具体数值。
咱再说说盐桥法。
这就好像是给电池搭了一座小桥,让里面的离子能顺畅地流动,减少了阻碍,从而让我们能更好地测定电动势。
这桥搭得好呀,测定起来就更轻松啦!你可别小看这些方法,每一种都有它的独特之处呢!就像我们每个人都有自己的拿手好戏一样。
它们能帮助我们揭开可逆电池电动势的神秘面纱,让我们对电的世界有更深入的了解。
在实际操作中,那可得小心谨慎,就跟走钢丝似的,一点差错都不能有。
稍有不慎,可能测出来的结果就不靠谱啦!所以呀,一定要认真对待,就像对待宝贝一样。
测定可逆电池电动势的方法就像是打开电世界大门的钥匙,有了它们,我们才能在这个充满奥秘的领域里畅游。
我们能更好地理解电池的工作原理,说不定还能发明出更厉害的电池呢!那时候,我们的生活可就变得更加便捷和精彩啦!总之,这些方法各有千秋,我们要根据实际情况选择最合适的那个。
就像我们挑鞋子一样,得合脚才行呀!让我们一起好好利用这些方法,去探索可逆电池电动势的奇妙世界吧!。

实验十六可逆电池电动势的测定一、实验目的测量铜-锌原电池的电动势,计算反应的热力学函数。
了解电动势的测量原理和方法。
二、实验原理电池反应中,摩尔吉布斯函数[变]、摩尔熵[变],反应热分别为(1)(2)(3)(4)可见,只要测出某一电池反应的电动势E及其温度系数(∂E/∂T),,就可算出热力学函数。
可逆电池的电动势数据可用于热力学计算。
可逆电池电动势的测量条件除了电池反应可逆和传质可逆外,还要求在测量回路中电流趋近于零。
测定电动势不能用伏特计。
因为电池与伏特计相接后会有电流通过,电池中电极被极化,电解液组成也会发生变化。
所以伏特计只能测得电池电极间的电势降,而不是平衡时的电动势。
利用对消法可使我们在测量回路中电流趋于零的条件下进行测量,所测得的结果即为可逆电池的电动势。
对消法电路如图8-1所示。
acBa回路由工作电源、可变电阻和电位差计组成。
工作电源的输出电压必须大于待测电池的电动势。
调节可变电阻使流过回路的电流为某一定值,在电位差计的滑线电阻上产生确定的电势降,其数值由已知电动势的标准电池Es校准。
另一回路abGExa由待测电池Ex、检流计G和电位差计组成。
移动b点,当回路中无电流通过时.电池的电动势等于a、b两点的电势差。
对消法测电动势是一个接近热力学可逆过程的例子。
为了尽可能减小电池中溶液接界外因扩散产生的非平衡液接电势,两电极间用盐桥连通。
三、仪器试剂直流电势差计一台;光点反射检流计一台;标准电池一个;于电池(1.5V)两节;铜电极、锌电极(带电极池)各一支;超级恒温器一台;0.100mol·dm-3硫酸铜和硫酸锌溶液若干;饱和氯化钾溶液;2.00mol·dm-3硫酸溶液;6.00mol·dm-3硝酸溶液;丙酮试剂(A.R.);小烧杯;金相砂纸。
四、实验步骤先对电极进行预处理。
用金相砂纸把电极片抛光,用水冲洗后在丙酮液中浸洗数分钟,再用稀硫酸和稀硝酸浸洗。
然后将电极用蒸馏水冲洗于净。

可逆电池电动势的测定实验报告实验报告:可逆电池电动势的测定一、实验目的1.掌握可逆电池电动势测定的原理和方法。
2.学习使用电位差计测量电池电动势。
3.理解可逆电池电动势与反应物质、温度等因素的关系。
二、实验原理可逆电池是指在一定条件下,能够完全逆向恢复到初始状态的电池。
可逆电池的电动势是指电池在开路状态下正负极之间的电位差,是电池反应的重要参数之一。
本实验采用标准电池和待测电池进行电动势的测量,通过比较两者的差异,可以得到待测电池的电动势。
三、实验步骤1.准备实验器材:电位差计、标准电池、待测电池、电阻箱、恒温水槽、温度计、电解质溶液等。
2.将电位差计与标准电池和待测电池连接,调整电阻箱阻值,使得电位差计指示为零。
3.将标准电池和待测电池放入恒温水槽中,记录温度。
4.根据实验原理,计算标准电池的电动势E0(已知)。
5.按照相同条件,测量待测电池的电动势E1。
6.根据测量结果,计算待测电池的电动势E1(未知)。
7.分析实验数据,得出实验结论。
四、实验结果与数据分析1.标准电池的电动势E0=1.018V(已知)。
2.待测电池的电动势E1=1.015V(未知)。
3.比较标准电池和待测电池的电动势,发现两者相差较小,说明待测电池的电动势较为准确。
4.分析实验数据,发现可逆电池的电动势与反应物质、温度等因素有关。
随着反应物质浓度的降低或温度的升高,电动势会相应减小。
这表明可逆电池的反应速率与电动势密切相关。
5.通过本实验,我们掌握了可逆电池电动势的测定方法,学会了使用电位差计进行电动势的测量,加深了对可逆电池工作原理的理解。
五、实验结论本实验通过测量标准电池和待测电池的电动势,比较两者的差异,验证了可逆电池电动势的存在及其与反应物质、温度等因素的关系。
实验结果表明,随着反应物质浓度的降低或温度的升高,电动势会相应减小。
这表明可逆电池的反应速率与电动势密切相关。
通过本实验,我们进一步加深了对可逆电池工作原理的理解,掌握了可逆电池电动势的测定方法。

可逆电池电动势的测定实验报告实验目的:掌握利用可逆电池的电动势进行测定的方法,探究电动势与浓度、温度的关系。
实验器材:标准氯化银电极、0.1mol/L AgNO3溶液、电解池、热水槽、温度计、万用表、导线等。
实验原理:可逆电池是指电极间反应完全可逆的电池,在理想状况下,可逆电池的电动势与电极间的化学势差相等。
因此,可逆电池可以用来测量其他电池电动势或溶液中离子的标准电位。
实验步骤:1.将标准氯化银电极置于电解池中,并将电解池连接至万用表的正负极。
2.将电解池中注入0.1mol/L AgNO3溶液,使电极完全浸没其中。
3.将电解池置于热水槽中,通过热水槽中的温度计调节溶液的温度。
记录温度。
4.在稳定温度的条件下,打开万用表的电源开关,等待电动势稳定后记录电动势。
5.将温度调节至不同的数值,重复步骤4并记录相应的电动势和温度。
实验结果:温度(℃)电动势(V)200.78300.80400.82500.84600.86实验分析:根据实验结果,我们可以发现随着温度的升高,电动势的数值也逐渐增加。
这是因为随着温度的升高,反应速率也加快,更多的电子参与了氯化银的还原,从而增加了电池的电动势。
实验结论:根据实验结果,我们可以得出结论:电动势与温度呈正相关关系。
这一结论在工业应用中具有重要意义,因为在实际使用电池的过程中,温度的变化会影响电动势的稳定性,从而对电池的性能产生影响。
实验中可能存在的误差:1.离子浓度的变化未考虑。
溶液中的Ag+浓度可能随着反应过程发生变化,影响电动势的测量结果。
2.极化现象的影响。
在实验过程中,电解池可能发生了极化现象,导致电极反应不完全,并影响电动势的测定结果。
3.万用表的误差。
万用表的精度限制了电动势测量结果的准确性。
为减小误差,可以采取以下措施:1.在实验过程中定期检查溶液中的Ag+浓度,保持其稳定。
2.进行电化学预处理,减小电解池的极化现象。
3.使用高精度的电位计或泳报仪进行电动势测量,提高测量结果的准确性。


实验可逆电池电动势的测定(1)实验可逆电池电动势的测定1. 实验介绍可逆电池是指在反应进行过程中,反应物与生成物之间的浓度或压强的变化对电动势没有影响,且可逆方向与正方向的电动势相等的电池。
本实验主要研究几种可逆电池的电动势的测量方法及原理。
2. 实验材料与设备- 在常温(25℃)下工作的比色皿、三角搅拌棒、移液管、容量瓶、50ml烧杯、电子天平;- 物质:氧化还原剂、还原剂溶液及其他用品;- 电池:阳极和阴极为铜/铜离子电极的Cu/CuSO4电池,钬/钬离子电极和PbO2/PbSO4电池等。
3. 实验步骤1)用容量瓶测量CuSO4溶液的第一小于0.1电位电动势,记录浓度,即Cu2+Molar2)将新制备的0.1mol/L AgNO3溶液定容于50ml烧杯中3)在容量瓶中加入5mg的活性炭,并加足够的去离子水。
将瓶子摇匀,然后倒入烧杯中,使其变成混浊状态。
4)在另外一个50ml烧杯中加入3~4g的CuSO4.5H2O,加足够的去离子水,搅拌至溶解。
5)将Cu2+溶液慢慢倒入另一个50ml烧杯中。
待溶液保持稳定后,取10ml分别装入两个比色皿中6)在1ml单质铜管中加入一只Cu/Ni电池片,将其插入电路中7)等待30秒后,将铜管取出,用三角搅拌棒搅动烧杯中的溶液8)将大约5~6mg的道盖盖住肉眼可见的溶液4. 实验结果结论:通过本实验,我们测定了Cu/CuSO4、PbO2/PbSO4、钴/钴离子电池的电动势,得到了可逆电池的准确测量,并给出了它们的数据表。
5. 实验结论通过本实验,我们得出了可逆电池的电动势的正确测量方法,提高了测量结果的准确度,进一步深化了我们对实验过程原理的理解和掌握。
电池的可逆电动势名词解释电池是一种将化学能转化为电能的装置。
它是由一个或多个电池单元组成的,每个电池单元包含两个电极(一个负极和一个正极),它们之间通过电解质连接。
电池的可逆电动势是指在没有电流流动时,电池中负极和正极之间的露脱电位差。
本文将解释电池的可逆电动势的含义以及影响因素。
可逆电动势是指在理想条件下,电池在无电流通过的情况下能够实现的最大电势差。
这个电势差是由电池中发生的在正极和负极之间的化学反应引起的。
当没有电流流过电池时,电池的正极和负极之间存在一个全面停留的平衡态,这时可测量到的电势差即为电池的可逆电动势。
两个主要影响电池可逆电动势的因素是离子活性和温度。
离子活性是指溶液中的化学物质含量,它影响电池中的化学反应速率,并直接影响到电池中正极和负极之间的电位差。
温度则会影响化学反应速率,并改变电池中的离子扩散速度,因此也会对电池的可逆电动势产生影响。
电池的可逆电动势是电池性能的重要指标之一。
较高的可逆电动势意味着电池具有更高的化学反应能力,能够产生更大的电势差。
这也意味着电池能够提供更高的电流和更稳定的电压输出。
因此,对于需要高电压和高电流输出的应用,选择具有较高可逆电动势的电池是非常关键的。
然而,实际情况下,电池的可逆电动势是很难完全实现的。
在真实的工作条件下,由于电流流动和能量转化的不可避免的损耗,电池中会存在一定的内部电阻,并引起电池的电压下降。
这被称为电池的极化。
极化的程度取决于电流的大小和电池内部的反应速率。
因此,实际的电池电动势会小于可逆电动势。
要提高电池的可逆电动势,可以通过优化电池的设计和使用更高效的电极材料来实现。
例如,选择更高活性的化学物质作为正负极材料,提高电池中的反应速率和离子迁移速度。
此外,还可以通过优化电解质的种类和浓度,调整温度等控制因素来改善电池的可逆电动势。
总而言之,电池的可逆电动势是指在理想条件下,电池在无电流流动时可以达到的最大电势差。
该电势差受离子活性和温度等因素的影响。
第九章可逆电池电动势将化学能转化为电能的装置称原电池,根据热力学上可逆过程和不可逆过程的概念,原电池可区分为可逆电池不可逆电池可逆电池可揭示化学能转变为电能的最高极限,为此重点讨论之。
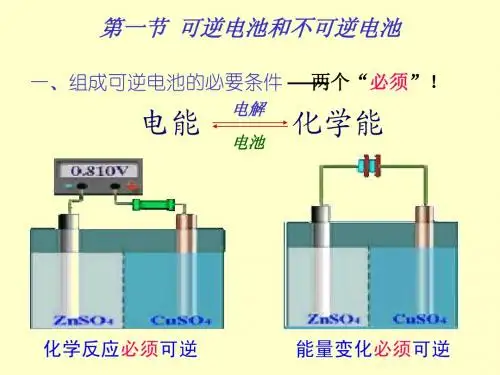
在可逆电池中,系统自由能的降低(△rGm)T.P等于系统对外所作的最大电功Wr′,此时,两电极间电势差达最大值,称为电池的电动势E,其间关系为(△rGm)T.P= Wr′=-nFE若反应物质的量为1mol时,则(△rGm)T.P=-zFE那么,什么是可逆电池呢?§9.1可逆电池和可逆电极1.可逆电池必须具备的条件(1)电池放电反应与充电反应必须互为逆反应。
对电池a当E>V,电池放电时Zn极(负):Zn-2e=Zn2+(氧)Cu极(正):Cu2++2e= Cu (还)放电反应:Zn+ Cu2+= Zn2++ Cu (自)当E<V,电池充电时Zn极(阴):Zn2++2e=Zn (还)Cu极(阳):Cu-2e= Cu2+(氧)充电反应:Zn2++ Cu= Zn+ Cu2+(非)可见电池a的充、放电反应互为逆反应。
图(略)但对电池b,当E>V,电池放电时Zn极(负):Zn-2e=Zn2+(氧)Cu极(正):2H++2e=H2(还)放电反应:Zn+2H+= Zn2++ H2(自)当E<V,电池充电时Zn极(阴):2H++2e=H2(还)Cu极(阳):Cu-2e= Cu2+(氧)充电反应:Cu+2H+= Cu2++ H2(非)可见,电池b的充、放电反应不为逆反应,因此,它不可能是可逆电池。
(2)电池所通过的电流必须为无限小。
并不是任何充放电的反应互为逆反应的电池都是可逆电池。
据热力学可逆过程概念,只有当E与V相差无限小dE,即V=E±dE使通过的电流无限小,才不会有电功不可逆地转化为热的现象。
这样,放电时,电池作最大有效功,充电时,消耗电功最小。
只有同时满足以上两个条件的电池才是可逆电池。
也就是可逆电池在充、放电时,不仅物质的转化是可逆的,而且能量的转化也是可逆的。