09章_可逆电池的电动势及其应用
- 格式:ppt
- 大小:3.34 MB
- 文档页数:118

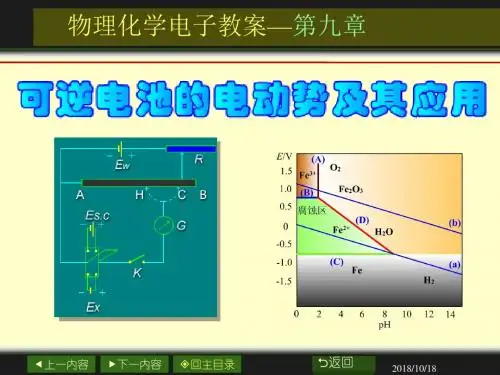
第九章 可逆电池的电动势及其应用【复习题】【1】可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应,对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?【答】可逆电极主要有三类:A.第一类电极:由金属浸在含有该金属离子的溶液中组成。
如锌电极 22()|()Zn Zn a Zn s ++ 22()2()Zn Zn a e Zn s ++-+→ 222,,1ln2Zn Zn Zn ZnZn RT F a θϕϕ+++=- 属于第一类电极的除了金属电极外,还有气体电极(比如氢电极、氧电极和卤素电极)和汞齐电极等。
B. 第二类电极:包括难溶盐电极和难溶氧化物电极难溶盐电极:由金属表面覆盖一薄层该金属的难溶盐,然后浸在含有该难溶盐的负离子的溶液中组成。
例如甘汞电极 ()|()|(Cl Cl a AgCl s Ag s -- ()()()Cl AgCl s e Ag s Cl a ---+=+ ln Cl RTa Fθϕϕ-=-难溶氧化物电极:由金属表面覆盖一薄层该金属的难溶氧化物,然后浸在含有H +或OH -离子的溶液中组成。
例如汞-氧化汞电极()()|Hg s HgO s H OH +--或(a )2()2()2()HgO s H O e Hg s OH a --++=+ ln RTa Fθϕϕ=-C.第三类电极:叫氧化还原电极。
由惰性金属(如铂片)插入含有某种离子的不同氧化态溶液中构成的电极。
例如3232(),()|()Fe Fe Fe a Fe a Pt s ++++3212()()Fe a e Fe a +-++→ 32321,,2ln Fe Fe Fe Fe a RT F a θϕϕ++++=- 对于气体电极和氧化还原电极在书写电极表示式时应注意:要有惰性金属作为导体,惰性金属只传导电子,不发生化学变化。
【2】什么叫电池的电动势?用伏特表测得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?【答】(1)电池的电动势是原电池组成相间的各界面上所产生的电势差的代数和。
![[理学]9章可逆电池的电动势及其应用](https://uimg.taocdn.com/1cc58d7177232f60ddcca1c9.webp)







09-可逆电池的电动势及其应用(课程习题解)第九章可逆电池的电动势及其应用习题及解答(2022.3)【1】写出下列电池中各电极的反应和电池反应。
(1)Pt|H2(pH2)|HCl(a)|Cl2(pCl2)|Pt;(2)Pt|H2(pH2)|H(aH)||Ag(aAg)|Ag();(3)Ag()|AgI()|I(aI)||Cl(aCl)|AgCl()|Ag();2(aSO2)||Cu2(aCu2)|Cu();(4)Pb()|PbSO4()|SO44(5)Pt|H2(pH2)|NaOH(a)|HgO()|Hg(l);(6)Pt|H2(pH2)|H(aq)|Sb2O3()|Sb();(7)Pt|Fe3(a1),Fe2(a2)||Ag(aAg)|Ag();(8)Na(Hg)(aam)|Na(aNa)||OH(aOH)|HgO()|Hg(l).【解】(1)负极:H2(pH2)2e2H(aH)正极:Cl2(pCl2)2e2Cl(aCl)电池反应:H2(pH2)Cl2(pCl2)2HCl(a)(2)负极:H2(pH2)2e2H(aH)正极:2Ag(aAg)2e2Ag()电池反应:H2(pH2)2Ag(aAg)2Ag()2H(aH)(3)负极:Ag()I(aI)eAgI()正极:AgI()eAg()Cl(aCl)电池反应:AgCl()I(aI)AgI()Cl(aCl)2(aSO2)2ePbSO4()(4)负极:Pb()SO44正极:Cu2(aCu2)2eCu()2(aSO2)PbSO4()Cu()电池反应:Pb()Cu2(aCu2)SO44(5)负极:H2(pH2)2OH(aOH)2e2H2O(l)正极:HgO()H2O(l)2e2OH(aOH)Hg(l)电池反应:H2(pH2)HgO()Hg(l)H2O(l)(6)负极:3H2(pH2)6e6H(aq)正极:Sb2O3()6H(aq)6e2Sb()3H2O(l)电池反应:3H2(pH2)Sb2O3()2Sb()3H2O(l)(7)负极:Fe2(a2)eFe3(a1)正极:Ag(aAg)eAg()电池反应:Fe2(a2)Ag(aAg)Fe3(a1)Ag()(8)负极:2Na(Hg)(aam)2e2Na(aNa)2Hg(l)正极:HgO()H2O(l)2e2OH(aOH)Hg(l)电池反应:2Na(Hg)(aam)HgO()H2O(l)2Na(aNa)2OH(aOH)3Hg(l)【3】(1)Weton标准电池为Cd(Hg)CdSO48/3H2O()饱和CdSO4(aq)Hg2SO(Hg4)写出电极反应和电池反应;(2)从饱和Weton标准电池的电动势与温度的关系式:E/V1.018454.05105(T/K293.15)9.5107(T/K293.15)2试求在298.15K,当电池可逆地产生2mol电子的电荷量时,电池反应的rGm,rHm和rSm。

9. 1 分(4490)4490已知φ (Zn2+,Zn)=-0.763 V, 则下列电池反应的电动势为:Zn(s)+2 H+(a=1)=Zn2+(a=1)+H2(p ) ( )(A) -0.763 V (B) 0.763 V(C) 0 V (D) 无法确定12. 2 分(4201)4201写出25℃时,电池Sb(s)│Sb2O3(s)│KOH(m),KCl(m')│H2(g,p ),Pt 的负极反应_____________________________,正极反应________________________,以及电池的总反应______________________________________________________ 。
14. 2 分(4441)4441下列两个反应:Pb(Hg) ─→Pb2+(a) + 2e-+ Hg(l)Pb ─→Pb2+(a) + 2e-其电极电势公式分别为及,这两个反应相应的φ 及φ 是否相同?16. 2 分(4801)4801电池Pb(s)│H2SO4(m)│PbO2(s),作为原电池时,负极是,正极是;作为电解池时,阳极是,阴极是。
19. 15 分(6719)671918℃时,测定了下列电池的电动势E:Hg(l)|Hg2Cl2(s)|KCl(1 mol·dm-3)||溶液S|CaC2O4(s)|Hg2C2O4(s)|Hg(l)若溶液S中含有0.1 mol·dm-3 NaNO3及0.01 mol·dm-3 Ca(NO3)2时, E1 = 324.3 mV;当溶液S中含有0.1 mol·dm-3 NaNO3但含Ca2+不同时, E2 = 311.1 mV。
(1) 写出电极反应和电池反应;(2) 计算在后一种情况下溶液S中Ca2+的浓度。
1. 5 分(4446)444625℃,将含有Fe 2+和Fe 3+的水溶液与 Fe 粉一起振荡,使其达平衡,求出 K = [Fe 2+]3[Fe 3+]-2= 8.98×1040,其φ (Fe 2+/Fe) = -0.4402 V ,则下列答案正确的是: ( )(A) φ (Fe 3+/Fe 2+) = 0.771 V , φ (Fe 2+/Fe) = 0.3308 V(B) φ (Fe 3+/Fe 2+) = 1.6514 V , φ (Fe 2+/Fe) = 0.8439 V(C) φ (Fe 3+/Fe 2+) = 0.771 V , φ (Fe 2+/Fe) = -0.0365 V(D) φ (Fe 3+/Fe 2+) = 1.6514 V , φ (Fe 2+/Fe) = -0.0365 V4. 5 分 (4196)4196298 K 时,已知E (Cu 2+|Cu)=0.337 V ,E (Zn 2+|Zn)= - 0.7628 V ,则电池Zn(s)|Zn 2+(a 1=1)||Cu 2+(a 2=1)|Cu(s)的E =______________,电池反应的平衡常数K a =_________________,当电能耗尽时,两离子的活度比a 1/a 2=____________________。