可逆电池的电动势及其应用物理化学
- 格式:pdf
- 大小:969.45 KB
- 文档页数:30





第八章可逆电池的电动势及其应用物化试卷(一)1.下列电池中,哪个电池的电动势与 Cl-离子的活度无关?(A) Zn│ZnCl2(aq)│Cl2(g)│Pt(B) Zn│ZnCl2(aq)‖KCl(aq)│AgCl(s)│Ag(C) Ag│AgCl(s)│KCl(aq)│Cl2(g)│Pt(D) Hg│Hg2Cl2(s)│KCl(aq)‖AgNO3(aq)│Ag2.下列对原电池的描述哪个是不准确的:(A) 在阳极上发生氧化反应(B) 电池内部由离子输送电荷(C) 在电池外线路上电子从阴极流向阳极(D) 当电动势为正值时电池反应是自发的3.用补偿法(对消法)测定可逆电池的电动势时,主要为了:(A) 消除电极上的副反应(B) 减少标准电池的损耗(C) 在可逆情况下测定电池电动势(D) 简便易行4.用对消法测定由电极Ag(s)│AgNO3(aq) 与电极Ag,AgCl(s)│KCl(aq) 组成的电池的电动势,下列哪一项是不能采用的?(A) 标准电池(B) 电位计(C) 直流检流计(D) 饱和KCl盐桥5.若算得电池反应的电池电动势为负值时,表示此电池反应是:(A) 正向进行(B) 逆向进行(C) 不可能进行(D) 反应方向不确定6.电池电动势与温度的关系为:298 K 时,电池可逆放电,则:(A) Q > 0 (B) Q < 0(C) Q = 0 (D) 不能确定7.25℃时,φ(Fe3+,Fe2+) = 0.771 V,φ (Sn4+,Sn2+) = 0.150 V,反应的为:(A) -268.7 kJ/mol (B) -177.8 kJ/mol(C) -119.9 kJ/mol (D) 119.9 kJ/mol8.某燃料电池的反应为: H2(g)+ O2(g) ---> H2O(g) 在 400 K 时的Δr H m和Δr S m分别为 -251.6 kJ/mol和 -50 J/(K·mol),则该电池的电动势为:(A) 1.2 V (B) 2.4 V(C) 1.4 V (D) 2.8 V9.某电池在等温、等压、可逆情况下放电,其热效应为Q R, 则:(A) Q R=0 (B) Q R=ΔH(C) Q R=TΔS (D) Q R=ΔU10.金属与溶液间电势差的大小和符号主要取决于:(A) 金属的表面性质(B) 溶液中金属离子的浓度(C) 金属与溶液的接触面积(D) 金属的本性和溶液中原有的金属离子浓度11.Li - Cl2电池结构如下:Li│LiCl((饱和液)有机溶剂)│Cl2(p)│Pt 已知[LiCl(s)] = -384 kJ/mol,则该电池的电动势值 E 为:(A) 1 V (B) 2 V (C) 3 V (D) 4 V12.有两个电池,电动势分别为E1和E2:H2(p)│KOH(0.1 mol/kg)│O2(p) E1H2(p)│H2SO4(0.0l mol/kg)│O2(p) E2比较其电动势大小:(A) E1< E2 (B) E1> E2(C) E1= E2 (D) 不能确定13.已知:(1) Cu│Cu2+(a2)‖Cu2+(a1)│Cu 电动势为 E1 (2) Pt│Cu2+(a2),Cu+(a')‖Cu2+(a1),Cu+(a')│Pt 电动势为 E2,则:(A) E1=E2 (B) E1= 2 E2(C) E1= E2 (D) E1≥ E214.在298 K将两个 Zn(s)极分别浸入 Zn2+ 离子活度为0.02和0.2的溶液中, 这样组成的浓差电池的电动势为:(A) 0.059 V (B) 0.0295 V(C) -0.059 V (D) (0.059lg0.004) V15.电池Pb(Hg)(a1)│Pb2+(aq)│Pb(Hg)(a2) 要使电动势E>0, 则两个汞齐活度关系为:(A) a1>a2 (B) a1=a2(C) a1<a2 (D)a1与a2可取任意值16.关于液体接界电势 Ej, 正确的说法是:(A) 只有电流通过时才有Ej存在(B) 只有无电流通过电池时才有 Ej(C) 只有种类不同的电解质溶液接界时才有Ej(D) 无论电池中有无电流通过, 只要有液体接界存在, Ej总是存在17.测定溶液的 pH 值的最常用的指示电极为玻璃电极, 它是:(A) 第一类电极(B) 第二类电极(C) 氧化还原电极(D) 氢离子选择性电极18.已知 298 K 时,φ (Ag+,Ag)=0.799 V, 下列电池的 E为0.627 V . Pt, H2│H2SO4(aq)│Ag2SO4(s)│Ag(s) 则 Ag2SO4的活度积为:(A) 3.8×(B) 1.2×(C) 2.98×(D) 1.52×19.通过电动势的测定,可以求难溶盐的活度积,今欲求 AgCl 的活度积,则应设计的电池为:(A) Ag│AgCl│HCl(aq)‖Cl2(p)│Pt(B) Pt│Cl2│HCl(aq)‖AgNO3(aq)│Ag(C) Ag│AgNO3(aq)‖HCl(aq)│AgCl│Ag(D) Ag│AgCl│HCl(aq)‖AgCl│Ag20.电池(1) Ag(s)│AgNO3(a1)‖AgNO3(a2)│Ag(s) 电动势为 E1 电池(2) Ag(s)│AgNO3(a1)┆AgNO3(a2)│Ag(s) 电动势为 E2,其液接电势为 EJ。
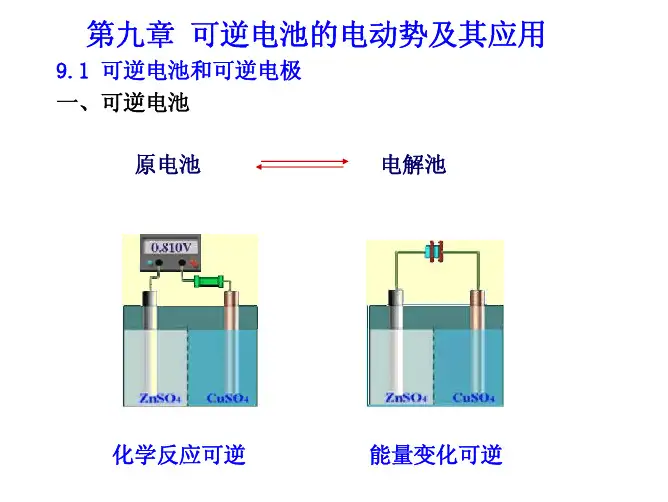


第九章 可逆电池的电动势及其应用1. 原电池是使化学能能为电能的装置,其主要组成是两个电极和电解液,在等温等压条件下,体系发生变化时,系统吉氏自由能的减少等于对外所做的最大膨胀功.此时转变过程以热力学可逆方式进行,电池为可逆电池.()f ,max r T,pG W =V若非膨胀功只有电功,则(),r T p G nEF =-V如果可逆电动势为E 的电池按电池反应进行进度ξ=1mol 时吉氏自由能的变化值可以写成: ()r T,p G zEF =-V2. 该式是联系热力学和电化学扩要桥梁.可逆电池必须满足的两个条件:1. 电极上的化学反应可向正、反两个方向进行。
可逆电池工作时,电池是在接近平衡养状态下工作的。
可逆电极有以下三种类型:第一类电极:由金属浸在含有该金属离子的溶液构成。
第二类电极:由金属表面覆盖一该金属难溶盐薄层,然后浸入含有该难溶盐负离子的溶液构成。
第三类电极:由惰性金属插入含有某种离子的不同氧化态的溶液中构成电极。
电池的电动势不能直接用伏特计测量。
一般使用对消法。
需要一个电动势已知并且稳定的辅助电池,即标准电池。
常用的标准电池是韦斯顿标准电池。
电极中还包括标准氢电极。
人为规定其电极电势为0电池的书面表示采用的规则是,负极写在在方,进行氧化反应,正极写在右方,进行还原反应用单垂线表示不同物相的界面,用双垂线表示盐桥。
不觉 应注意气体应注明压力,电解质溶液应注明活度。
在书面电极和电池反应时应遵守物量和电荷量守衡。
电动势产生机理:(1)电极与电解质溶液界面间形成的电势差。
(2)接触电势。
(3)液体接界电势。
液接电势可以通过盐桥来减小。
3.可逆电池的热力学及电动势测定的应用。
Nerst 方程 g hGHc dC DIn a a RT E E zF a a =- In RTE K zF=r m T p E S zF ∂⎛⎫= ⎪∂⎝⎭V ,m T r pE H zEF zFT ∂⎛⎫=-+ ⎪∂⎝⎭Vr m R pE Q T S zFT T ∂⎛⎫=⋅= ⎪∂⎝⎭V还原电极电势:Ina RT zF a ϕϕ=--还原态氧化态应用:求电解质溶液的平均活度因子; 求难溶盐的溶度积; pH 值的测定:()s r x s pH pH In10E EF RT -==典型例题讲解例1 以M 代表某金属,MCl 2是其氧化物,是强电解质,设下列电池:()12M|MCl 1mol kg |AgCl|Ag -⋅在0~60℃间的电动势E 与温度之间的关系为: 57 =1.200V+4.0010V+9.0010V E --⨯⨯,25℃时,()()2M |M 0.9636,Ag |Ag |Cl 0.2223V E E ++-==-==(1)写出电极反应及电池反应。

宁波工程学院物理化学实验报告专业班级姓名序号实验日期同组姓名指导老师实验名称电动势的测定及应用一、实验目的1、通过实验加深对可逆电池、可逆电极、盐桥等概念的理解。
2、掌握对消法测定电池电动势的原理及电位差计的使用方法。
3、通过电池Ag | AgNO3(b1) || KCl(b2) | Ag-AgCl |Ag的电动势求AgCl的溶度积Ksp。
4、了解标准电池的使用和不同盐桥的使用条件。
二、实验原理1、可逆电池的电动势:电池的书写习惯是左方为负极,右方为正极。
如果电池反应是自发的,则电池电动势为正。
符号“|”表示两相界面,“||”表示盐桥。
在电池中,电极都具有一定的电极电势。
当电池处于平衡态时,两个电极的电极电势之差就等于该可逆电极电势。
规定电池的电动势等于正负电极的电极电势之差,即:E = ψ+-ψ-可逆电池必须具备的条件为:1、电极上的化学反应可向正反两个方向进行,即反应可逆;2、电池在工作(充放电)时,所通过的电流必须无限小,此时电池可在接近平衡状态下工作,即能量可逆;3、电池中所进行的其它过程可逆。
如溶液间无扩散、无液体接界电势;因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量时,常用正负离子迁移数比较接近的盐类构成“盐桥”来减小液体接界电势。
要达到工作电流零的条件,必须使电池在接近热力学平衡条件下工作。
测量可逆电池的电动势不能直接用伏特计来测量。
所以要准确测定电池的电动势,只有在电流无限小的情况下进行,所采用的对消法就是根据这个要求设计的。
2、对消法测定原电池电动势原理在待测电池上并联一个大小相等,方向相反的外加电势差,这样待测电池中没有电流通过,外加电动势的大小即等于待测电池的电动势。
装置如下:Ew -工作电源,E N -标准电池,Ex -待测电池;R-调节电阻,Rx-待测电池电动势补偿电阻,R N -标准电池电动势补偿电阻;K -转换电键,G -检流计。
3、电极:1、标准氢电极:电极电势的绝对值无法测定,手册上所列的电极电势均为相对电极电势,即以标准氢电极作为标准(标准氢电极是氢气压力为101325Pa,溶液中H+为1,其电极电动势规定为零)。
物理化学教案新疆大学化学化工学院物理化学教研室刘月娥第九章可逆电池电动势及其应用9.1 可逆电池和可逆电极一、可逆电池必须满足两个必要条件:(1)该化学反应可逆,即当E > E外时,电池放电;当E < E外时,电池充电(2)能量的转移可逆(I → 0)Cu – Zn电池E > E外时放电,为原电池(-) Zn – 2e- → Zn2+ (+) Cu2+ + 2e-→ Cu电池反应:Zn + Cu2+ = Zn2+ + CuE < E外时充电,为电解池(-) Zn2+ + 2e-→ Zn (+) Cu – 2e- → Cu2+电池反应:Zn2+ + Cu = Zn + Cu2+说明:充放电时,电极反应和电池反应互为可逆反应,并且当I → 0时能量的转变也是可逆的。
Zn-Cu H2SO4溶液电池E > E外时放电,为原电池(-) Zn – 2e-→ Zn2+ (+) 2H+ + 2e-→ H2(p)电池反应:Zn + 2H+ = Zn2+ + H2(p)E < E外时充电,为电解池(-) 2H+ + 2e-→ H2(p) (+) Cu – 2e-→ Cu2+电池反应:Cu + 2H+ = H2(p) + Cu2+说明:不互为可逆反应注意:(1)并不是所有反应可逆的电池都是可逆电池(如E外>>E)(2)丹尼尔电池实际上并不是可逆电池(因为存在离子的扩散),可插入盐桥处理;严格地说,凡是具有两个不同电解质溶液接界的电池都是热力学不可逆的。
二、可逆电极和电极反应可逆电极的种类12.3掌握:(1)可逆电极 写出电极反应(2)电极反应 设计出可逆电极,并判断属于第几类电极9.2 电动势的测定不能直接用伏特计测量原因:(1)伏特计显示需通过电流,致使化学反应发生,则不为可逆电池。
(2)电池本身有内阻,测出的只是两极间的电势差。
波根多夫对消法(补偿法) AC AH E E sx = AC AH E E s x ⋅= 标准电池韦斯顿标准电池特点:稳定、温度系数小、重现性好、高度可逆 负极:镉汞齐(含镉5-14%)Cg(Hg)(12.5%) – 2e - → Cd 2+(a +) + Hg(l) 正极:Hg(l)与Hg 2SO 4(s)的糊状体Hg 2SO 4(s) + 2e - → 2Hg(l) + -24SO (a -)电池反应:Cd(Hg)(12.5%)+Hg 2SO 4(s)+8/3H 2O = CdSO 4⋅8/3H 2O(s)+2Hg(l) 注意:(1)正负极不要接反 (2)切勿倒置(-)Cd(Hg)(12.5%)| CdSO 4⋅8/3H 2O(s) | CdSO 4(a) | CdSO 4⋅8/3H 2O(s) | Hg 2SO 4(s)+ Hg(l) (+)9.3 电池的书写方法及电动势的取号一、可逆电池的书写方法 1. 负极-左边(氧化作用),正极-右边(还原作用)2. ―|‖表示不同物相的界面,有接界电势(电极-溶液,溶液-溶液)存在;―||‖表示盐桥,液接电势可忽略E j →03. 物质-化学式,标明温度(不标明指298.15K )、压力(不标明指p θ)、物态及活度(a, s 、l 、g(依附的不活泼金属))切记:各化学式及符号的排列顺序要真实反映电池中各种物质的原来接触顺序。