(二) 可逆电池电动势
- 格式:doc
- 大小:201.50 KB
- 文档页数:6





可逆电池电动势及应用可逆电池是指在一定条件下,电池的氧化还原反应既可以正向进行,也可以逆向进行,进而可以通过外加电势来实现电能的存储和释放。
可逆电池的电动势是指在电池没有电流通过时,测得的产生的电动势。
可逆电池的电动势主要是由电极反应引起的。
在可逆电池中,每一个电极都有自己的电对,可以分别写出其电对的反应方程式。
例如,在可逆电池中,如果正极是铜,负极是锌,则其电对可以写作:Cu2+ + 2e- -> Cu (正极反应)Zn -> Zn2+ + 2e- (负极反应)在可逆电池中,正极与负极之间既可以发生正极反应,也可以发生负极反应。
当外加电势为正极时,正极反应发生;当外加电势为负极时,负极反应发生。
当外加电势为零时,正负极反应同时发生,而且它们的速率相等。
因此,在可逆电池中,电化学动力学状态迅速达到平衡状态,电池的电动势不会因为正负极反应到达平衡而发生变化。
应用方面,可逆电池具有以下几个方面的重要应用。
1. 电能存储和释放:可逆电池是一种可充放电电池,可以通过外加电势电化学反应的正向和逆向来在化学能和电能之间进行转换。
电池在充电状态下将电能转化为化学能,而在放电状态下将化学能转化为电能。
可逆电池被广泛应用于手机、笔记本电脑、电动车等各种移动设备中,能够实现电能的高效存储和释放。
2. 电源备份:可逆电池的典型例子是蓄电池,它们能够储存电能并在需要时释放出来。
蓄电池被应用于各种场合,如UPS电源、太阳能和风能储能系统、汽车启动电池等。
蓄电池的高可逆性和长寿命使得它们成为电力系统的备用电源,确保供电的稳定性和可靠性。
3. 温度控制:可逆电池也被应用于温度控制的设备中,如恒温器和温度计。
可逆电池在恒温器中起到稳定温度的作用,通过测量温度引起的电动势差,来调整继电器的工作状态,从而实现恒定的温度控制。
4. 电化学分析:可逆电池的电动势在电化学分析中也具有重要的应用价值。
通过测量可逆电池的电动势变化,可以对溶液中的阳离子或阴离子进行定量分析。

(二) 电化学热力学与可逆电池电动势将锌板浸入硫酸锌溶液,将铜板浸入硫酸铜溶液,中间用多孔陶瓷隔开,就构成了丹尼尔(Daniell )电池。
该电池中发生的反应Zn + Cu 2+ −→ Zn 2+ + Cu 是一个典型的氧化还原反应(redox reaction ),当其在电池中发生时,则可在正负极间形成约1.5 V 的电势差,并对外输出电能。
化学反应与电化学反应两者为什么不同?如何将一个反应设计成电池而使之对外输出电功?电极间的电势差是如何形成的?输出的电功与体系化学能变化之间有何关系?这些问题都要由电化学来回答。
所谓电化学(electrochemistry)就是研究化学现象与电现象之间的关系,以及电能与化学能之间相互转化规律的科学。
电化学反应需在电化学装置中才能发生。
将化学能转化为电能的装置称为原电池(galvanic cell),将电能转化成电能的装置称为电解池(electrolytic cell)。
无论原电池还是电解池通常的均由2个电极和对应的电解质溶液构成。
电极的命名有2种,即正负极和阴阳极。
其中,电势高的一极称为正极,电势低的为负极;发生氧化反应的一极是阳极,而发生还原反应的是负极。
例如,图7.15中,Zn 电极电势低,为负极,发生氧化反应Zn −→ Zn 2+ +2e -,是阳极;而Cu 电极电势高,是正极,发生还原反应Cu 2+ +2e -−→ Cu ,所以是阴极。
对于原电池和电解池,电极名称的对应关系如表7.7 所示。
表7.7 原电池和电解池的电极名称对应关系原电池 电解池 电势 高低 高 低 正极负极 正极 负极 反应 还原氧化 氧化 还原 阴极 阳极 阳极 阴极§7.6 可逆电池的设计1.原电池设计的原理通常的氧化还原反应在电池中发生时,会拆成单纯的氧化反应(oxidation reaction )和还原反应(reduction reaction )在两个电极上分别发生,如上例:负 极:Zn −→ Zn 2+ + e 2-正 极:Cu 2+ + e 2-−→ Cu总反应:Zn + Cu 2+ −→ Zn 2+ + Cu在电极上发生的反应称为电极反应(electrode reaction ),也称半反应(half reaction),因为它们仅是完整氧化还原反应的一半。

可逆电池电动势的测定实验报告实验报告:可逆电池电动势的测定一、实验目的1.掌握可逆电池电动势测定的原理和方法。
2.学习使用电位差计测量电池电动势。
3.理解可逆电池电动势与反应物质、温度等因素的关系。
二、实验原理可逆电池是指在一定条件下,能够完全逆向恢复到初始状态的电池。
可逆电池的电动势是指电池在开路状态下正负极之间的电位差,是电池反应的重要参数之一。
本实验采用标准电池和待测电池进行电动势的测量,通过比较两者的差异,可以得到待测电池的电动势。
三、实验步骤1.准备实验器材:电位差计、标准电池、待测电池、电阻箱、恒温水槽、温度计、电解质溶液等。
2.将电位差计与标准电池和待测电池连接,调整电阻箱阻值,使得电位差计指示为零。
3.将标准电池和待测电池放入恒温水槽中,记录温度。
4.根据实验原理,计算标准电池的电动势E0(已知)。
5.按照相同条件,测量待测电池的电动势E1。
6.根据测量结果,计算待测电池的电动势E1(未知)。
7.分析实验数据,得出实验结论。
四、实验结果与数据分析1.标准电池的电动势E0=1.018V(已知)。
2.待测电池的电动势E1=1.015V(未知)。
3.比较标准电池和待测电池的电动势,发现两者相差较小,说明待测电池的电动势较为准确。
4.分析实验数据,发现可逆电池的电动势与反应物质、温度等因素有关。
随着反应物质浓度的降低或温度的升高,电动势会相应减小。
这表明可逆电池的反应速率与电动势密切相关。
5.通过本实验,我们掌握了可逆电池电动势的测定方法,学会了使用电位差计进行电动势的测量,加深了对可逆电池工作原理的理解。
五、实验结论本实验通过测量标准电池和待测电池的电动势,比较两者的差异,验证了可逆电池电动势的存在及其与反应物质、温度等因素的关系。
实验结果表明,随着反应物质浓度的降低或温度的升高,电动势会相应减小。
这表明可逆电池的反应速率与电动势密切相关。
通过本实验,我们进一步加深了对可逆电池工作原理的理解,掌握了可逆电池电动势的测定方法。


可逆电池电动势的测定实验报告实验目的:掌握利用可逆电池的电动势进行测定的方法,探究电动势与浓度、温度的关系。
实验器材:标准氯化银电极、0.1mol/L AgNO3溶液、电解池、热水槽、温度计、万用表、导线等。
实验原理:可逆电池是指电极间反应完全可逆的电池,在理想状况下,可逆电池的电动势与电极间的化学势差相等。
因此,可逆电池可以用来测量其他电池电动势或溶液中离子的标准电位。
实验步骤:1.将标准氯化银电极置于电解池中,并将电解池连接至万用表的正负极。
2.将电解池中注入0.1mol/L AgNO3溶液,使电极完全浸没其中。
3.将电解池置于热水槽中,通过热水槽中的温度计调节溶液的温度。
记录温度。
4.在稳定温度的条件下,打开万用表的电源开关,等待电动势稳定后记录电动势。
5.将温度调节至不同的数值,重复步骤4并记录相应的电动势和温度。
实验结果:温度(℃)电动势(V)200.78300.80400.82500.84600.86实验分析:根据实验结果,我们可以发现随着温度的升高,电动势的数值也逐渐增加。
这是因为随着温度的升高,反应速率也加快,更多的电子参与了氯化银的还原,从而增加了电池的电动势。
实验结论:根据实验结果,我们可以得出结论:电动势与温度呈正相关关系。
这一结论在工业应用中具有重要意义,因为在实际使用电池的过程中,温度的变化会影响电动势的稳定性,从而对电池的性能产生影响。
实验中可能存在的误差:1.离子浓度的变化未考虑。
溶液中的Ag+浓度可能随着反应过程发生变化,影响电动势的测量结果。
2.极化现象的影响。
在实验过程中,电解池可能发生了极化现象,导致电极反应不完全,并影响电动势的测定结果。
3.万用表的误差。
万用表的精度限制了电动势测量结果的准确性。
为减小误差,可以采取以下措施:1.在实验过程中定期检查溶液中的Ag+浓度,保持其稳定。
2.进行电化学预处理,减小电解池的极化现象。
3.使用高精度的电位计或泳报仪进行电动势测量,提高测量结果的准确性。

电池的可逆电动势名词解释电池是一种将化学能转化为电能的装置。
它是由一个或多个电池单元组成的,每个电池单元包含两个电极(一个负极和一个正极),它们之间通过电解质连接。
电池的可逆电动势是指在没有电流流动时,电池中负极和正极之间的露脱电位差。
本文将解释电池的可逆电动势的含义以及影响因素。
可逆电动势是指在理想条件下,电池在无电流通过的情况下能够实现的最大电势差。
这个电势差是由电池中发生的在正极和负极之间的化学反应引起的。
当没有电流流过电池时,电池的正极和负极之间存在一个全面停留的平衡态,这时可测量到的电势差即为电池的可逆电动势。
两个主要影响电池可逆电动势的因素是离子活性和温度。
离子活性是指溶液中的化学物质含量,它影响电池中的化学反应速率,并直接影响到电池中正极和负极之间的电位差。
温度则会影响化学反应速率,并改变电池中的离子扩散速度,因此也会对电池的可逆电动势产生影响。
电池的可逆电动势是电池性能的重要指标之一。
较高的可逆电动势意味着电池具有更高的化学反应能力,能够产生更大的电势差。
这也意味着电池能够提供更高的电流和更稳定的电压输出。
因此,对于需要高电压和高电流输出的应用,选择具有较高可逆电动势的电池是非常关键的。
然而,实际情况下,电池的可逆电动势是很难完全实现的。
在真实的工作条件下,由于电流流动和能量转化的不可避免的损耗,电池中会存在一定的内部电阻,并引起电池的电压下降。
这被称为电池的极化。
极化的程度取决于电流的大小和电池内部的反应速率。
因此,实际的电池电动势会小于可逆电动势。
要提高电池的可逆电动势,可以通过优化电池的设计和使用更高效的电极材料来实现。
例如,选择更高活性的化学物质作为正负极材料,提高电池中的反应速率和离子迁移速度。
此外,还可以通过优化电解质的种类和浓度,调整温度等控制因素来改善电池的可逆电动势。
总而言之,电池的可逆电动势是指在理想条件下,电池在无电流流动时可以达到的最大电势差。
该电势差受离子活性和温度等因素的影响。
第九章可逆电池电动势将化学能转化为电能的装置称原电池,根据热力学上可逆过程和不可逆过程的概念,原电池可区分为可逆电池不可逆电池可逆电池可揭示化学能转变为电能的最高极限,为此重点讨论之。
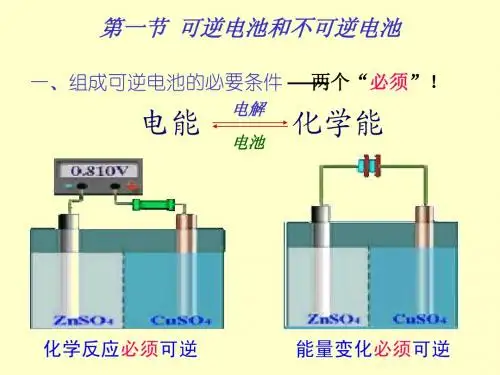
在可逆电池中,系统自由能的降低(△rGm)T.P等于系统对外所作的最大电功Wr′,此时,两电极间电势差达最大值,称为电池的电动势E,其间关系为(△rGm)T.P= Wr′=-nFE若反应物质的量为1mol时,则(△rGm)T.P=-zFE那么,什么是可逆电池呢?§9.1可逆电池和可逆电极1.可逆电池必须具备的条件(1)电池放电反应与充电反应必须互为逆反应。
对电池a当E>V,电池放电时Zn极(负):Zn-2e=Zn2+(氧)Cu极(正):Cu2++2e= Cu (还)放电反应:Zn+ Cu2+= Zn2++ Cu (自)当E<V,电池充电时Zn极(阴):Zn2++2e=Zn (还)Cu极(阳):Cu-2e= Cu2+(氧)充电反应:Zn2++ Cu= Zn+ Cu2+(非)可见电池a的充、放电反应互为逆反应。
图(略)但对电池b,当E>V,电池放电时Zn极(负):Zn-2e=Zn2+(氧)Cu极(正):2H++2e=H2(还)放电反应:Zn+2H+= Zn2++ H2(自)当E<V,电池充电时Zn极(阴):2H++2e=H2(还)Cu极(阳):Cu-2e= Cu2+(氧)充电反应:Cu+2H+= Cu2++ H2(非)可见,电池b的充、放电反应不为逆反应,因此,它不可能是可逆电池。
(2)电池所通过的电流必须为无限小。
并不是任何充放电的反应互为逆反应的电池都是可逆电池。
据热力学可逆过程概念,只有当E与V相差无限小dE,即V=E±dE使通过的电流无限小,才不会有电功不可逆地转化为热的现象。
这样,放电时,电池作最大有效功,充电时,消耗电功最小。
只有同时满足以上两个条件的电池才是可逆电池。
也就是可逆电池在充、放电时,不仅物质的转化是可逆的,而且能量的转化也是可逆的。
第九章 可逆电池的电动势及其应用教学目的与要求:使学生了解和掌握电池过程的热力学函数改变m m m S H G ∆∆∆,,与电功、电动势的关系,了解电动势产生的原因和熟悉电化学的惯用符号;熟练地从所给电池、电极写出有关的电化学反应方程式以及根据所给化学反应设计原电池;掌握电池电动势、电极电势的能斯特方程与电动势测定的应用。
石化学能转变为电能的装置称为原电池或电池。
如果这个转变过程是在热力学上的可逆的条件下进行的,则这个电池称为可逆电池。
在等温等压及可逆的条件下,系统Gibbs 自由能的减少等于系统所作的最大非体积功.()max,,f pT W G =∆如果非膨胀功只是电功,则上式可以写成()nEF W G f p T -==max ,,∆式中为电池输电荷的物质的量,单位为mol ,E 为可逆电池的电动势,单位为V ,F 是Faraday 常数。
如果电池在放电的过程中,按反应式发生了1=ξmol 的化学反应,系统的Gibbs 自由能的变化为()zEFnEFG pT m-=-=ξ∆,或中为按所写的电极反应,当反应进度1=ξmol 时,反应式中电子的计量系数,其单位为1。
上式是一个重要的关系式,是联系热力学和电化学的一个桥梁,可以使人们通过对可逆电池的电动势的测定等电化学方法求得电池反应的各种热力学函数的改变量。
同时上式也揭示了化学能转变为电能的最高限度,为改善电池性能或研制新的化学电源提供了理论依据。
重点与难点:电池过程和热力学的关系,即电池过程的热力学函数改变m m m S H G ∆∆∆,,与电功、电动势的关系以及可逆电池的条件, 电动势的测定;电池电动势产生的机理;电池电动势(包括浓差电池)的计算以及可逆电池电动势的测定的应用等。
§9.1 可逆电池与可逆电极要使化学能可逆的转化为电能,首先必要的条件是在电极上发生一个或几个氧化还原应(只有这样,才可能由电子的转移),并且是有适当的装置—电池,其次,这个电能与化学能之间的转换必须是可逆的。
(二) 电化学热力学与可逆电池电动势将锌板浸入硫酸锌溶液,将铜板浸入硫酸铜溶液,中间用多孔陶瓷隔开,就构成了丹尼尔(Daniell)电池。
该电池中发生的反应Zn + Cu2+−→ Zn2+ + Cu是一个典型的氧化还原反应(redox reaction),当其在电池中发生时,则可在正负极间形成约1.5 V的电势差,并对外输出电能。
化学反应与电化学反应两者为什么不同?如何将一个反应设计成电池而使之对外输出电功?电极间的电势差是如何形成的?输出的电功与体系化学能变化之间有何关系?这些问题都要由电化学来回答。
所谓电化学(electrochemistry)就是研究化学现象与电现象之间的关系,以及电能与化学能之间相互转化规律的科学。
电化学反应需在电化学装置中才能发生。
将化学能转化为电能的装置称为原电池(galvanic cell),将电能转化成电能的装置称为电解池(electrolytic cell)。
无论原电池还是电解池通常的均由2个电极和对应的电解质溶液构成。
电极的命名有2种,即正负极和阴阳极。
其中,电势高的一极称为正极,电势低的为负极;发生氧化反应的一极是阳极,而发生还原反应的是负极。
例如,图7.15中,Zn电极电势低,为负极,发生氧化反应Zn −→ Zn2+ +2e-,是阳极;而Cu电极电势高,是正极,发生还原反应Cu2+ +2e-−→ Cu,所以是阴极。
对于原电池和电解池,电极名称的对应关系如表7.7 所示。
表7.7 原电池和电解池的电极名称对应关系原电池电解池电势高低高低正极负极正极负极反应还原氧化氧化还原阴极阳极阳极阴极§7.6 可逆电池的设计1.原电池设计的原理通常的氧化还原反应在电池中发生时,会拆成单纯的氧化反应(oxidation reaction)和还原反应(reduction reaction)在两个电极上分别发生,如上例:负极:Zn −→ Zn2+ + e2-正极:Cu2+ + e2-−→ Cu总反应:Zn + Cu2+−→ Zn2+ + Cu在电极上发生的反应称为电极反应(electrode reaction),也称半反应(half reaction),因为它们仅是完整氧化还原反应的一半。
上述反应发生时,在负极Zn变成Zn2+进入溶液并将电子留在极板上,导致极板电子过剩,电势变负;在正极,溶液中的Cu2+到电极上夺取电子,导致铜板带正电,电势变正。
可见,电极间电势差的形成是电极上分别发生氧化、还原反应的必然结果。
因此,只要将一个反应拆成氧化和还原两个半反应,让它们在两个电极上solution4 partition图7.15 丹尼尔电池示意图分别发生,就可以获得电势差和电流。
这是原电池设计的基本思路。
电池(cell)由电极(electrode)和电解质溶液组成。
本章主要研究讨论可逆电池(reversible cell),即按照热力学可逆的方式将化学能转化为电能的装置......................。
研究可逆电池不仅可以建立热力学与电化学的联系,而且可以为热力学研究提供方法和手段。
已知在恒温恒压条件下,体系吉布斯函数的减小-(∆r G m)T,p等于体系对外所做的最大有效功W r'。
电功W’= -QE是一种重要的有效功。
如果反应过程中电子转移的物质的量为n,则通过电化学装置的电荷量Q= nF。
在可逆情况下,电池两电极间的电势差最大,称为该电池的可逆电池电动势(electromotive force, E),所以- (∆r G m)T,p = W r'= -nFE (7.23)该式将热力学参数(∆r G m)T,p与电化学参数(E)联系起来,是沟通电化学和热力学的桥梁和最重要的基本关系。
所谓电池的热力学可逆,包含两方面内容:反应可逆和过程可逆。
所谓反应可逆是指同一个电极在发生氧化或还原反应时,其反应式相同但反应方向相反;所谓过程可逆,是指不存在任何不可逆过程(如扩散过程),且电池电动势(E)与外加电压(V)之间只差无限小,从而使流经电池的电流强度为零或者无限小。
其中,过程可逆多数易于人为控制,而反应可逆则主要由体系自身性质决定,要构成可逆电池必须采用可逆电极(reversible electrode)。
2.可逆电极电极通常由导体、活性物质(active materials)和电解质溶液三部分构成。
例如,丹尼尔电池的负极是锌板加上硫酸锌溶液,记为Zn(s)⎢Zn2+(m),其中的“⎢”表示两相界面。
该电极中,锌板本身既是导体又是活性物质。
将电极理解为单一的金属板是错误的。
可逆电极必须满足单一电极(single electrode)、反应可逆和处于电化学平衡三个条件。
所谓单一电极是指只发生一种电化学反应的电极。
将Zn片插入硫酸,则Zn片上发生Zn→Zn2+ + 2e-和2H++ 2e-→H2两个反应,因此,Zn(s) ⎢H+(m)电极就不是单一电极。
同理,Na(s) ⎢Na+(aq, m)和Fe(s) ⎢Fe3+(m)均不是单一电极,因而也就不可逆。
而如果电极未达电化学平衡,则电极必然发生不可逆的变化而破坏电极的可逆性。
为方便判断电极的可逆性,现将主要的可逆电极种类介绍如下:1)第一类电极:该类电极以金属电极为代表。
所谓金属电极,就是将金属浸在含有该种金属离子的溶液中所构成的电极,以符号M⎢M z+表示,电极反应通式为Array M z+ + ze-−→M显然,丹尼尔电池的正负极都是金属电极。
通常将气体电极如氢电极:(Pt)H2(g, p)⎢H+(m)、汞齐电极如镉汞齐电极Cd(Hg)x⎢Cd2+(m)和配合物电极如Ag(s)⎢Ag(CN)2-也归入第一类电极。
该类电极的最大特点就是只有金属/电解质溶液一个界面,界面处不仅有电子的转移还伴有金属离子的转移。
氢电极、氧电极等气体电极的基本结构见图7.16。
是将作为导体的Pt片浸入含H+或OH-的溶液中,而后将H2、O2冲打图7.16氢电极示意图在其上构成。
用符号(Pt)H2(g, p)⎢H+(m)或(Pt)H2(g, p)⎢OH-(m),以及(Pt)O2(g, p)⎢OH-(m)或(Pt)O2(g, p)⎢H2O,H+(m)表示,其电极反应的写法也略有不同,如:氢电极:酸性:2H+(m)+2e-−→ H2;碱性:2H2O + 2e-−→ 2OH-(m)+ H2;氧电极:酸性:O2 + 2H2O + 4e-−→ 4OH-(m);碱性:O2 + 4H+(m) + 4e-−→2H2O第一类电极在电化学中有重要应用,如丹尼尔电池中的Cu(s)⎢Cu2+(m)和Zn(s)⎢Zn2+(m)电极,干电池中的负极Zn(s)⎢Zn(NH3)42+(m)和Zn(s)⎢Zn(OH)42-(m)电极等。
【习题】试写出下列第一类电极的电极反应(1) Sb(s)⎢Sb3+(m)(2) Zn(s)⎢Zn(NH3)42+(m)(3) Au(s) ⎢Au(CN)3-(m1), CN-(m2)(4) Pt (s), Cl2(g, p)⎢Cl-(m)【思考题】为什么Fe(s) ⎢Fe3+(m)不可能构成可逆电极?试写出其中发生的反应。
2)第二类电极:主要包括微溶盐电极和微溶氧化物电极。
以微溶盐电极为例,该类电极是在金属电极表面覆盖一薄层该金属的一种微溶盐,然后浸入含有该微溶盐阴离子的溶液中构成。
最常见的有甘汞电极Hg(l)-Hg2Cl2(s)⎢Cl-(m)和银—氯化银电极Ag(s)-AgCl(s)⎢Cl-(m)。
这种电极的特点是对微溶盐的阴离子可逆。
以Ag(s)-AgCl(s)⎢Cl-(m)为例,其电极反应为AgCl (s) + e-−→ Ag(s) + Cl-(m)该类电极有金属/微溶盐和微溶盐/电解质溶液两个界面,界面处不仅有电子转移而且有阴离子的转移。
该类电极在电化学研究中具有较重要的理论意义,因为绝大多数参比电极(reference electrode)都属于该类电极,另外,该类电极在可充电电池中的应用也相当广泛,如铅酸蓄电池中的负极Pb(s)⎢PbSO4(s) ⎢SO42-(m)和正极Pb(s)⎢PbO2(s)⎢PbSO4(s) ⎢SO42-(m)等。
【思考题】Hg(l)-Hg2Cl2(s)⎢Cl-(m)和Pb(s)⎢PbO2(s)⎢PbSO4(s)⎢SO42-(m)电极的导体、活性物质各是什么?试分别写出电极发生氧化和还原时的电极反应。
【习题】写出下列第二类电极的电极反应:(1) Pb(s)⎢PbSO4(s) ⎢SO42-(m)(2) Ni(s) ⎢NiOOH(s)⎢Ni(OH)2(s)⎢OH-(m)(3) Hg (l) ⎢HgO(s)⎢OH-(m)(4) Ag (s) ⎢Ag2O(s)⎢OH-(m)3)第三类电极:又称氧化还原电极,是将惰性金属如铂片插入含有某种离子(或化合物)的两种不同氧化态的溶液中而构成的,最典型的例子是(Pt)⎢Fe3+(m1), Fe2+(m2)电极,其电极反应为Fe3+(m1) + e-−→ Fe2+(m2)该类电极只有一个固/液界面,界面处只有..电子的转移,金属片只起传导电流的作用而不参与电极反应。
该类电极在电分析化学(electroanalysis)、流体电池(fluid cell)和溶液中进行的电化学催化(electrocatalysis)研究中比较常见。
(5) Sb(s)-Sb2O3(s)⎪ H2O, H+(m)(6) (Pt)O2(g)⎪ H+(m)(7) Na(Hg x)⎪ Na+(m) (8) (Pt)H2(g)⎪OH-(m)(9) (Pt)⎪ Cr3+, Cr2O72-, H+(m) (10) (Pt)⎪ Sn4+, Sn2+(m)3.电池表达式所谓电池的表达方式就是采用人为规定的一些符号来表示电池组成的式子。
例如,图7.15所示的丹尼尔电池就可以简单地用下列表达式表示:Zn(s) ⎢Zn2+(m1) ⎪⎢Cu2+(m2) ⎢Cu(s)表达式要比采用图7.15的图示形式简单方便得多。
在书写电池表达式时,通常需遵循以下几个规定:1)以化学式表示电池中各种物质的组成,并注明固(s)、液(l)、气(g)等物态。
对气体还要注明压力(p),对溶液需注明浓度(m)或活度(a);2)以单竖线“⎢”表示不同物相间的界面。
用双竖线“⎪⎢”表示盐桥。
书写电池表达式时要求各化学式及符号的排列顺序要真实反映电池中各种物质的接触次序;3)电池的负极写在左方,正极写在右方。
4. 可逆电池的设计采用可逆电极构成的电池,在其他条件满足要求的情况下,可以构成可逆电池。
根据可逆电池设计的原理,可逆电池的设计可按以下步骤进行:1)拆分氧化还原反应,确定电池的正、负极;2)确定电解质溶液的种类和是否使用盐桥;3)书写电池表达式,4)复核电池反应与给定反应是否一致。